Rata de lege pentru reacție SN2
mai Devreme am văzut că energia necesară pentru a ajunge la starea de tranzitie vine din energia cu care nucleofil și halogenuri de alchil se ciocnesc. Cerința pentru o coliziune înseamnă, de asemenea, că frecvența cu care nucleofilul și halogenura de alchil se ciocnesc este importantă. Această frecvență este controlată în principal prin concentrare.,

dacă concentrația halogenurii de alchil este ridicată, atunci vor exista multe oportunități pentru ca un nucleofil să se ciocnească cu o moleculă de halogenură de alchil. Rata reacției va crește proporțional cu creșterea concentrației de halogenură de alchil. În acest caz, se spune că reacția este de prim ordin în halogenură de alchil. În mod similar, o creștere a concentrației nucleofile va duce la o creștere proporțională a ratei, astfel încât reacția este, de asemenea, de prim ordin în nucleofile., În general, rata depinde de concentrația ambilor reactanți, iar reacția se spune că este de ordinul doi. Acest lucru poate fi rezumat în ecuația ratei sau în Legea ratei.
Rate = k
este comportamentul de ordinul doi (cerința ca două molecule să se ciocnească în starea critică de tranziție) care este desemnat de „2” în SN2.,pe scurt, vedem că pentru reacția SN2:
- reacția este „concertată” – are doar un pas în mecanism
- viteza de reacție depinde de concentrația atât a electrofilului (halogenura de alchil sau similară), cât și a nucleofilului.
- nucleofilul atacă ” partea din spate „a electrofilului, cu grupul care pleacă din”față”., Acest lucru înseamnă, de asemenea, că, dacă părăsesc grupul se pleacă de la un carbon chirali, stereochimia la care centrul este inversat,
SN1 reacție
Un al doilea model pentru un nucleofil substituție reacția se numește ‘disociativă”, sau ” SN1 mecanismul: în această imagine, C-X bond pauze în primul rând, înainte de nucleofil abordări:

Acest lucru duce la formarea unui carbocationul: pentru centrale de carbon are doar trei obligațiuni, poartă o taxa oficială de +1., Reamintim că un carbocationul-ar fi imaginat ca sp2hybridized, cu tv cu (trigonal plane) geometrie. Perpendicular pe planul format de cei trei orbitali hibrizi sp2 este un orbital p gol, nehidridizat.

În cel de-al doilea pas al doi-pas reacție, nucleofil atacuri de gol, pentru electron foame’ p orbital de carbocationul pentru a forma o nouă legătură și a reveni carbon tetraedric de geometrie.,

am văzut că reacțiile SN2 rezultă în mod specific în inversarea stereochimiei la Centrul electrofil de carbon. Cum rămâne cu rezultatul stereochimic al reacțiilor SN1? În reacția modelului SN1 prezentată mai sus, grupul care pleacă disociază complet din vecinătatea reacției înainte ca nucleofilul să înceapă atacul. Deoarece grupul care pleacă nu mai este în imagine, nucleofilul este liber să atace din ambele părți ale electrofilului carbocation planar, hibridizat sp2., Aceasta înseamnă că aproximativ jumătate din timp produsul are aceeași configurație stereochimică ca materia primă (păstrarea configurației) și aproximativ jumătate din timpul stereochimiei a fost inversat. Cu alte cuvinte, produsul a devenit racemic și optic inactiv. De exemplu, bromura de alchil terțiară de mai jos ar fi de așteptat să formeze un amestec racemic de alcooli R și S după o reacție SN1 cu apa ca nucleofil care intră.,

Exercițiu
Desenați structura de intermediar în două etape nucleofil substituție reacția de mai sus.,Show Soluție
În reacție SN1 vom vedea un exemplu de un intermediar de reacție, un concept foarte important în studiul unor mecanisme de reacție organic, care a fost introdus pentru prima dată în Capitolul 5 Reamintim că multe reacții organice nu apar într-un singur pas; mai degrabă, ele sunt suma a două sau mai discrete bond-formarea / bond-rupere pași, și implică tranzitorii specii intermediare care să reacționeze foarte rapid., Reacția SN1 implică atât o etapă de heteroliză, cât și o etapă de coordonare, precum și (de obicei) cel puțin o etapă acido-bazică. Specia carbocation este intermediarul reactiv în reacția SN1. O diagramă de energie potențială pentru o reacție SN1 arată că intermediarul carbocation poate fi vizualizat ca un fel de „vale de munte” în calea reacției, mai mare în energie decât atât reactantul, cât și produsul, dar mai mic în energie decât cele două stări de tranziție.,

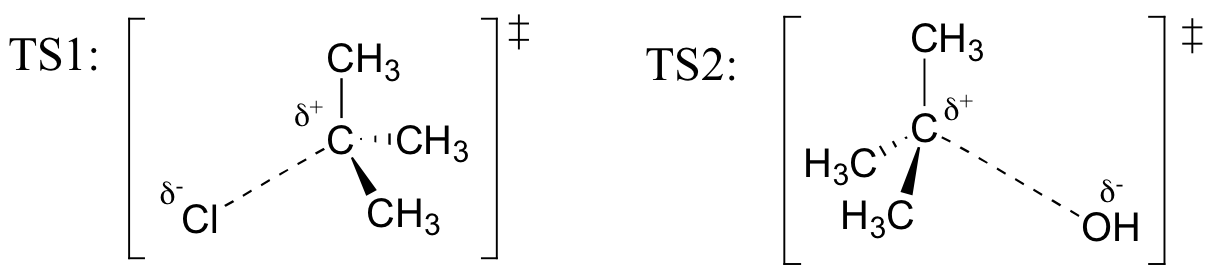
exercițiu
desenează structuri reprezentând TS1 și TS2 în reacția de mai sus. Utilizați Convenția solid / dash wedge pentru a afișa trei dimensiuni.
– mi Amintesc (de la Hammond postulat) că primul heterolysis pas de reacție de mai sus, în care două specii încărcate sunt formate dintr-o moleculă neutră, este mult mai lent din doi pași, și este, prin urmare, rata de determinare., Acest lucru este ilustrat de diagrama energiei, unde energia de activare pentru prima etapă este mai mare decât cea pentru a doua etapă. De asemenea, reamintim că o reacție SN1 are cinetică de prim ordin, deoarece etapa de determinare a ratei implică o moleculă care se desparte, nu două molecule care se ciocnesc.luați în considerare două substituții nucleofile care apar necatalizate în soluție. Să presupunem că reacția A este SN2, iar reacția B este SN1., Preziceți, în fiecare caz, ce s-ar întâmpla cu rata reacției dacă concentrația nucleofilului ar fi dublată, în timp ce toate celelalte condiții au rămas constante.

multe reacții SN1 sunt dintr-o clasă denumită solvoliză, unde o moleculă de solvent participă la reacție ca nucleofil. Reacția SN1 a bromurii de alil în metanol este un exemplu de ceea ce am numi metanoliză, în timp ce dacă apa este solventul, reacția ar fi numită hidroliză., În astfel de reacții care utilizează un nucleofil neîncărcat, este necesară o etapă acido-bazică după etapa de coordonare, pentru a elimina H+ și a forma produsul final neîncărcat.

deoarece apa și alcoolii sunt nucleofili relativ slabi, este mai puțin probabil să reacționeze într-un mod SN2.