Taxa lei para a reação SN2
Anterior vimos que a energia necessária para atingir o estado de transição vem a energia com a qual o nucleophile e o haleto de alquilo colidem. O requisito para uma colisão também significa que a frequência com a qual o nucleófilo e o haleto de alquilo colidem é importante. Esta frequência é principalmente controlada pela concentração.,
Se a concentração do haleto de alquilo for elevada, então haverá muitas oportunidades para um nucleófilo colidir com uma molécula de haleto de alquilo. A taxa de reação aumentará proporcionalmente à medida que a concentração de haleto de alquilo é feita mais elevada. Quando este é o caso, diz-se que a reação é de primeira ordem em haleto de alquilo. Similarmente, um aumento na concentração nucleófila resultará em um aumento proporcional na taxa, de modo que a reação também é de primeira ordem em nucleófilo., No geral, a taxa depende da concentração de ambos os reagentes, e a reação é dita ser de segunda ordem. Isto pode ser resumido na equação de taxa ou lei de taxa.
Rate = k
é o comportamento de segunda ordem (requisito para duas moléculas colidirem no estado crítico de transição) que é designado pelo “2” em SN2.,
A reação SN2
Em resumo, vemos que para a reação SN2:
- A reação é “concertada” – ele tem apenas um passo no mecanismo
- A taxa de reação depende da concentração de ambos os electrophile (o haleto de alquilo ou similar) e o nucleophile.
- o nucleófilo ataca o ” lado de trás “do eletrófilo, com o grupo deixando as folhas da”frente”., Isso também significa que, se a saída do grupo está saindo a partir de um carbono quiral, a estereoquímica em que o centro é invertido,
A reação SN1
Um segundo modelo para um nucleophilic substituição de reação é o chamado “dissociativo”, ou “SN1′ mecanismo: nesta foto, o C-X bond quebras de primeira, antes que a nucleophile abordagens:

Isto resulta na formação de um carbocation: porque a central de carbono, tem apenas três títulos, dá um formal de carga de +1., Lembre-se que uma carbocação deve ser retratada como sp2hybridized, com geometria plana (trigonal planar). Perpendicular ao plano formado pelos três orbitais híbridos sp2 é um orbital p vazio e não-hidratado.

no segundo passo desta reacção de dois passos, o nucleófilo ataca o vazio, ‘faminto de elétrons’ p orbital da carbocação para formar uma nova ligação e devolver o carbono à geometria tetraédrica.,

vimos que reações SN2 resultam especificamente na inversão da estereoquímica no centro de carbono eletrofílico. E o resultado estereoquímico das reações do SN1? No modelo de reação SN1 mostrado acima, o grupo que deixa dissocia-se completamente da vizinhança da reação antes que o nucleófilo comece seu ataque. Como o grupo de saída não está mais na imagem, o nucleófilo está livre para atacar de ambos os lados do planar, carbocation electrophile hibridizado sp2., Isto significa que cerca da metade do tempo o produto tem a mesma configuração estereoquímica que o material de base (retenção da configuração), e cerca da metade do tempo a estereoquímica foi invertida. Por outras palavras, o produto tornou-se racémico e opticamente inactivo. Como um exemplo, o brometo de alquilo terciário abaixo seria esperado para formar uma mistura racêmica de álcoois R E S após uma reação SN1 com água como o nucleófilo.,

Draw the structure of the intermediate in the two-step nucleophilic substitution reaction above.,Mostrar a Solução
Na reação SN1 vemos um exemplo de uma reação intermediária, um conceito muito importante no estudo dos mecanismos de reação orgânica que foi introduzido pela primeira vez no Capítulo 5 Recordar que muitas reações orgânicas não ocorrem em uma única etapa; em vez disso, eles são a soma de dois ou mais discretos bond-a formação / bond-quebrando passos, e envolvem transitória intermédio de espécies que reagem muito rapidamente., A reação SN1 envolve um passo de heterólise e um passo de coordenação, bem como (geralmente) pelo menos um passo ácido-base. A espécie carbocation é o intermediário reativo na reação SN1. Um diagrama de energia potencial para uma reação SN1 mostra que o carbocation intermediário pode ser visualizado como uma espécie de “vale da montanha”, no caminho da reação, maior de energia do que o reagente e produto, mas de menor energia do que os dois estados de transição.,

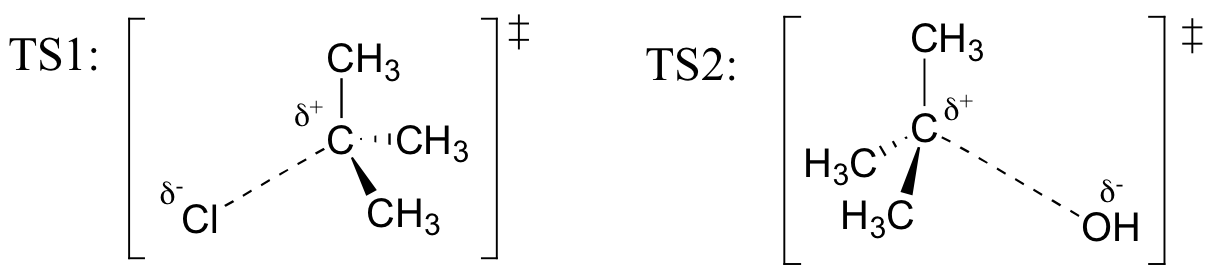
desenhar estruturas que representem TS1 e TS2 na reacção acima. Use a Convenção solid/dash wedge para mostrar três dimensões.
a recuperação (a partir do postulado de Hammond) que o primeiro heterolysis etapa da reação acima, em que dois cobrado espécies são formadas a partir de uma molécula neutra, é muito mais lenta das duas etapas, e, portanto, é avaliá-determinação., Isto é ilustrado pelo diagrama de energia, onde a energia de ativação para o primeiro passo é maior do que a energia para o segundo passo. Também lembre-se que uma reação SN1 tem cinética de primeira ordem, porque o passo de determinação da taxa envolve uma molécula se separando, Não duas moléculas colidindo.
exercício
considerar duas substituições nucleofilicas que ocorrem não analisadas em solução. Suponha que a reação A é SN2, e a reação B é SN1., Prever, em cada caso, o que aconteceria à taxa de reação se a concentração do nucleófilo fosse duplicada, enquanto todas as outras condições permanecessem constantes.

Muitas reações SN1 são de uma classe que são referidos como solvolysis, onde uma molécula de solvente participa da reação como um nucleophile. A reação de SN1 do brometo de alilo em metanol é um exemplo do que nós chamaríamos de metanólise, enquanto que se a água é o solvente a reação seria chamada de hidrólise., Em reações como esta que usam um nucleófilo não carregado, um passo ácido-base é necessário após o passo de coordenação, a fim de remover H+ e formar o produto final não carregado.

porque a água e os álcoois são nucleófilos relativamente fracos, eles são menos propensos a reagir de uma forma SN2.