prawo szybkości reakcji SN2
wcześniej widzieliśmy, że energia potrzebna do osiągnięcia stanu przejściowego pochodzi z energii, z którą zderzają się nukleofil i halogenek alkilowy. Wymóg kolizji oznacza również, że ważna jest częstotliwość, z jaką zderzają się nukleofil i halogenek alkilowy. Częstotliwość ta jest przede wszystkim kontrolowana przez stężenie.,

Jeśli stężenie halogenku alkilu jest wysokie, wtedy będzie wiele możliwości zderzenia nukleofila z cząsteczką halogenku alkilu. Szybkość reakcji wzrośnie proporcjonalnie, ponieważ stężenie halogenku alkilu jest wyższe. W takim przypadku reakcja jest uważana za pierwszą w kolejności w halogenku alkilu. Podobnie wzrost stężenia nukleofilowego spowoduje proporcjonalny wzrost szybkości, więc reakcja jest również pierwszego rzędu w nukleofilach., Ogólnie rzecz biorąc, szybkość zależy od stężenia obu reagentów, a reakcja jest mówi się, że drugiego rzędu. Można to podsumować w równaniu stawki lub prawie stawki.
Rate = k
jest to zachowanie drugiego rzędu (Wymaganie zderzenia dwóch cząsteczek w krytycznym stanie przejściowym), które jest oznaczane przez „2” w SN2.,
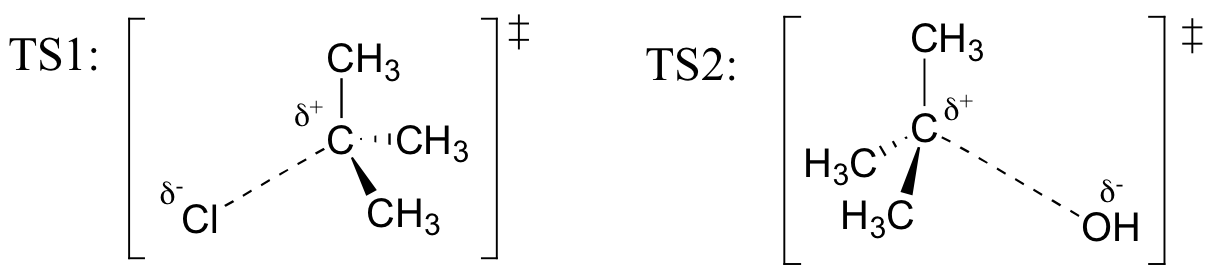
reakcja SN2
podsumowując, widzimy, że dla reakcji SN2:
- reakcja jest „uzgodniona” – ma tylko jeden etap w mechanizmie
- szybkość reakcji zależy od stężenia zarówno elektrofilu (halogenku alkilu lub podobnego), jak i nukleofila.
- nukleofil atakuje „tylną stronę” elektrofilu, a grupa odchodząca od „przedniej”., Oznacza to również, że jeśli grupa odchodząca odchodzi od chiralnego węgla, stereochemia w tym centrum jest odwrócona,
reakcja SN1
drugi model reakcji substytucji nukleofilowej nazywa się mechanizmem”dysocjacyjnym”lub ” SN1″: na tym zdjęciu Wiązanie C-X zrywa się najpierw, zanim zbliża się nukleofil:

powoduje to powstanie karbokationu: ponieważ węgiel centralny ma tylko trzy wiązania, nosi formalny ładunek +1., Przypomnijmy, że karbokacja powinna być przedstawiona jako sp2hybridized, z geometrią płaską (trygonalną planarną). Prostopadle do płaszczyzny utworzonej przez trzy orbitale hybrydowe sp2 jest pusty, niehybrydiowany orbital P.

w drugim etapie tej dwuetapowej reakcji nukleofil atakuje pusty, 'głodny elektronów' orbital P karbokacji, tworząc nowe wiązanie i zwracając węgiel do geometrii czworościennej.,

widzieliśmy, że reakcje SN2 wynikają konkretnie z inwersji stereochemii w elektrofilowym centrum węgla. Co ze stereochemicznym wynikiem reakcji SN1? W pokazanym powyżej modelu reakcji SN1 Grupa odchodząca całkowicie dysocjuje z otoczenia reakcji przed rozpoczęciem ataku nukleofila. Ponieważ grupa opuszczająca nie jest już na zdjęciu, nukleofil może atakować z obu stron planarnego, hybrydyzowanego elektrofila karbokatalizacyjnego sp2., Oznacza to, że około połowa czasu produkt ma taką samą konfigurację stereochemiczną jak materiał wyjściowy( zachowanie konfiguracji), a około połowa czasu stereochemia została odwrócona. Innymi słowy, produkt stał się racemiczny i optycznie nieaktywny. Jako przykład można oczekiwać, że trzeciorzędowy bromek alkilowy poniżej utworzy racemiczną mieszaninę alkoholi R I S po reakcji SN1 z wodą jako nadchodzącym nukleofilem.,

ćwiczenie
narysuj strukturę półproduktu w dwuetapowej reakcji substytucji nukleofilowej powyżej.,Pokaż rozwiązanie
Przypomnijmy (z postulatu Hammonda), że pierwszy etap heterolizy powyższej reakcji, w którym dwa naładowane gatunki są utworzone z neutralnej cząsteczki, jest znacznie wolniejszy z dwóch etapów, a zatem jest określanie stawki., Jest to zilustrowane przez diagram energetyczny, gdzie energia aktywacji dla pierwszego etapu jest wyższa niż dla drugiego etapu. Przypomnijmy również, że reakcja SN1 ma kinetykę pierwszego rzędu, ponieważ etap determinujący szybkość polega na rozdzieleniu jednej cząsteczki, a nie zderzeniu dwóch cząsteczek.
ćwiczenie
rozważ dwie substytucje nukleofilowe, które występują w roztworze bez katalitycznym. Załóżmy, że reakcja a to SN2, a reakcja B to SN1., Przewidywać, w każdym przypadku, co stanie się z szybkością reakcji, jeśli stężenie nukleofilu zostanie podwojone, podczas gdy wszystkie inne warunki pozostaną stałe.

wiele reakcji SN1 należy do klasy, która jest określana jako solvolysis, gdzie cząsteczka rozpuszczalnika uczestniczy w reakcji jako nukleofil. Reakcja SN1 bromku allilu w metanolu jest przykładem tego, co nazwalibyśmy metanolizą, podczas gdy woda jest rozpuszczalnikiem reakcja byłaby nazywana hydrolizą., W reakcjach takich jak ta, w których wykorzystuje się nienaładowany nukleofil, potrzebny jest etap kwasowo-zasadowy po etapie koordynacji, w celu usunięcia H+ i utworzenia nienaładowanego produktu końcowego.

ponieważ woda i alkohole są stosunkowo słabymi nukleofilami, rzadziej reagują w sposób SN2.