Snelheidswet voor de SN2-reactie
eerder zagen we dat de energie die nodig is om de overgangstoestand te bereiken, afkomstig is van de energie waarmee het nucleofiel en het alkylhalide botsen. Het vereiste voor een botsing betekent ook dat de frequentie waarmee het nucleofiel en het alkylhalide botsen belangrijk is. Deze frequentie wordt voornamelijk bepaald door concentratie.,

als de concentratie van het alkylhalide hoog is, zullen er veel mogelijkheden zijn voor een nucleofiel om te botsen met een alkylhalidemolecuul. De reactiesnelheid neemt proportioneel toe naarmate de alkylhalogenideconcentratie hoger wordt. Wanneer dit het geval is wordt de reactie gezegd om eerste orde in alkylhalide te zijn. Ook een toename van de nucleofiele concentratie zal resulteren in een evenredige toename van de snelheid, dus de reactie is ook de eerste orde in nucleofiel., Over het geheel genomen hangt het tarief af van de concentratie van beide reactanten, en de reactie wordt gezegd om tweede orde te zijn. Dit kan worden samengevat in de tariefvergelijking of Tariefwet.
Rate = k
Het is de tweede orde gedrag (vereiste voor twee moleculen om te botsen in de kritieke overgangstoestand) die wordt aangeduid door de” 2 ” in SN2.,
de SN2-reactie
samengevat zien we dat Voor de SN2 – reactie:
- de reactie “onderling afgestemd” is-het heeft slechts één stap in het mechanisme
- de reactiesnelheid hangt af van de concentratie van zowel de elektrofiel (het alkylhalide of soortgelijk) als het nucleofiel.
- het nucleofiel valt de ” achterkant “van de elektrofiel aan, waarbij de leaving group van de”voorkant” vertrekt., Dit betekent ook dat als het verlaten van de groep is het verlaten van een chirale koolstof, de stereochemie bij dat centrum is omgekeerd,
De SN1 reactie
Een tweede model voor een nucleophilic substitutie-reactie is de zogenaamde ‘dis’, of ‘SN1 mechanisme: in deze foto, de C-X bond breekt eerst de nucleophile benaderingen:

Dit resulteert in de vorming van een carbocation: omdat de centrale koolstof heeft slechts drie obligaties, draagt een formele lading van +1., Bedenk dat een carbocatie moet worden afgebeeld als sp2hybride, met vlakke (trigonale vlakke) geometrie. Loodrecht op het vlak gevormd door de drie SP2 hybride orbitalen is een lege, ongehybride p orbitaal.

in de tweede stap van deze tweestapsreactie valt het nucleofiel de lege, ‘elektron hongerige’ p-orbitaal van de carbocatie aan om een nieuwe binding te vormen en de koolstof terug te brengen naar de tetraëdergeometrie.,

we zagen dat SN2-reacties specifiek resulteren in inversie van stereochemie in het elektrofiele koolstofcentrum. Hoe zit het met de stereochemische uitkomst van SN1 reacties? In het hierboven getoonde model SN1-reactie distantieert de leaving group zich volledig van de omgeving van de reactie voordat het nucleofiel zijn aanval begint. Omdat de leaving group niet meer in beeld is, is het nucleofiel vrij om aan te vallen van beide kanten van de planaire, SP2-gehybridiseerde carbocatie-elektrofiel., Dit betekent dat het product ongeveer de helft van de tijd dezelfde stereochemische configuratie heeft als het uitgangsmateriaal (behoud van configuratie), en ongeveer de helft van de tijd is de stereochemie omgekeerd. Met andere woorden, het product is racemisch en optisch inactief geworden. Als voorbeeld, het tertiaire alkylbromide hieronder zou naar verwachting een racemisch mengsel van R en S alcoholen na een SN1 reactie met water als inkomend nucleofiel vormen.,

oefening
teken de structuur van het tussenproduct in de tweestaps nucleofiele substitutiereactie hierboven.,Toon Oplossing
In de SN1-reactie zien we een voorbeeld van een reactie intermediair, een zeer belangrijk begrip in de studie van biologische reactie mechanismen die voor het eerst werd geïntroduceerd in Hoofdstuk 5 Herinneren dat vele belangrijke biologische reacties doen zich niet in één stap; integendeel, ze zijn de som van twee of meer discrete bond-vorming / bond-breken stappen, en het betrekken van voorbijgaande tussenliggende soorten die op te reageren zeer snel., De SN1-reactie impliceert zowel een heterolysestap als een coördinatiestap, evenals (gewoonlijk) ten minste één zuur-base-stap. De carbocatiesoort is het reactieve tussenproduct in de SN1-reactie. Een potentiaalenergiediagram voor een SN1-reactie laat zien dat het carbocatie-tussenproduct kan worden gevisualiseerd als een soort “bergdal” in het pad van de reactie, hoger in energie dan zowel de reactant als het product, maar lager in energie dan de twee overgangstoestanden.,

oefening
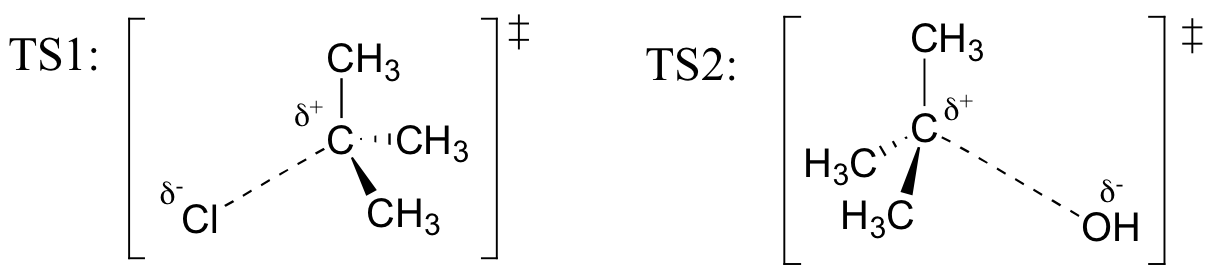
Draw structures representing TS1 and TS2 in the reaction above. Gebruik de solid / dash wedge conventie om drie dimensies te tonen.
Recall (Uit Hammond ‘ s postulaat) dat de eerste heterolysestap van de reactie hierboven, waarbij twee geladen soorten worden gevormd uit een neutraal molecuul, veel langzamer is van de twee stappen, en is daarom tariefbepalend., Dit wordt geïllustreerd door het energiediagram, waar de activeringsenergie voor de eerste stap hoger is dan die voor de tweede stap. Bedenk ook dat een SN1-reactie eerste ordekinetiek heeft, omdat de snelheidsbepalende stap één molecuul omvat die zich uit elkaar splitst, niet twee molecules die botsen.
oefening
beschouw twee nucleofiele substituties die niet-gekatalyseerd in oplossing voorkomen. Neem aan dat reactie a SN2 is en reactie B SN1., Voorspel, in elk geval, wat er zou gebeuren met de snelheid van de reactie als de concentratie van het nucleofiel zou worden verdubbeld, terwijl alle andere voorwaarden constant bleven.

veel SN1-reacties behoren tot een klasse die solvolyse wordt genoemd, waarbij een oplosmiddelmolecuul als nucleofiel aan de reactie deelneemt. De SN1-reactie van allylbromide in methanol is een voorbeeld van wat we methanolyse zouden noemen, terwijl als water het oplosmiddel is de reactie hydrolyse zou worden genoemd., In reacties als deze waarbij een niet-geladen nucleofiel wordt gebruikt, is na de coördinatiestap een zuur-base stap nodig om H+ te verwijderen en het niet-geladen eindproduct te vormen.

omdat water en alcoholen relatief zwakke nucleofielen zijn, is het minder waarschijnlijk dat ze op een SN2-manier reageren.