loi de vitesse pour la réaction SN2
Nous avons vu précédemment que l’énergie nécessaire pour atteindre l’état de transition provient de l’énergie avec laquelle le nucléophile et l’halogénure d’alkyle entrent en collision. L’exigence d’une collision signifie également que la fréquence avec laquelle le nucléophile et l’halogénure d’alkyle en collision est important. Cette fréquence est principalement contrôlée par la concentration.,

Si la concentration de l’halogénure d’alkyle est élevé, alors il y aura de nombreuses possibilités pour un nucléophile d’entrer en collision avec un halogénure d’alkyle molécule. La vitesse de la réaction augmente proportionnellement à mesure que la concentration en halogénure d’alkyle augmente. Lorsque c’est le cas, la réaction est dite de premier ordre dans l’halogénure d’alkyle. De même, une augmentation du nucléophile concentration entraînera une augmentation proportionnelle du taux, de sorte que la réaction est également de premier ordre dans nucléophile., Dans l’ensemble, le taux dépend de la concentration des deux réactifs, et la réaction est dite de second ordre. Cela peut être résumé dans l’équation de taux ou loi de taux.
Rate = k
c’est le comportement du second ordre (exigence pour que deux molécules entrent en collision dans l’état de transition critique) qui est désigné par le « 2” dans SN2.,
La réaction SN2
En résumé, nous voyons que pour la réaction SN2:
- La réaction est « concertée” – il n’a qu’une étape dans le mécanisme
- La vitesse de réaction dépend de la concentration à la fois de l’électrophile (l’halogénure d’alkyle ou similaires) et le nucléophile.
- le nucléophile attaque la « face arrière” de l’électrophile, le groupe partant partant du « front”., Cela signifie également que si le groupe partant part d’un carbone chiral, la stéréochimie à ce centre est inversée,
la réaction SN1
un deuxième modèle pour une réaction de substitution nucléophile est appelé le mécanisme »dissociatif », ou « SN1 »: dans cette image, la liaison C-X se rompt en premier, avant que le nucléophile s’approche:

il en résulte la formation d’un carbocation: comme le carbone central n’a que trois liaisons, il porte une charge formelle de +1., Rappelons qu’un carbocation doit être représenté comme sp2hybridized, avec une géométrie plane (plan trigonale). Perpendiculaire au plan formé par les trois orbitales hybrides sp2 est une orbitale p vide, non hybridée.

dans la deuxième étape de cette réaction en deux étapes, le nucléophile attaque l’orbitale p vide, « avide d’électrons » du carbocation pour former une nouvelle liaison et ramener le carbone à la géométrie tétraédrique.,

Nous avons vu que les réactions SN2 entraînent spécifiquement une inversion de la stéréochimie au centre du carbone électrophile. Qu’en est-il du résultat stéréochimique des réactions SN1? Dans le modèle de réaction SN1 montré ci-dessus, le groupe partant se dissocie complètement du voisinage de la réaction avant que le nucléophile ne commence son attaque. Puisque le groupe partant n’est plus dans l’image, le nucléophile est libre d’attaquer de chaque côté du carbocation électrophile plan, hybridé sp2., Cela signifie qu’environ la moitié du temps, le produit a la même configuration stéréochimique que le matériau de départ (rétention de configuration), et environ la moitié du temps de la stéréochimie a été inversé. En d’autres termes, le produit est devenu racémique et optiquement inactif. À titre d’exemple, on s’attendrait à ce que le bromure d’alkyle tertiaire ci-dessous forme un mélange racémique d’alcools R et S après une réaction SN1 avec de l’eau comme nucléophile entrant.,

exercice
dessinez la structure de l’intermédiaire dans la réaction de substitution nucléophile en deux étapes ci-dessus.,Montrer la Solution
dans la réaction SN1, nous voyons un exemple d’intermédiaire réactionnel, un concept très important dans l’étude des mécanismes réactionnels organiques le chapitre 5 rappelle que de nombreuses réactions organiques importantes ne se produisent pas en une seule étape; elles sont plutôt la somme de deux ou plusieurs étapes discrètes de formation / rupture de liaison et impliquent des espèces intermédiaires transitoires qui réagissent très rapidement., La réaction SN1 implique à la fois une étape d’hétérolyse et une étape de coordination, ainsi que (généralement) au moins une étape acide-base. L’espèce carbocation est l’intermédiaire réactif dans la réaction SN1. Un diagramme d’énergie potentielle pour une réaction SN1 montre que l’intermédiaire carbocation peut être visualisé comme une sorte de” vallée de montagne » dans le trajet de la réaction, plus élevée en énergie que le réactif et le produit mais plus faible en énergie que les deux états de transition.,

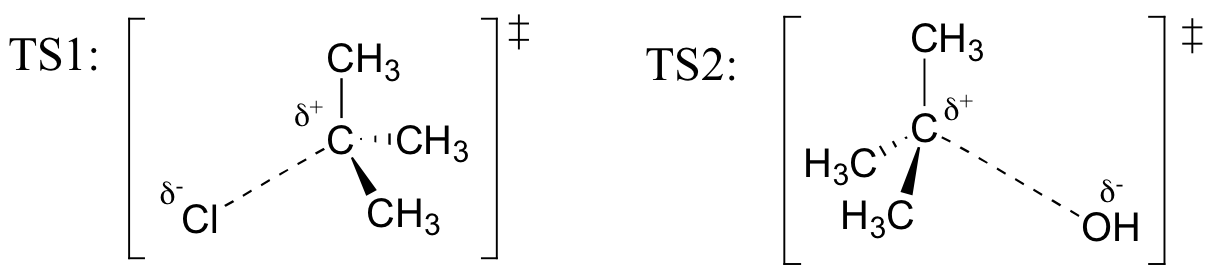
Exercice
Tirage au sort des structures représentant TS1 et TS2 dans la réaction ci-dessus. Utilisez la Convention solid/dash wedge pour afficher trois dimensions.
rappeler (d’après le postulat de Hammond) que la première étape d’hétérolyse de la réaction ci-dessus, dans laquelle deux espèces chargées sont formées à partir d’une molécule neutre, est beaucoup plus lent des deux étapes, et est donc déterminant du taux., Ceci est illustré par le diagramme d’énergie, où l’énergie d’activation pour la première étape est plus élevé que pour la deuxième étape. Rappelons également qu’une réaction SN1 a une cinétique de premier ordre, car l’étape de détermination de la vitesse implique la séparation d’une molécule et non la collision de deux molécules.
exercice
considérons deux substitutions nucléophiles qui se produisent non catalysées en solution. Supposons que la réaction a soit SN2 et que la réaction B soit SN1., Prédire, dans chaque cas, ce qui arriverait à la vitesse de la réaction si la concentration du nucléophile était doublée, alors que toutes les autres conditions restaient constantes.

de nombreuses réactions SN1 sont d’une classe appelée solvolyse, où une molécule de solvant participe à la réaction en tant que nucléophile. La réaction SN1 du bromure d’allyle dans le méthanol est un exemple de ce que nous appellerions la méthanolyse, alors que si l’eau est le solvant, la réaction serait appelée hydrolyse., Dans des réactions comme celle-ci qui utilisent un nucléophile non chargé, une étape acide-base est nécessaire après l’étape de coordination, afin d’éliminer H+ et de former le produit final non chargé.

étant donné que l’eau et les alcools sont des nucléophiles relativement faibles, ils sont moins susceptibles de réagir de manière SN2.