Rate-laki SN2-reaktiolle
Aiemmin näimme, että siirtymätilan saavuttamiseen tarvittava energia tulee energiasta, jolla nukleofiili ja alkyylihalidi törmäävät. Törmäysvaatimus tarkoittaa myös sitä, että taajuus, jolla nukleofiili ja alkyylihalidi törmäävät, on tärkeä. Tämä esiintymistiheys määräytyy ensisijaisesti pitoisuuden mukaan.,

Jos alkyylihalidin pitoisuus on korkea, nukleofiilille on monia mahdollisuuksia törmätä alkyylihalidimolekyyliin. Reaktion nopeus kasvaa suhteellisesti, kun alkyylihalidipitoisuus suurenee. Tällöin reaktion sanotaan olevan alkyylihalidissa ensimmäinen kertaluku. Vastaavasti nukleofiilipitoisuuden nousu johtaa suhteelliseen nopeuteen, joten reaktio on myös ensimmäinen kertaluku nukleofiilissa., Kaiken kaikkiaan nopeus riippuu molempien reaktanttien pitoisuudesta, ja reaktion sanotaan olevan toista luokkaa. Tämä voidaan tiivistää korko yhtälö tai korko laki.
Rate = k
on toisen kertaluvun käyttäytyminen (vaatimus kahden molekyylin törmäämisestä kriittisessä siirtymätilassa), jonka SN2: ssa ”2” nimeää.,
SN2 – reaktio
tiivistettynä näemme, että SN2-reaktiossa:
- reaktio on ”concerted” – sillä on vain yksi askel mekanismissa
- reaktionopeus riippuu sekä elektrofiilin (alkyylihalidin tai vastaavan) että nukleofiilin pitoisuudesta.
- nukleofiili hyökkää elektrofiilin ”takapuolelle”, jolloin lähtevä ryhmä lähtee”edestä”., Tämä tarkoittaa myös sitä, että jos lähtevä ryhmä lähtee kiraalisesta hiilestä, stereokemia tuossa keskellä on käänteinen,
SN1-reaktio
nukleofiilisen substituutioreaktion toista mallia kutsutaan”dissosiatiiviseksi”tai” SN1 ”- mekanismiksi: tässä kuvassa C-X-sidos katkeaa ensin ennen nukleofiilien lähestymistä:

tämä johtaa karbokationin muodostumiseen: koska keskihiilellä on vain kolme sidosta, sillä on muodollinen varaus +1., Muista, että karbokationin olisi kuvattava sp2hybridized, Tasainen (trigonaalinen planar) geometria. Kohtisuorassa muodostuu kolme sp2-hybridi orbitaalit on tyhjä, unhybridized p kiertoradan.

toisessa vaiheessa tämä kaksivaiheinen reaktio, nucleophile hyökkäyksiä tyhjä, ’electron nälkäinen’ p kiertoradan, että carbocation muodostaa uuden bond ja palauttaa hiiltä tetraedri geometria.,

näimme, että SN2-reaktiot johtavat nimenomaan stereokemian inversioon elektrofiilisessa hiilikeskuksessa. Entä SN1-reaktioiden stereokemiallinen lopputulos? Edellä esitetyssä SN1-reaktiomallissa poistuva ryhmä hajoaa täysin reaktion läheisyydestä ennen kuin nukleofiili aloittaa hyökkäyksensä. Koska poistuva ryhmä ei ole enää kuvassa, nukleofiili on vapaa hyökkäämään planaarin kummaltakin puolelta, sp2-hybridisoituneesta karbokationielektrofiilistä., Tämä tarkoittaa, että noin puolet ajasta tuotteella on sama stereokemiallinen konfiguraatio kuin lähtöaineella (kokoonpanon retentio), ja noin puolet ajasta stereokemia on käännetty ylösalaisin. Toisin sanoen tuote on muuttunut raseemiseksi ja optisesti toimimattomaksi. Esimerkiksi jäljempänä olevan tertiäärisen alkyylibromidin oletetaan muodostavan R-ja S-alkoholien raseemisen seoksen SN1-reaktion jälkeen veden kanssa tulevana nukleofiilina.,

liikunta
Piirrä välituotteen rakenne yllä olevaan kaksivaiheiseen nukleofiiliseen substituutioreaktioon.,Näytä liuos
SN1-reaktiossa näemme esimerkin reaktiovälitteestä, joka on erittäin tärkeä käsite orgaanisten reaktiomekanismien tutkimuksessa, joka otettiin ensimmäisen kerran käyttöön Luku 5 muistuttaa, että monet tärkeät orgaaniset reaktiot eivät tapahdu yhdessä vaiheessa, vaan ne ovat kahden tai useamman erillisen sidoksen muodostavan / sidoksen rikkovan vaiheen summa, ja niihin liittyy ohimeneviä välilajeja, jotka reagoivat hyvin nopeasti., SN1-reaktioon liittyy sekä heterolyysivaihe että koordinaatiovaihe sekä (yleensä) ainakin yksi happopohjavaihe. Karbokationilaji on reaktiivinen Välituote SN1-reaktiossa. SN1-reaktion potentiaalienergiakaavio osoittaa, että karbokationiväli voidaan visualisoida eräänlaisena ”vuorilaaksona” reaktion tiellä, suurempana energiana kuin sekä reaktantti että tuote, mutta pienempänä energiana kuin kaksi siirtymätilaa.,

harjoitus
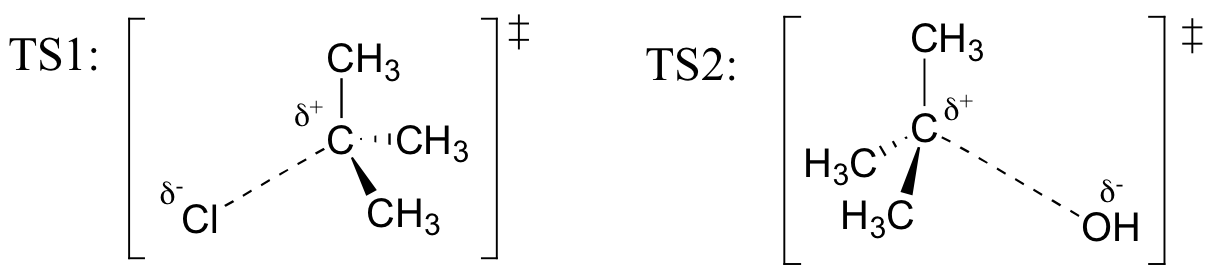
Vetorakenteet edustavat TS1: tä ja TS2: ta yllä olevassa reaktiossa. Käytä solid / dash kiila yleissopimus näyttää kolme ulottuvuutta.
Palauta (alkaen Hammond on olettamus), että ensimmäinen heterolysis vaiheen reaktio yläpuolella, jossa kaksi ladattu lajit ovat muodostettu neutraali molekyyli, on paljon hitaampi kaksi vaihetta, ja on siksi korko-määritettäessä., Tämä käy ilmi energiakaaviosta, jossa ensimmäisen vaiheen aktivointienergia on suurempi kuin toisen vaiheen. Muista myös, että SN1-reaktiolla on ensimmäisen kertaluvun kinetiikka, koska nopeuden määräävässä vaiheessa yksi molekyyli hajoaa, ei kaksi molekyyliä törmää toisiinsa.
liikunta
harkitse kahta nukleofiilista substituutiota, jotka esiintyvät liuoksessa analysoimattomina. Oletetaan, että reaktio A on SN2 ja reaktio B on SN1., Ennustaa, kussakin tapauksessa, mitä tapahtuisi, nopeus reaktion, jos pitoisuus nucleophile oli kaksinkertaistunut, kun kaikki muut olosuhteet pysyivät vakiona.

monet SN1-reaktiot kuuluvat solvolyysiin, jossa liuotinmolekyyli osallistuu reaktioon nukleofiilina. Allyylibromidin SN1-reaktio metanolissa on esimerkki niin sanotusta metanolyysistä, kun taas jos vesi on liuotin, reaktiota kutsuttaisiin hydrolyysiksi., Vuonna reaktioita, kuten tämä, joka käyttää varaukseton nucleophile, happo-emäs-vaiheen jälkeen tarvitaan koordinointia askel, jotta voidaan poistaa H+ ja muodostavat varauksettomia lopullinen tuote.
koska vesi ja alkoholit ovat suhteellisen heikkoja nukleofiileja, ne reagoivat vähemmän SN2-tavalla.