Rate law för SN2-reaktionen
Tidigare såg vi att den energi som krävs för att nå övergångstillståndet kommer från den energi som nukleofilen och alkylhalogen kolliderar med. Kravet på kollision innebär också att frekvensen med vilken nukleofilen och alkylhalogenid kolliderar är viktig. Denna frekvens styrs primärt av koncentration.,

om koncentrationen av alkylhaliden är hög kommer det att finnas många möjligheter för en nukleofil att kollidera med en alkylhalidmolekyl. Reaktionshastigheten ökar proportionellt eftersom alkylhalidkoncentrationen görs högre. När detta är fallet sägs reaktionen vara första ordningen i alkylhalid. På samma sätt kommer en ökning av nukleofilkoncentrationen att resultera i en proportionell ökning av hastigheten, så reaktionen är också första ordningen i nukleofil., Sammantaget beror hastigheten på koncentrationen av båda reaktanterna, och reaktionen sägs vara andra ordningen. Detta kan sammanfattas i rate equation eller rate law.
Rate = k
det är det andra ordningens beteende (krav på att två molekyler kolliderar i det kritiska övergångstillståndet) som betecknas med ”2” i SN2.,
SN2 – reaktionen
Sammanfattningsvis ser vi att för SN2-reaktionen:
- reaktionen är ”samordnad” – den har bara ett steg i mekanismen
- reaktionshastigheten beror på koncentrationen av både elektrofilen (alkylhaliden eller liknande) och nukleofilen.
- nukleofilen angriper elektrofilens ”baksida”, med den vänstra gruppen lämnar från ”framsidan”., Detta innebär också att om den avgående gruppen lämnar ett kiralt kol, är stereokemi vid det centret inverterat,
SN1-reaktionen
en andra modell för en nukleofil substitutionsreaktion kallas”dissociativ”eller” SN1 ”- mekanismen: i den här bilden bryts C-X-bindningen först innan nukleofilen närmar sig:

detta resulterar i bildandet av en karbocation: eftersom det centrala kolet bara har tre bindningar bär det en formell avgift på +1., Minns att en förgasning bör avbildas som sp2hybridized, med platt (trigonal plana) geometri. Vinkelrätt mot det plan som bildas av de tre SP2 hybrid orbitalerna är en tom, unhybridized p orbital.

i det andra steget i denna tvåstegsreaktion angriper nukleofilen den tomma, ’electron hungry’ p-omloppsbanan för att bilda en ny bindning och returnera kolet till tetraedrisk geometri.,

vi såg att SN2-reaktioner resulterar specifikt i inversion av stereokemi vid det elektrofila kolcentret. Vad sägs om det stereokemiska resultatet av SN1-reaktioner? I modellen SN1-reaktion som visas ovan dissocierar den lämnar gruppen helt från reaktionens närhet innan nukleofilen börjar sin attack. Eftersom den avgående gruppen inte längre finns i bilden är nukleofilen fri att attackera från vardera sidan av den plana, sp2-hybridiserade karbokationselektrofilen., Detta innebär att ungefär hälften av tiden produkten har samma stereokemiska konfiguration som utgångsmaterialet (lagring av konfiguration), och ungefär hälften av tiden stereokemi har inverterats. Med andra ord har produkten blivit racemisk och optiskt inaktiv. Som ett exempel förväntas tertiär alkylbromid nedan bilda en racemisk blandning av R-och s-alkoholer efter en SN1-reaktion med vatten som inkommande nukleofil.,

övning
Rita mellanstrukturen i den tvåstegs nukleofila substitutionsreaktionen ovan.,Visa lösning
i SN1-reaktionen ser vi ett exempel på en reaktion mellanliggande, ett mycket viktigt begrepp i studien av organiska reaktionsmekanismer som först infördes i kapitel 5 minns att många viktiga organiska reaktioner inte förekommer i ett enda steg; snarare är de summan av två eller flera diskreta bindningsbildande / bondbrytande steg och involverar övergående mellanliggande arter som fortsätter att reagera mycket snabbt., SN1-reaktionen innefattar både ett heterolyssteg och ett koordinationssteg, liksom (vanligtvis) minst ett syrabasbaserat steg. Carbocation-arten är den reaktiva intermediären i SN1-reaktionen. Ett potentiellt energidiagram för en SN1-reaktion visar att karbokationsintervallet kan visualiseras som en slags ”bergsdal” i reaktionens väg, högre i energi än både reaktant och produkt men lägre i energi än de två övergångsstaterna.,

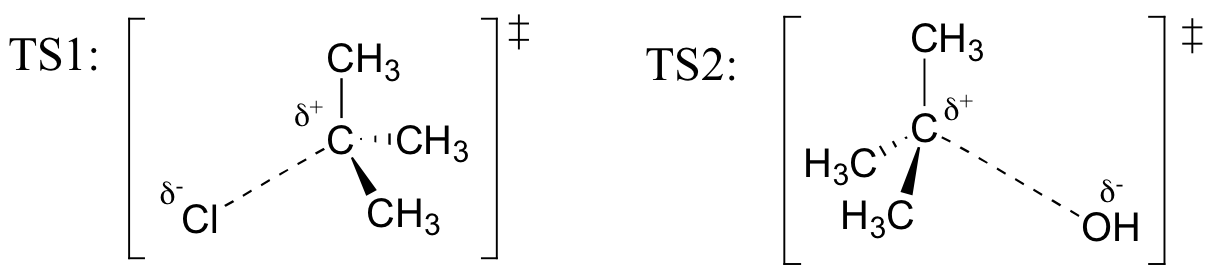
övning
Rita strukturer som representerar TS1 och TS2 i reaktionen ovan. Använd solid / dash wedge-konventionen för att visa tre dimensioner.
Recall (från Hammonds postulat) att det första heterolissteget av reaktionen ovan, där två laddade arter bildas från en neutral molekyl, är mycket långsammare av de två stegen och är därför hastighetsbestämande., Detta illustreras av energidiagrammet, där aktiveringsenergin för det första steget är högre än för det andra steget. Minns också att en SN1-reaktion har första ordningens kinetik, eftersom det hastighetsbestämande steget innebär att en molekyl splittras, inte två molekyler kolliderar.
Motion
överväga två nukleofila substitutioner som uppstår ocatalyzed i lösning. Antag att reaktion A är SN2, och reaktion B är SN1., Förutsäga i varje fall vad som skulle hända med reaktionshastigheten om koncentrationen av nukleofilen fördubblades, medan alla andra förhållanden förblev konstanta.

många SN1-reaktioner är av en klass som kallas solvolys, där en lösningsmedelsmolekyl deltar i reaktionen som en nukleofil. SN1-reaktionen av allylbromid i metanol är ett exempel på vad vi skulle kalla metanolys, medan om vatten är lösningsmedlet skulle reaktionen kallas hydrolys., I reaktioner som detta som använder en oladdad nukleofil behövs ett syrabassteg efter samordningssteget för att avlägsna H+ och bilda den oladdade slutprodukten.

eftersom vatten och alkoholer är relativt svaga nukleofiler är de mindre benägna att reagera på ett SN2-sätt.