Ratengesetz für die SN2-Reaktion
Früher haben wir gesehen, dass die Energie, die benötigt wird, um den Übergangszustand zu erreichen, aus der Energie stammt, mit der das nukleophile und das Alkylhalogenid kollidieren. Die Anforderung an eine Kollision bedeutet auch, dass die Häufigkeit, mit der das nukleophile und das Alkylhalogenid kollidieren, wichtig ist. Diese Frequenz wird hauptsächlich durch Konzentration gesteuert.,

Wenn die Konzentration des Alkylhalogenids hoch ist, besteht für ein Nucleophiles viele Möglichkeiten, mit einem Alkylhalogenidmolekül zu kollidieren. Die Reaktionsgeschwindigkeit steigt proportional an, wenn die Alkylhalogenidkonzentration erhöht wird. Wenn dies der Fall ist, soll die Reaktion in Alkylhalogenid erster Ordnung sein. In ähnlicher Weise führt eine Erhöhung der Nukleophilkonzentration zu einer proportionalen Erhöhung der Rate, so dass die Reaktion auch bei Nukleophilen erster Ordnung ist., Insgesamt hängt die Rate von der Konzentration beider Reaktanten ab, und die Reaktion soll zweiter Ordnung sein. Dies kann in der Rate Gleichung oder Rate Gesetz zusammengefasst werden.
Rate = k
Es ist das Verhalten zweiter Ordnung (Voraussetzung für die Kollision zweier Moleküle im kritischen Übergangszustand), das durch die“ 2 “ in SN2 bezeichnet wird.,
Die SN2-Reaktion
Zusammenfassend sehen wir, dass für die SN2 – Reaktion:
- Die Reaktion „abgestimmt“ ist-sie hat nur einen Schritt im Mechanismus
- Die Reaktionsgeschwindigkeit hängt von der Konzentration sowohl des Elektrophils (des Alkylhalogenids oder ähnlichem) als auch des Nukleophils ab.
- Das Nucleophile greift die „Rückseite“ des Elektrophils an, wobei die verlassende Gruppe von der „Vorderseite“abgeht., Dies bedeutet auch, dass, wenn die auslassende Gruppe von einem chiralen Kohlenstoff austritt, die Stereochemie in diesem Zentrum invertiert ist,
Die SN1-Reaktion
Ein zweites Modell für eine nukleophile Substitutionsreaktion wird als“dissoziativer“oder“ SN1 „- Mechanismus bezeichnet: In diesem Bild bricht die C-X-Bindung zuerst, bevor sich das Nukleophile nähert:

Dies führt zur Bildung einer Carbokation: Da der zentrale Kohlenstoff nur drei Bindungen aufweist, trägt er eine formelle Ladung von +1., Denken Sie daran, dass ein Carbocation als spikesybridized mit flacher (trigonaler planarer) Geometrie dargestellt werden sollte. Senkrecht zu der Ebene, die von den drei sp2 Hybrid-Orbitalen gebildet wird, befindet sich ein leeres, unhybridisiertes p-Orbital.

Im zweiten Schritt dieser zweistufigen Reaktion greift das Nukleophile das leere, ‚elektronenhungrige‘ p-Orbital der Carbokation an, um eine neue Bindung zu bilden und den Kohlenstoff in die tetraedrische Geometrie zurückzugeben.,

Wir haben gesehen, dass SN2-Reaktionen speziell zur Inversion der Stereochemie im elektrophilen Kohlenstoffzentrum führen. Was ist mit dem stereochemischen Ergebnis von SN1-Reaktionen? In der oben gezeigten SN1-Reaktion des Modells dissoziiert die Leaving-Gruppe vollständig aus der Nähe der Reaktion, bevor das Nucleophile seinen Angriff beginnt. Da die Abgangsgruppe nicht mehr im Bild ist, kann das Nucleophile von beiden Seiten des planaren, sp2-hybridisierten Carbokationselektrophilen frei angreifen., Dies bedeutet, dass etwa die Hälfte der Zeit, die das Produkt die gleiche stereochemische Konfiguration wie das Ausgangsmaterial hat (Beibehaltung der Konfiguration), und etwa die Hälfte der Zeit, in der die Stereochemie invertiert wurde. Mit anderen Worten, das Produkt ist racemisch und optisch inaktiv geworden. Als ein Beispiel würde erwartet, dass das tertiäre Alkylbromid unten eine racemische Mischung von R-und S-Alkoholen nach einer SN1-Reaktion mit Wasser als dem ankommenden Nukleophilen bildet.,

Zeichnen Sie die Struktur des Zwischenprodukts in der obigen zweistufigen nukleophilen Substitutionsreaktion.,Lösung anzeigen
In der SN1-Reaktion sehen wir ein Beispiel für ein Reaktionszwischenprodukt, ein sehr wichtiges Konzept bei der Untersuchung organischer Reaktionsmechanismen, das erstmals in Kapitel 5 eingeführt wurde Erinnern Sie sich daran, dass viele wichtige organische Reaktionen nicht in einem einzigen Schritt auftreten.vielmehr sind sie die Summe von zwei oder mehr diskreten bindungsbildenden / bindungsbrechenden Schritten und beinhalten vorübergehende Zwischenarten, die sehr schnell reagieren., Die SN1-Reaktion umfasst sowohl einen Heterolyseschritt als auch einen Koordinationsschritt sowie (üblicherweise) mindestens einen Säure-Basen-Schritt. Die Carbocation-Spezies ist das reaktive Zwischenprodukt in der SN1-Reaktion. Ein potenzielles Energiediagramm für eine SN1-Reaktion zeigt, dass das Carbocation-Intermediat als eine Art „Gebirgstal“ auf dem Weg der Reaktion visualisiert werden kann, das energiereicher ist als sowohl der Reaktant als auch das Produkt, aber energiereicher als die beiden Übergangszustände.,

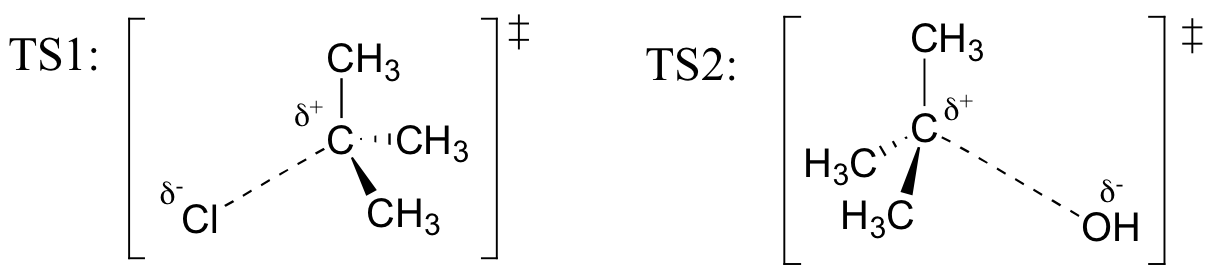
Zeichne Strukturen, die TS1 und TS2 in der obigen Reaktion darstellen. Verwenden Sie die Solid / Dash Wedge-Konvention, um drei Dimensionen anzuzeigen.
Erinnern Sie (aus Hammonds Postulat) daran, dass der erste Heterolyseschritt der obigen Reaktion, bei dem zwei geladene Spezies aus einem neutralen Molekül gebildet werden, viel langsamer von den beiden Schritten ist und daher geschwindigkeitsbestimmend ist., Dies wird durch das Energiediagramm veranschaulicht, in dem die Aktivierungsenergie für den ersten Schritt höher ist als die für den zweiten Schritt. Denken Sie auch daran, dass eine SN1-Reaktion Kinetik erster Ordnung hat, da der Schritt zur Geschwindigkeitsbestimmung ein Molekül spaltet und nicht zwei Moleküle kollidieren.
Betrachten Sie zwei nucleophile Substitutionen, die in Lösung unkatalysiert auftreten. Angenommen, Reaktion A ist SN2 und Reaktion B ist SN1., Sagen Sie jeweils voraus, was mit der Reaktionsgeschwindigkeit passieren würde, wenn die Konzentration des Nukleophils verdoppelt würde, während alle anderen Bedingungen konstant blieben.

Viele SN1-Reaktionen gehören zu einer Klasse, die als Solvolyse bezeichnet wird, wobei ein Lösungsmittelmolekül als Nukleophiles an der Reaktion teilnimmt. Die SN1-Reaktion von Allylbromid in Methanol ist ein Beispiel für das, was wir Methanolyse nennen würden, während, wenn Wasser das Lösungsmittel ist, die Reaktion Hydrolyse genannt würde., Bei solchen Reaktionen, die ein ungeladenes Nukleophiles verwenden, ist nach dem Koordinierungsschritt ein Säure-Basen-Schritt erforderlich, um H+ zu entfernen und das ungeladene Endprodukt zu bilden.

Da Wasser und Alkohole relativ schwache Nukleophile sind, reagieren sie weniger wahrscheinlich auf SN2-Weise.