Rangere lov for SN2 reaksjon
Tidligere så vi at den energien som kreves for å nå transition state kommer fra den energi som nucleophile og alkyl halide kolliderer. Kravet om en kollisjon betyr også at frekvensen som nucleophile og alkyl halide kolliderer er viktig. Denne frekvensen er først og fremst styrt av konsentrasjon.,

Hvis konsentrasjonen av alkyl halide er høy, så vil det være mange muligheter for en nucleophile å kollidere med en alkyl-halide molekyl. Hastigheten av reaksjonen vil øke proporsjonalt som alkyl halide konsentrasjon er laget høyere. Når dette er tilfelle, reaksjonen er sagt å være den første bestillingen i alkyl halide. Tilsvarende vil en økning i nucleophile konsentrasjon vil resultere i en forholdsmessig økning i pris, så reaksjonen er også første bestillingen i nucleophile., Totalt sett pris avhenger av konsentrasjonen av både reaktanter, og reaksjonen er sagt å være andre ordre. Dette kan oppsummeres i pris ligningen eller pris loven.
Pris = k
Det er den andre for atferd (kravet for to molekyler til å kollidere i den kritiske overgangen staten) som er merket med «2» i SN2.,
De SN2 reaksjon
I sammendraget, ser vi at for SN2 reaksjon:
- reaksjonen er «felles» – den har bare ett trinn i mekanismen
- reaksjonen pris avhenger av konsentrasjonen av både electrophile (den alkyl halide eller lignende) og nucleophile.
- nucleophile angrep på «baksiden» av electrophile, med å forlate gruppen går fra «front»., Dette betyr også at hvis de forlater gruppen reiser fra en chiral karbon, og stereokjemi på at senteret er invertert,
SN1 reaksjon
En annen modell for en nucleophilic substitusjon reaksjon er kalt «dissosiativ’, eller ‘SN1’ mekanisme: i dette bildet, C-X bond bryter først, før nucleophile tilnærminger:

Dette resulterer i dannelsen av en carbocation: fordi den sentrale karbon har bare tre obligasjoner, bærer det formelle ansvaret for +1., Husker at en carbocation bør være avbildet som sp2hybridized, med flatskjerm (trigonal plane) geometri. Vinkelrett på planet som dannes av de tre sp2 hybrid orbitals er en tom, ikke-hybridisert p-orbital.

I det andre trinnet av denne totrinns reaksjon, nucleophile angrep på tomt, ‘elektron sulten’ s orbital av carbocation å danne en ny bond og retur karbon til tetrahedral geometri.,

– Vi så at SN2 reaksjoner resultat spesielt i inversjon av stereokjemi på elektrofil karbon center. Hva om stereochemical utfallet av SN1 reaksjoner? I modellen SN1 reaksjon vist ovenfor, å forlate gruppen distanserer helt fra nærhet av reaksjon før nucleophile starter sitt angrep. Fordi forlater gruppen er ikke lenger i bildet, den nucleophile er gratis å angripe fra hver side av den plane, sp2-hybridiserte carbocation electrophile., Dette betyr at omtrent halvparten av den tiden produktet har samme stereochemical konfigurasjon som starter materiale (oppbevaring av konfigurasjon), og omtrent halvparten av tiden de stereokjemi har blitt invertert. Med andre ord, produktet har blitt racemisk og optisk inaktive. Som et eksempel, universitets-alkyl bromide nedenfor kan forventes å danne en racemisk blanding av R-og S-alkoholer etter en SN1 reaksjon med vann som innkommende nucleophile.,

Trening
Draw strukturen av den mellomliggende i to trinn nucleophilic substitusjon reaksjon ovenfor.,Vis Løsning
I SN1 reaksjon vi se et eksempel på en reaksjon middels et svært viktig begrep i studiet av organiske reaksjonsmekanismer, som først ble introdusert i Kapittel 5 Huske at mange viktige organiske reaksjoner oppstår ikke i et enkelt trinn; i stedet, de er summen av to eller flere atskilte bond-forming / bond-breaking trinn, og innebærer forbigående middels arter som går på å reagere svært raskt., Den SN1 reaksjon innebærer både en heterolysis trinn og en koordinering trinn, så vel som (vanligvis) minst ett av syre-base-trinn. Den carbocation arter er reaktiv, mellomliggende i SN1 reaksjon. En potensiell energi-diagram for en SN1 reaksjon viser at carbocation mellomliggende kan visualiseres som en slags «mountain valley» i veien for reaksjon, høyere energi enn både reaktant og produkt, men lavere energi enn de to overgang stater.,

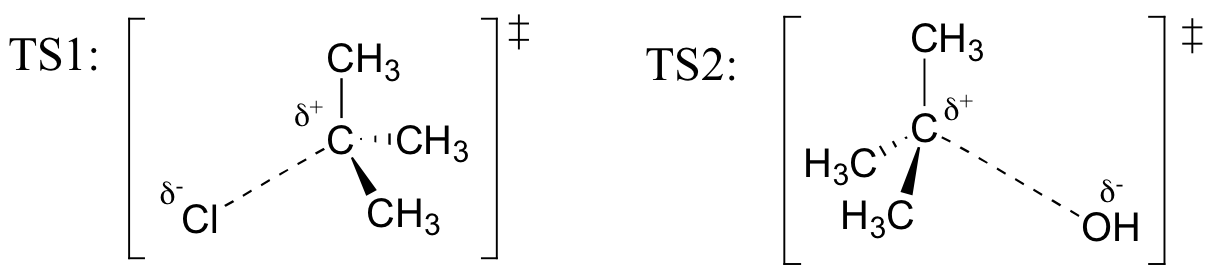
Trening
Tegne strukturer som representerer TS1 og TS2 i reaksjonen ovenfor. Bruk solid/dash kile-konvensjonen for å vise tre dimensjoner.
Tilbakekall (fra Hammond ‘ s postulat) som den første heterolysis trinn av reaksjonen ovenfor, der to belastet arter er dannet fra en nøytral molekyl, som er mye tregere av de to trinnene, og er derfor pris-bestemme., Dette er illustrert ved den energi diagram, der aktivisering energi for første trinn er høyere enn for andre trinn. Også huske at en SN1-reaksjonen første ordens kinetikk, fordi pris bestemme trinn innebærer ett molekyl splittet fra hverandre, ikke to molekylene kolliderer.
Trening
Vurdere to nucleophilic erstatninger som oppstår uncatalyzed i løsningen. Anta at En reaksjon er SN2, og reaksjonen B er SN1., Forutsi, i hvert enkelt tilfelle, hva som ville skje med hastigheten av reaksjonen hvis konsentrasjonen av nucleophile ble doblet, mens alle andre forhold holdt konstant.

Mange SN1 reaksjonene er av en klasse som er referert til som solvolysis, der et løsemiddel molekyl deltar i reaksjonen som en nucleophile. Den SN1 reaksjon av allyl bromide i metanol er et eksempel på hva vi ville kalle methanolysis, mens hvis vannet er solvent reaksjonen ville være kalles hydrolyse., I reaksjoner som dette som å bruke et ladet nucleophile, en syre-base-trinnet er nødvendig etter samordning trinn, for å fjerne H+ og danner ladet endelige produktet.

Fordi vann og alkohol er relativt svake nucleophiles, de er mindre tilbøyelige til å reagere i en SN2 mote.