Rate law pro SN2 reakci
dříve jsme viděli, že energie potřebná k dosažení přechodového stavu pochází z energie, se kterou se nukleofil a alkylhalogenid srazí. Požadavek na kolizi také znamená, že frekvence, s níž se nukleofil a alkylhalogenid srazí, je důležitá. Tato frekvence je primárně řízena koncentrací.,

Pokud je koncentrace alkylhalogenidu vysoká, pak bude mnoho příležitostí, aby se nukleofil srazil s molekulou alkylhalogenidu. Rychlost reakce se úměrně zvýší, protože koncentrace alkylhalogenidu je vyšší. V tomto případě je reakce považována za první objednávku v alkylhalogenidu. Podobně zvýšení koncentrace nukleofilů povede k přiměřenému zvýšení rychlosti, takže reakce je také první v nukleofilu., Celkově rychlost závisí na koncentraci obou reaktantů a reakce je považována za druhé pořadí. To lze shrnout do rovnice sazeb nebo zákona o sazbách.
Rychlost = k
To je druhého řádu chování (požadavek na dvě molekuly se srazí v kritický přechodový stav), který je označen „2“, v SN2.,
SN2 reakce.
stručně řečeno, vidíme, že pro SN2 reakci.
- reakce je „společné“ – má pouze jeden krok v mechanismu
- rychlost reakce závisí na koncentraci obou elektrofilem (alkyl halogenidu nebo podobné) a nukleofil.
- nukleofil napadá“ zadní stranu “ elektrofilu, přičemž odcházející skupina odchází z „přední“., To také znamená, že pokud se odstupující skupina odchází od chirální uhlík, stereochemií na to, že centrum je převrácený,
SN1 reakce
druhý model pro nucleophilic substitution reakce se nazývá ‚disociační“ nebo “ SN1 mechanismus: v tomto obrázku, C-X pouto se zlomí jako první, před nukleofil přístupy:

To má za následek vznik karbokation: protože centrální uhlík má pouze tři dluhopisy, nese formální náboj +1., Připomeňme, že karbokace by měla být zobrazena jako sp2hybridizovaná, s plochou (trigonální rovinnou) geometrií. Kolmo k rovině tvořené třemi hybridními orbitaly sp2 je prázdný, nehybridizovaný P orbital.

ve druhém kroku této dvoustupňové reakce nukleofil napadá prázdný, „elektronový hlad“ P orbital karbokace, aby vytvořil novou vazbu a vrátil uhlík do tetrahedrální geometrie.,

Jsme viděli, že SN2 reakce výsledek konkrétně v inverzi stereochemie na elektrofilní uhlík centrum. A co stereochemický výsledek SN1 reakcí? Ve výše uvedené reakci modelu SN1 se opouštěcí skupina zcela odděluje od blízkosti reakce před tím, než nukleofil zahájí útok. Vzhledem k tomu, že opouštěcí skupina již není na obrázku, nukleofil může volně zaútočit z obou stran planárního, sp2-hybridizovaného karbokačního elektrofilu., To znamená, že přibližně polovinu času má produkt stejnou stereochemickou konfiguraci jako výchozí materiál (retence konfigurace) a přibližně polovinu času, kdy byla stereochemie obrácena. Jinými slovy, produkt se stal racemickým a opticky neaktivním. Jako příklad lze očekávat, že terciární alkylbromid níže vytvoří racemickou směs R A S alkoholů po SN1 reakci s vodou jako příchozí nukleofil.,

Cvičení
Nakreslete strukturu meziproduktu ve dvou-krok nucleophilic substitution reakce výše.,Zobrazit řešení
V reakci SN1 vidíme příklad reakčního meziproduktu, což je velmi důležitý koncept ve studiu organických reakčních mechanismů, které byly poprvé zavedeny v reakci SN1.Kapitola 5 připomeňme, že mnoho důležitých organických reakcí se nevyskytuje v jediném kroku; spíše jsou součtem dvou nebo více diskrétních kroků vytváření vazeb / lámání vazeb a zahrnují přechodné mezilehlé druhy, které reagují velmi rychle., Reakce SN1 zahrnuje jak heterolýzní krok, tak koordinační krok, stejně jako (obvykle) alespoň jeden acidobazický krok. Karbokační druh je reaktivní meziprodukt v reakci SN1. Potenciální energetický diagram pro reakci SN1 ukazuje, že karbokační meziprodukt může být vizualizován jako druh „horského údolí“ v cestě reakce, vyšší v energii než reaktant i produkt, ale nižší v energii než dva přechodové stavy.,

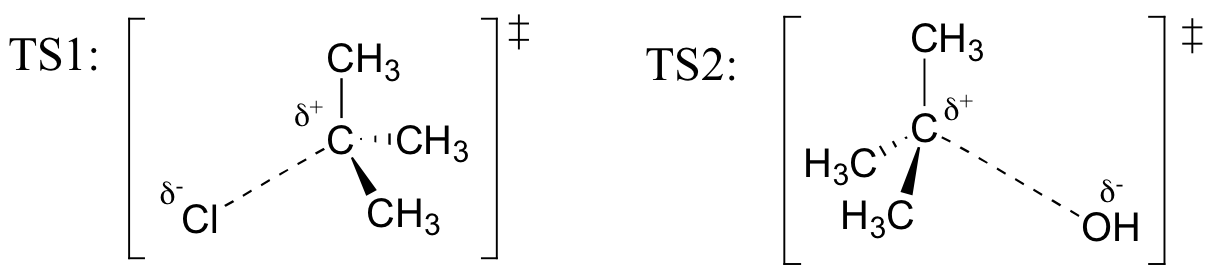
cvičení
nakreslete struktury představující TS1 a TS2 v reakci výše. Pomocí konvence solid / dash wedge zobrazte tři rozměry.
vyvolat (z hammondova postulátu), že první heterolýzní krok reakce výše, ve kterém jsou dva nabité druhy tvořeny z neutrální molekuly, je mnohem pomalejší ze dvou kroků, a proto je rychlost určující., To je ilustrováno energetickým diagramem, kde aktivační energie pro první krok je vyšší než energie pro druhý krok. Připomeňme také, že reakce SN1 má kinetiku prvního řádu, protože krok stanovení rychlosti zahrnuje rozdělení jedné molekuly od sebe, nikoli srážku dvou molekul.
cvičení
zvažte dvě nukleofilní substituce, které se vyskytují nekatalyzovaně v roztoku. Předpokládejme, že reakce a je SN2 a reakce B je SN1., V každém případě předpovídejte, co by se stalo s rychlostí reakce, kdyby se koncentrace nukleofilu zdvojnásobila, zatímco všechny ostatní podmínky zůstaly konstantní.

mnoho SN1 reakcí je třídy, která se označuje jako solvolýza, kde se molekula rozpouštědla podílí na reakci jako nukleofil. V SN1 reakce allyl bromid v methanolu je příkladem toho, co bychom nazvali methanolysis, zatímco pokud je rozpouštědlem voda reakce by se nazývá hydrolýza., V reakcích, jako je tato, které používají nezmapovaný nukleofil, je po koordinačním kroku nutný krok acidobazické, aby se odstranil H+ a vytvořil se nezmapovaný konečný produkt.

protože voda a alkoholy jsou relativně slabé nukleofily, je méně pravděpodobné, že reagují SN2 způsobem.