az SN2 reakció Sebességtörvénye
korábban láttuk, hogy az átmeneti állapot eléréséhez szükséges energia abból az energiából származik, amellyel a nukleofil és az alkil-Halid ütközik. Az ütközés követelménye azt is jelenti, hogy fontos a nukleofil és az alkil-Halid ütközésének gyakorisága. Ezt a frekvenciát elsősorban koncentráció vezérli.,

Ha az alkil-Halid koncentrációja magas, akkor sok lehetőség lesz arra, hogy egy nukleofil összeütközjön egy alkil-Halid molekulával. A reakció sebessége arányosan növekszik, mivel az alkil-Halid koncentrációja magasabb. Ebben az esetben a reakció az alkil-Halid első sorrendje. Hasonlóképpen a nukleofil koncentráció növekedése a sebesség arányos növekedését eredményezi, így a reakció a nukleofil első sorrendje is., Összességében a sebesség mindkét reagens koncentrációjától függ,és a reakció másodrendű. Ezt össze lehet foglalni az arányegyenletben vagy az aránytörvényben.
Rate = k
Ez a másodrendű viselkedés (két molekula kritikus átmeneti állapotban való ütközésének követelménye), amelyet az SN2 “2” jelöl.,
az SN2 reakció
összefoglalva azt látjuk, hogy az SN2 reakció esetében:
- a reakció “összehangolt” – csak egy lépése van a mechanizmusban
- a reakciósebesség mind az elektrofil (az alkil-Halid vagy hasonló), mind a nukleofil koncentrációjától függ.
- a nukleofil megtámadja az elektrofil “hátsó oldalát”, a kilépő csoport pedig az “elülső”., Ez azt is jelenti, hogy ha elhagyja a csoportot elhagyva egy királis szén, a stereochemistry a központ fordított,
Az SN1 reakció
A második modell nucleophilic szubsztitúciós reakció az úgynevezett ‘disszociatív” vagy “SN1’ mechanizmus: ezen a képen, a C-X bond szünetek előtt először a nucleophile megközelítések:

az eredmény kialakulását carbocation: mert a központi szén-csak három kötvények, viseli a vádemelés a +1., Emlékezzünk vissza, hogy a karbokációt SP2-ként kell ábrázolnihibridizált, lapos (trigonális sík) geometriával. A három sp2 hibrid orbitális által alkotott síkra merőleges egy üres, nem hidridizált p orbitális.

ennek a kétlépcsős reakciónak a második lépésében a nukleofil megtámadja a karbokáció üres, “elektronéhes” p pályáját, hogy új kötést képezzen, és visszaadja a szenet a tetraéderes geometriába.,

láttuk, hogy az SN2 reakciók kifejezetten a sztereokémia inverzióját eredményezik az elektrofil szénközpontban. Mi a helyzet az SN1 reakciók sztereokémiai eredményével? A fent bemutatott SN1 reakció modellben a kilépő csoport teljesen disszociál a reakció közeléből, mielőtt a nukleofil megkezdi támadását. Mivel a kilépő csoport már nincs a képen, a nukleofil szabadon támadhat a sík, sp2-hibridizált karbokációs elektrofil mindkét oldaláról., Ez azt jelenti, hogy a termék körülbelül fele ugyanolyan sztereokémiai konfigurációval rendelkezik, mint a kiindulási anyag (konfiguráció megtartása), és körülbelül a sztereokémia megfordításának fele. Más szóval, a termék racém és optikailag inaktív lett. Például az alábbi tercier alkil-bromid várhatóan R és S alkoholok racém keverékét képezi, miután az SN1 reakció vízzel, mint a bejövő nukleofil.,

gyakorlat
rajzolja meg a köztes szerkezetét a fenti kétlépcsős nukleofil szubsztitúciós reakcióban.,Térkép
az SN1 reakció példát láthatunk arra, hogy a reakció köztes, egy nagyon fontos fogalom a tanulmány a szerves reakció mechanizmus, hogy először be Fejezet 5 Emlékszem, hogy sok fontos szerves reakciók nem lépnek fel, egyetlen lépés; inkább, ezek összege a két vagy több különálló bond-képző / kötvény-breaking lépéseket, ami azt jelenti, átmeneti, köztes fajok rajta, hogy nagyon gyorsan reagál., Az SN1 reakció magában foglalja mind a heterolízis lépést, mind a koordinációs lépést, valamint (általában) legalább egy sav-bázis lépést. A karbokációs faj az SN1 reakció reaktív köztiterméke. Potenciális energia diagram egy SN1 reakció azt mutatja, hogy a carbocation közbenső is megjeleníthető, mint egyfajta “hegy-völgy” az út a reakció, nagyobb energia, mint mind a reagenshez kovalens kötéssel kapcsolódnak, illetve terméket, de alacsonyabb az energia, mint a két átmenet államokban.,

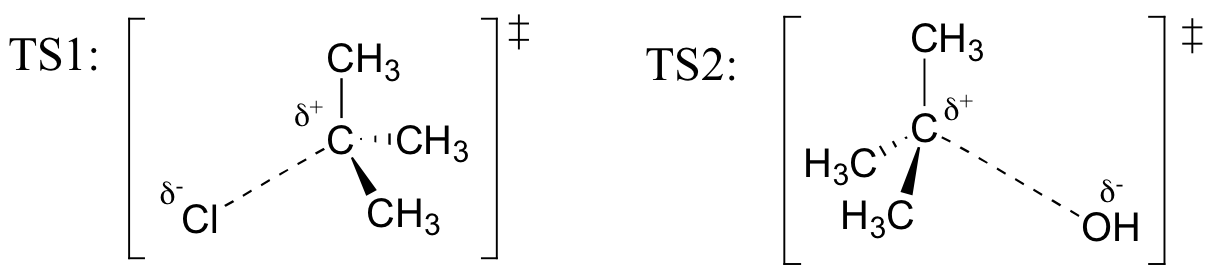
a fenti reakcióban a TS1-et és TS2-t képviselő szerkezetek rajzolása. Használja a solid / dash wedge egyezményt három dimenzió megjelenítéséhez.
Visszahívás (a Hammond posztulátum), hogy az első heterolysis lépés a fenti reakció, amelyben két feltöltött fajok alakulnak ki a semleges molekula, sokkal lassabban, a két lépést, ezért a sebesség-meghatározó., Ezt szemlélteti az energia diagram, ahol az aktiválási energia az első lépésben magasabb, mint a második lépésben. Emlékezzünk arra is, hogy az SN1 reakció elsőrendű kinetikával rendelkezik, mivel a sebességmeghatározó lépés egy molekula szétválasztását jelenti, nem pedig két molekula ütközését.
gyakorlat
fontolja meg két nukleofil szubsztitúciót, amelyek oldatban nem katalizálódnak. Tegyük fel, hogy az a reakció SN2, a B reakció pedig SN1., Jósolja meg minden esetben, mi történne a reakció sebességével, ha a nukleofil koncentrációja megduplázódna, míg az összes többi feltétel állandó maradt.

Sok SN1 reakció egy osztály, amely a továbbiakban solvolysis, ahol az oldószer molekula vesz részt a reakcióban, mint egy nucleophile. Az allil-bromid SN1 reakciója metanolban egy példa arra, amit metanolízisnek neveznénk, míg ha a víz az oldószer, a reakciót hidrolízisnek neveznénk., Az ilyen reakciókban, amelyek nem töltött nukleofilt használnak, a koordinációs lépés után sav-bázis lépésre van szükség a H + eltávolításához és a nem töltött végtermék kialakításához.

mivel a víz és az alkoholok viszonylag gyenge nukleofilek, kevésbé valószínű, hogy SN2 módon reagálnak.