Ley de velocidad para la reacción SN2
Anteriormente vimos que la energía requerida para alcanzar el estado de Transición proviene de la energía con la que el nucleófilo y el haluro de alquilo chocan. El requisito de colisión también significa que la frecuencia con la que el nucleófilo y el haluro de alquilo chocan es importante. Esta frecuencia está controlada principalmente por la concentración.,

si la concentración del haluro de alquilo es alta, entonces habrá muchas oportunidades para que un nucleófilo colisione con una molécula de haluro de alquilo. La velocidad de la reacción aumentará proporcionalmente a medida que la concentración de haluro de alquilo aumente. Cuando este es el caso, se dice que la reacción es de primer orden en el haluro de alquilo. De manera similar, un aumento en la concentración de nucleófilos dará lugar a un aumento proporcional en la velocidad, por lo que la reacción también es de primer orden en nucleófilos., En general, la velocidad depende de la concentración de ambos reactivos, y se dice que la reacción es de segundo orden. Esto se puede resumir en la ecuación de tasa o ley de tasa.
Rate = k
es el comportamiento de segundo orden (requisito para que dos moléculas colisionen en el estado crítico de transición) que es designado por el «2» en SN2.,
la reacción SN2
En resumen, vemos que para la reacción SN2:
- La reacción es «concertada» – tiene solo un paso en el mecanismo
- La velocidad de reacción depende de la concentración tanto del electrófilo (el haluro de alquilo o similar) como del nucleófilo.
- El nucleófilo ataca el» lado posterior «del electrófilo, con el grupo saliente sale del»frente»., Esto también significa que si el grupo que sale está saliendo de un carbono quiral, la estereoquímica en ese centro se invierte,
la reacción SN1
Un segundo modelo para una reacción de sustitución nucleofílica se llama mecanismo ‘disociativo’, o ‘SN1’: en esta imagen, el enlace C-X se rompe primero, antes de que el nucleófilo se acerque:

esto resulta en la formación de un carbocatión: debido a que el carbono central tiene solo tres enlaces, lleva una carga formal de +1., Recordemos que un carbocatión debe ser representado como sp2hybridized, con geometría plana (trigonal planar). Perpendicular al plano formado por los tres orbitales híbridos sp2 es un orbital P vacío, sin hibridar.

en el segundo paso de esta reacción de dos pasos, el nucleófilo ataca el orbital P vacío, ‘hambriento de electrones’ del carbocatión para formar un nuevo enlace y devolver el carbono a la geometría tetraédrica.,

vimos que las reacciones SN2 resultan específicamente en la inversión de la estereoquímica en el Centro de carbono electrofílico. ¿Qué pasa con el resultado estereoquímico de las reacciones SN1? En el modelo de reacción SN1 mostrado arriba, el grupo saliente se disocia completamente de la vecindad de la reacción antes de que el nucleófilo comience su ataque. Debido a que el grupo saliente ya no está en la imagen, el nucleófilo es libre de atacar desde cualquier lado del electrófilo de carbocatión hibridado sp2 plano., Esto significa que aproximadamente la mitad del tiempo que el producto tiene la misma configuración estereoquímica que el material de partida (retención de la configuración), y aproximadamente la mitad del tiempo que la estereoquímica se ha invertido. En otras palabras, el producto se ha vuelto racémico y ópticamente inactivo. Como ejemplo, se esperaría que el bromuro de alquilo terciario siguiente formara una mezcla racémica de alcoholes R y S después de una reacción SN1 con agua como nucleófilo entrante.,

ejercicio
dibuje la estructura del Intermedio en la reacción de sustitución nucleofílica de dos pasos anterior.,Show Solution
en la reacción SN1 vemos un ejemplo de una reacción intermedia, un concepto muy importante en el estudio de los mecanismos de reacción orgánica que se introdujo por primera vez en 5 recuerde que muchas reacciones orgánicas importantes no ocurren en un solo paso; más bien, son la suma de dos o más pasos discretos de formación / ruptura de enlaces, e involucran especies intermedias transitorias que reaccionan muy rápidamente., La reacción SN1 implica tanto un paso de heterólisis como un paso de coordinación, así como (generalmente) al menos un paso ácido-base. La especie carbocation es el intermediario reactivo en la reacción SN1. Un diagrama de energía potencial para una reacción SN1 muestra que el intermedio de carbocación puede ser visualizado como una especie de «Valle de montaña» en el camino de la reacción, más alto en energía que el reactivo y el producto, pero más bajo en energía que los dos estados de Transición.,

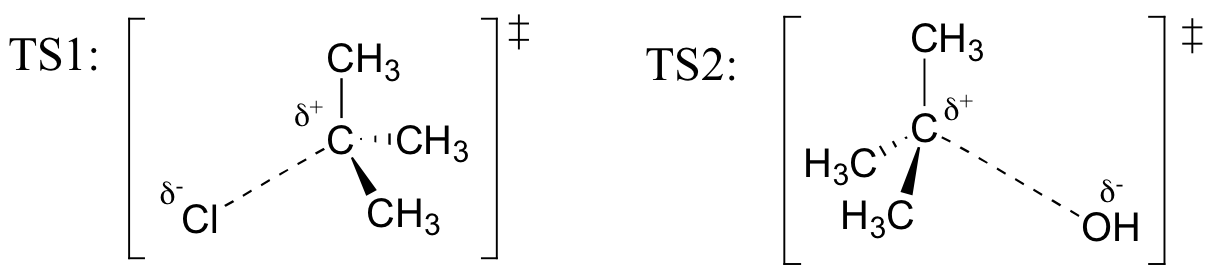
Ejercicio
Dibujar estructuras de representación de TS1 y TS2 en la reacción anterior. Utilice la Convención de cuña sólido/tablero para mostrar tres dimensiones.
recordar (del postulado de Hammond) que el primer paso de heterólisis de la reacción anterior, en el que dos especies cargadas se forman a partir de una molécula neutra, es mucho más lento de los dos pasos, y por lo tanto es determinante de la tasa., Esto se ilustra con el diagrama de energía, donde la energía de activación para el primer paso es más alta que la del segundo paso. También recuerde que una reacción SN1 tiene cinética de primer orden, porque el paso de determinación de la velocidad implica una molécula que se divide, no dos moléculas que chocan.
ejercicio
considerar dos sustituciones nucleofílicas que ocurren sin catalizar en solución. Supongamos que la reacción a es SN2, y la reacción B es SN1., Predecir, en cada caso, lo que sucedería a la velocidad de la reacción si la concentración del nucleófilo se duplicara, mientras que todas las demás condiciones permanecieran constantes.

muchas reacciones SN1 son de una clase que se conoce como solvólisis, donde una molécula solvente participa en la reacción como un nucleófilo. La reacción SN1 del bromuro de alilo en metanol es un ejemplo de lo que llamaríamos metanólisis, mientras que si el agua es el disolvente, la reacción se llamaría hidrólisis., En reacciones como esta que utilizan un nucleófilo sin carga, se necesita un paso ácido-base después del paso de coordinación, para eliminar H+ y formar el producto final sin carga.

debido a que el agua y los alcoholes son nucleófilos relativamente débiles, es menos probable que reaccionen de manera SN2.