Sats lov til SN2 reaktioner
Tidligere så vi, at den energi, der kræves for at nå transition state kommer fra den energi, med hvilken de nucleophile og alkyl halogenid kolliderer. Kravet om en kollision betyder også, at hyppigheden med hvilken nukleofilen og alkylhalogenidet kolliderer er vigtig. Denne frekvens styres primært af koncentration.,

hvis koncentrationen af alkylhalogenidet er høj, vil der være mange muligheder for en nukleofil at kollidere med et alkylhalogenidmolekyle. Reaktionshastigheden vil stige proportionalt, da alkylhalogenidkoncentrationen gøres højere. Når dette er tilfældet, siges reaktionen at være første orden i alkylhalogenid. Tilsvarende vil en stigning i nukleofilkoncentrationen resultere i en forholdsmæssig stigning i hastigheden, så reaktionen er også første orden i nukleofil., Samlet set afhænger hastigheden af koncentrationen af begge reaktanter, og reaktionen siges at være anden orden. Dette kan opsummeres i sats ligning eller sats lov.
Rate = k
det er den anden ordens adfærd (krav om to molekyler at kollidere i den kritiske overgangstilstand), som betegnes af “2” i SN2.,
SN2 reaktioner
sammenfattende ser vi, at for SN2 reaktioner:
- reaktionen er “samordnet” – det er kun et skridt i den mekanisme
- reaktionshastigheden afhænger af koncentrationen af både electrophile (den alkyl halogenid eller lignende) og nucleophile.
- nukleofilen angriber elektrofilens “bagside”, hvor den forlader gruppen forlader fra”fronten”., Dette betyder også, at hvis de forlader gruppen forlader fra en chiral kulstof, stereokemi på, at center er inverteret,
Den SN1 reaktion
En anden model for en nucleophilic substitution reaktion, der kaldes “dissociative”, eller ” SN1 ” – mekanisme: i dette billede, C-X bond bryder først, før nucleophile fremgangsmåder:

Dette resulterer i dannelsen af en carbocation: fordi den centrale carbon har kun tre obligationer, den bærer en formel ladning på +1., Husk, at en carbocation skal afbildes som sp2hybridiseret med flad (trigonal plan) geometri. Vinkelret på planet dannet af de tre SP2 hybrid orbitaler er en tom, uhybridiseret p orbitale.

I det andet trin af denne to-trins reaktion, nucleophile angreb den tomme, ‘elektron sultne’ s orbital af carbocation til at danne bånd og vende tilbage carbon at tetrahedrale geometri.,

vi så, at SN2-reaktioner specifikt resulterer i inversion af stereokemi ved det elektrofile carboncenter. Hvad med det stereokemiske resultat af SN1-reaktioner? I modellen SN1-reaktion vist ovenfor adskiller den forlader gruppen fuldstændigt fra nærheden af reaktionen, før nukleofilen begynder sit angreb. Fordi den forlader gruppen ikke længere er på billedet, er nukleofilen fri til at angribe fra hver side af den plane, sp2-hybridiserede carbocation-elektrofil., Det betyder, at omkring halvdelen af tiden produktet har den samme stereokemiske konfiguration som udgangsmaterialet (opbevaring af konfiguration), og omkring halvdelen af tiden stereokemien er blevet omvendt. Med andre ord er produktet blevet racemisk og optisk inaktivt. Som et eksempel forventes det tertiære alkylbromid nedenfor at danne en racemisk blanding af R-og S-alkoholer efter en SN1-reaktion med vand som den indkommende nukleofil.,

øvelse
tegn strukturen af mellemproduktet i den to-trins nukleofile substitutionsreaktion ovenfor.,Vis Løsning
I SN1 reaktion ser vi et eksempel på en reaktion mellemliggende, et meget vigtigt begreb i undersøgelsen af organisk reaktion mekanismer, som blev introduceret i Kapitel 5 Minde om, at mange vigtige organiske reaktioner forekommer ikke i et enkelt trin; de er snarere summen af to eller flere diskrete bond-danner / bond-breaking skridt, og inddrage forbigående mellemliggende arter, der går på at reagere meget hurtigt., SN1-reaktionen involverer både et heterolysetrin og et koordineringstrin såvel som (normalt) mindst et syre-basetrin. Carbocation-arterne er det reaktive mellemprodukt i SN1-reaktionen. En potentiel energi diagram for en SN1 reaktion viser, at carbocation mellemliggende kan visualiseres som en slags “dal” i vejen for den reaktion, et højere energi end både reaktanter og produkter, men lavere i energi, end de to overgang stater.,

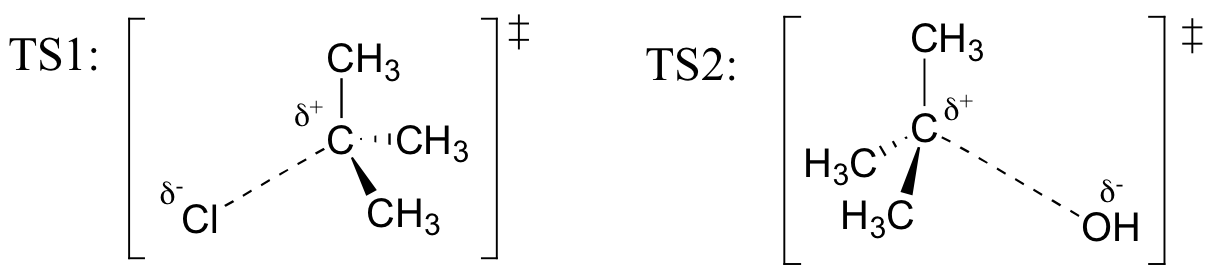
øvelse
tegn strukturer, der repræsenterer TS1 og TS2 i reaktionen ovenfor. Brug solid / dash wededge-konventionen til at vise tre dimensioner.
Huske (fra Hammond ‘ s postulat), at den første heterolysis trin i reaktionen ovenfor, hvor to opkrævet arter, som er dannet ud fra et neutralt molekyle, som er meget langsommere af de to trin, og er derfor sats-bestemmelse., Dette illustreres af energidiagrammet, hvor aktiveringsenergien for det første trin er højere end for det andet trin. Husk også, at en SN1-reaktion har første ordens kinetik, fordi det hastighedsbestemmende trin involverer et molekyle, der splittes fra hinanden, ikke to molekyler kolliderer.
øvelse
overvej to nukleofile substitutioner, der forekommer ukatalyserede i opløsning. Antag, at reaktion A er SN2, og reaktion B er SN1., Forudsige i hvert tilfælde, hvad der ville ske med reaktionshastigheden, hvis koncentrationen af nukleofilen blev fordoblet, mens alle andre forhold forblev konstante.

mange SN1-reaktioner er af en klasse, der benævnes solvolyse, hvor et opløsningsmiddelmolekyle deltager i reaktionen som en nukleofil. SN1-reaktionen af allylbromid i methanol er et eksempel på, hvad vi ville kalde methanolyse, mens hvis vand er opløsningsmidlet, ville reaktionen kaldes hydrolyse., I reaktioner som denne, der bruger en uladet nukleofil, er der brug for et syrebasetrin efter koordineringstrinnet for at fjerne H+ og danne det uladede slutprodukt.

da vand og alkoholer er relativt svage nukleofiler, er de mindre tilbøjelige til at reagere på en SN2-måde.