Os orbitais moleculares (MO) a teoria é uma forma de olhar para a estrutura de uma molécula usando orbitais moleculares que pertencem à molécula como um todo
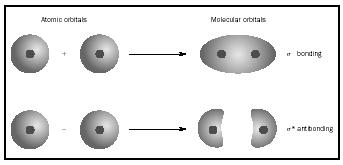
em vez de os átomos individuais. Quando a ligação simples ocorre entre dois átomos, o par de elétrons que formam a ligação ocupa um MO que é uma combinação matemática das funções de onda dos orbitais atômicos dos dois átomos envolvidos. O método MO originou-se no trabalho de Friedrich Hund e Robert S. Mulliken.
Quando os átomos se combinam para formar uma molécula, o número de orbitais na molécula é igual ao número de orbitais nos átomos que combinam. Quando dois átomos muito simples, cada um com uma orbital atômica, são combinados, dois orbitais moleculares são formados., Um é um orbital de ligação, menor em energia do que os orbitais atômicos, e Derivado de sua soma. Chama-se sigma. O outro é um orbital antibonding, maior em energia do que os orbitais atômicos, e resultante de sua diferença. É chamado de sigma-estrela (σ *). (Ver diagrama na Figura 1.)
A ideia básica pode ser ilustrada considerando moléculas diatômicas de hidrogênio e hélio. Os diagramas de energia são apresentados na Figura 2. Cada átomo de hidrogénio tem um electrão de 1 s. Na molécula de H2, os dois elétrons de hidrogênio entram no MO de menor energia disponível, o orbital de sigma., No caso do hélio, cada átomo de hélio tem dois elétrons, então a molécula He 2 teria quatro. Dois iriam para o orbital de ligação de energia mais baixa, mas os outros dois teriam que ir para o orbital de energia mais alta com sigma.
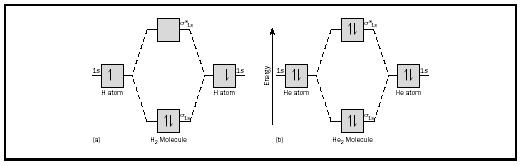
Bond Order
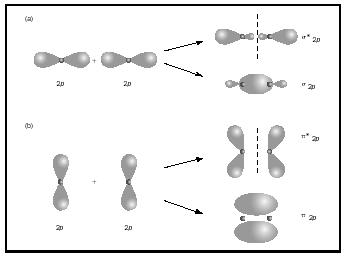
The bond order for a molecule can be determined as follows: bond order = ½ (bonding electrons − antibonding electrons). Portanto, a molécula H 2 tem uma ordem de ligação de ½ (2 − 0) = 1. Em outras palavras, há uma única ligação conectando os dois átomos H na molécula H 2. No caso de He 2, por outro lado, a ordem bond é ½ (2 − 2) = 0. Isto significa que ele 2 não é uma molécula estável., ligações múltiplas ligações duplas ou triplas envolvem dois ou três pares de elétrons de ligação. As ligações únicas são sempre ligações sigma, mas em múltiplas ligações a primeira ligação é sigma, enquanto qualquer segunda ou terceira ligação são ligações pi. A sobreposição dos orbitais p pode produzir pi ou sigma MOs, como mostrado na Figura 3. Quando eles se sobrepõem de ponta a ponta, eles formam orbitais sigma, mas quando eles se sobrepõem lado a lado, eles formam orbitais pi. considere agora a molécula de oxigénio., The Lewis structure for oxygen is: Ö: Ö: Ö: The double bond is necessary in order to satisfy the octet rule for both oxygen atoms. O comprimento da ligação medida para o oxigénio suporta a presença de uma ligação dupla. No entanto, sabemos que esta fórmula de Lewis Não pode ser a estrutura correta para o oxigênio porque o oxigênio é paramagnético, o que significa que a molécula de oxigênio deve ter elétrons não emparelhados.
olhe agora para o diagrama MO para o oxigénio, que é mostrado na Figura 4. Ele ainda indica uma ordem de ligação de 2, mas também mostra dois elétrons não emparelhados.
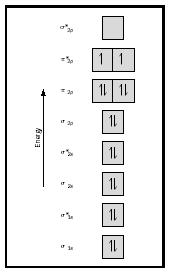
a teoria de MO também funciona bem para moléculas maiores como n 2 O, CO 2 , e BF 3 e para íons como no 3 − e CO 3 2− , em que os MOs de ligação são deslocalizados, envolvendo três ou mais átomos. It is especially useful for aromatic matic molecules such as benzene. Neste caso, todos os seis átomos C no anel estão igualmente envolvidos numa nuvem de elétrons pi deslocalizada que envolve toda a molécula., A teoria de MO pode até ser estendida a íons complexos e sólidos, incluindo materiais como supercondutores e semicondutores.