L’orbitale molecolare (MO) la teoria è un modo di vedere la struttura di una molecola utilizzando orbitali molecolari che appartengono alla molecola come un intero
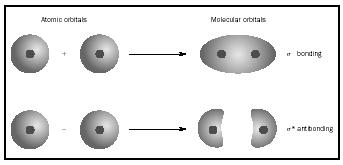
piuttosto che ai singoli atomi. Quando si verifica un legame semplice tra due atomi, la coppia di elettroni che formano il legame occupa un MO che è una combinazione matematica delle funzioni d’onda degli orbitali atomici dei due atomi coinvolti. Il metodo MO ha avuto origine nel lavoro di Friedrich Hund e Robert S. Mulliken.
Quando gli atomi si combinano per formare una molecola, il numero di orbitali nella molecola è uguale al numero di orbitali negli atomi che combinano. Quando due atomi molto semplici, ciascuno con un orbitale atomico, sono combinati, si formano due orbitali molecolari., Uno è un orbitale di legame, più basso in energia rispetto agli orbitali atomici e derivato dalla loro somma. Si chiama sigma. L’altro è un orbitale antibonding, più alto in energia rispetto agli orbitali atomici, e derivante dalla loro differenza. Si chiama sigma-starred (σ *). (Vedere il diagramma in Figura 1.)
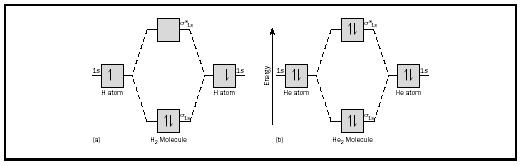
L’idea di base potrebbe essere meglio illustrata considerando le molecole biatomiche di idrogeno ed elio. I diagrammi di energia sono mostrati in Figura 2. Ogni atomo di idrogeno ha un elettrone 1 S. Nella molecola H 2 i due elettroni di idrogeno entrano nel MO di energia più basso disponibile, l’orbitale sigma., Nel caso dell’elio, ogni atomo di elio ha due elettroni, quindi la molecola He 2 ne avrebbe quattro. Due andrebbero nell’orbitale di legame di energia inferiore, ma gli altri due dovrebbero andare nell’orbitale a stella sigma di energia superiore.
Ordine di legame
L’ordine di legame per una molecola può essere determinato come segue: ordine di legame = ½ (elettroni di legame − elettroni antibonding). Pertanto, la molecola H 2 ha un ordine di legame di ½ (2 − 0) = 1. In altre parole, c’è un singolo legame che collega i due atomi H nella molecola H 2. Nel caso di He 2, d’altra parte, l’ordine del legame è ½ (2-2) = 0. Ciò significa che He 2 non è una molecola stabile.,
Legami multipli
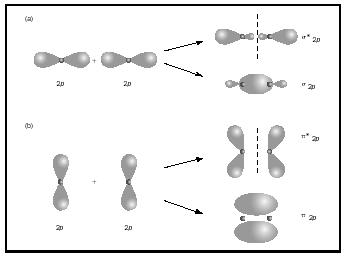
I legami doppi o tripli coinvolgono due o tre coppie di elettroni di legame. I singoli legami sono sempre legami sigma, ma in più legami il primo legame è sigma, mentre ogni secondo o terzo legame sono legami pi. La sovrapposizione di orbitali p può produrre pi o sigma MOs, come mostrato in Figura 3. Quando si sovrappongono da un capo all’altro, formano orbitali sigma, ma quando si sovrappongono da un lato all’altro, formano orbitali pi.
Considera ora la molecola di ossigeno., La struttura di Lewis per l’ossigeno è :Ö:: Ö: Il doppio legame è necessario per soddisfare la regola dell’ottetto per entrambi gli atomi di ossigeno. La lunghezza di legame misurata per l’ossigeno supporta la presenza di un doppio legame. Eppure sappiamo che questa formula di Lewis non può essere la struttura corretta per l’ossigeno perché l’ossigeno è paramagnetico, il che significa che la molecola di ossigeno deve avere elettroni spaiati.
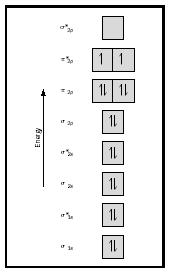
Guarda ora il diagramma MO per l’ossigeno, che è mostrato in Figura 4. Indica ancora un ordine di legame di 2, ma mostra anche due elettroni spaiati.
La teoria MO funziona bene anche per molecole più grandi come N 2 O, CO 2 e BF 3 e per ioni come NO 3 − e CO 3 2−, in cui i MOS di legame sono delocalizzati , coinvolgendo tre o più atomi. È particolarmente utile per molecole matiche aromatiche come il benzene. In questo caso tutti e sei gli atomi C nell’anello sono ugualmente coinvolti in una nube di elettroni pi delocalizzata che avvolge l’intera molecola., La teoria MO può anche essere estesa agli ioni complessi e ai solidi, inclusi materiali come superconduttori e semiconduttori.