la teoría de orbitales moleculares (MO) es una forma de ver la estructura de una molécula mediante el uso de orbitales moleculares que pertenecen molécula como un todo
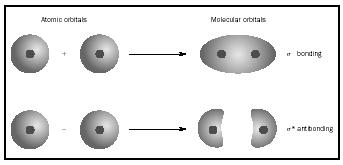
en lugar de a los átomos individuales. Cuando se produce un enlace simple entre dos átomos, el par de electrones que forman el enlace ocupa un MO que es una combinación matemática de las funciones de onda de los orbitales atómicos de los dos átomos involucrados. El método MO se originó en el trabajo de Friedrich Hund y Robert S. Mulliken.
cuando los átomos se combinan para formar una molécula, el número de orbitales en la molécula es igual al número de orbitales en los átomos combinados. Cuando se combinan dos átomos muy simples, cada uno con un orbital atómico, se forman dos orbitales moleculares., Uno es un orbital de enlace, más bajo en energía que los orbitales atómicos, y derivado de su suma. Se llama sigma. El otro es un orbital antibonding, más alto en energía que los orbitales atómicos, y resultante de su diferencia. Se llama sigma-starred (σ*). (Véase el diagrama de la Figura 1.)
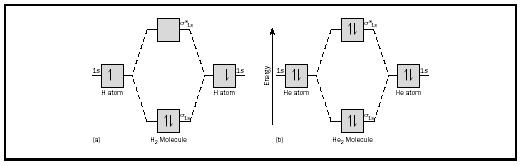
la idea básica podría ilustrarse mejor considerando las moléculas diatómicas de hidrógeno y helio. Los diagramas de energía se muestran en la Figura 2. Cada átomo de hidrógeno tiene un electrón de 1 s. En la molécula H 2 los dos electrones de hidrógeno entran en el MO de energía más baja disponible, el orbital sigma., En el caso del helio, cada átomo de helio tiene dos electrones, por lo que la molécula He 2 tendría cuatro. Dos entrarían en el orbital de enlace de menor energía, pero los otros dos tendrían que entrar en el orbital de estrella sigma de mayor energía.
orden de enlace
el orden de enlace para una molécula se puede determinar de la siguiente manera: orden de enlace = ½ (electrones de enlace − electrones antibonding). Por lo tanto, la molécula H 2 tiene un orden de enlace de ½ (2 − 0) = 1. En otras palabras, hay un enlace simple que conecta los dos átomos H en la molécula H 2. En el caso de He 2, por otro lado, el orden de la fianza es ½ (2 − 2) = 0. Esto significa que 2 no es una molécula estable.,
enlaces múltiples
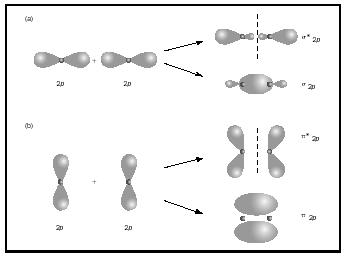
enlaces dobles o triples implican dos o tres pares de electrones de enlace. Los bonos simples son siempre bonos sigma, pero en bonos múltiples el primer bono es sigma, mientras que cualquier segundo o tercer bono son bonos pi. La superposición de orbitales p puede producir pi o sigma MOS, como se muestra en la Figura 3. Cuando se superponen de extremo a extremo, forman orbitales sigma, pero cuando se superponen de lado a lado, forman orbitales pi.
Considere ahora la molécula de oxígeno., La estructura de Lewis para el oxígeno es :Ö::Ö: el doble enlace es necesario para satisfacer la regla del octeto para ambos átomos de oxígeno. La longitud de enlace medida para el oxígeno apoya la presencia de un enlace doble. Sin embargo, sabemos que esta fórmula de Lewis no puede ser la estructura correcta para el oxígeno porque el oxígeno es paramagnético, lo que significa que la molécula de oxígeno debe tener electrones no emparejados.
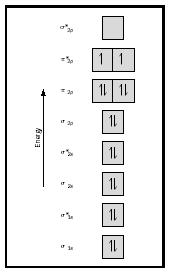
mire ahora el diagrama de MO para el oxígeno, que se muestra en la Figura 4. Todavía indica un orden de enlace de 2, pero también muestra dos electrones no apareados.
la teoría MO también funciona bien para moléculas más grandes como N 2 O, CO 2 Y BF 3 y para iones como NO 3 − y CO 3 2− , en los que los MOs de enlace están deslocalizados, involucrando tres o más átomos. Es especialmente útil para moléculas aromáticas como el benceno. En este caso, los seis átomos C del anillo están igualmente involucrados en una nube de electrones Pi deslocalizada que envuelve toda la molécula., La teoría MO puede incluso extenderse a iones complejos y sólidos, incluyendo materiales como superconductores y semiconductores.