molekyyli silmäkuopan (MO) teoria on tapa katsoa rakenne molekyylin käyttämällä molekyyli orbitaalit, jotka kuuluvat molekyyli kokonaisuutena
yksittäisten atomien sijaan. Kun kahden atomin välille syntyy yksinkertainen sidos, sidoksen muodostava elektronipari vie MO: n, joka on matemaattinen yhdistelmä näiden kahden atomin atomiorbitaalien aaltofunktioista. MO-menetelmä sai alkunsa Friedrich Hundin ja Robert S. Mullikenin teoksista.
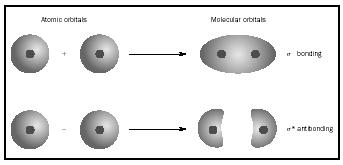
Kun atomit muodostavat molekyylin määrä orbitaalien molekyylissä sama määrä orbitaalit siinä yhdistyvät atomit. Kun kaksi hyvin yksinkertaista atomia, joilla kullakin on yksi atomiorbitaali, yhdistetään, muodostuu kaksi molekyyliorbitaalia., Yksi on sidosorbitaali, pienempi energia kuin atomiorbitaalit, ja johdettu niiden summa. Sen nimi on sigma. Toinen on atomiorbitaaleja suurempi antibonding-orbitaali, joka johtuu niiden erosta. Sen nimi on sigma-tähdittämä ( σ *). (KS. kaavio kuvassa 1.)
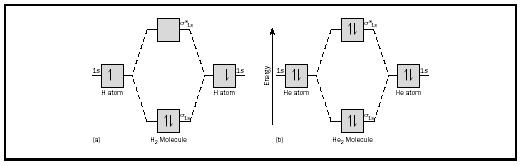
perusideaa voisi parhaiten havainnollistaa tarkastelemalla vedyn ja heliumin diatomisia molekyylejä. Energiakaaviot on esitetty kuvassa 2. Jokaisessa vetyatomissa on yksi 1 s: n elektroni. H 2-molekyylissä kaksi vetyelektronia menee alimpaan käytettävissä olevaan energiamomoon, sigma-orbitaaliin., Heliumin tapauksessa jokaisella heliumatomilla on kaksi elektronia, joten He 2-molekyylillä olisi neljä. Kaksi menisi alemman energian sidos kiertoradalla, mutta kaksi muuta olisi mennä korkeamman energian sigma-tähdellä orbital.
Bond Order
bond jotta molekyyli voidaan määrittää seuraavasti: bond order = ½ (liimaus elektronit − antibonding elektroneja). Siksi H 2-molekyylin sidosjärjestys on ½ (2 − 0) = 1. Toisin sanoen on olemassa yksi sidos, joka yhdistää kaksi h-atomia H 2-molekyylissä. He 2: n tapauksessa taas bond − järjestys on ½ (2-2) = 0. Tämä tarkoittaa, että He 2 ei ole vakaa molekyyli.,
Monisidokset
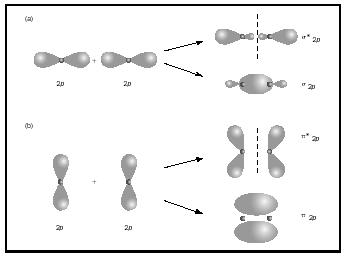
kaksois-tai kolmoissidokset sisältävät kaksi tai kolme paria sidoselektroneja. Yksittäiset sidokset ovat aina sigma-sidoksia, mutta useissa sidoksissa ensimmäinen sidos on sigma, kun taas Mikä tahansa toinen tai kolmas sidos on pi-sidoksia. P-orbitaalien päällekkäisyydet voivat tuottaa joko pi-tai sigma MOs-arvoja, kuten kuvassa 3 esitetään. Kun ne limittyvät päästä päähän, ne muodostavat sigma-orbitaaleja, mutta kun ne limittyvät puolelta toiselle, ne muodostavat pi-orbitaaleja.
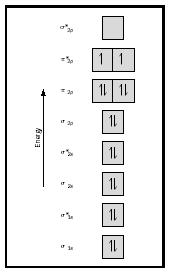
harkitse nyt happimolekyyliä., Hapen Lewis-rakenne on: Ö: Ö: ö: kaksoissidos on välttämätön, jotta molempien happiatomien oktettisääntö täyttyy. Hapen mitattu sidoksen pituus tukee kaksoissidoksen läsnäoloa. Mutta me tiedämme, että tämä Lewisin kaava ei voi olla oikea rakenne happea, koska happea on paramagneettinen, mikä tarkoittaa, että happea molekyyli on parittomia elektroneja.
Katso nyt hapen MO-diagrammia, joka on esitetty kuvassa 4. Se osoittaa edelleen sidosjärjestystä 2, mutta siinä näkyy myös kaksi paritonta elektronia.
MO − teoria toimii hyvin myös suuremmille molekyyleille, kuten N 2 O , CO 2 ja BF 3 , sekä ioneille, kuten NO 3− ja CO 3 2 -, joissa sidosmos on delokalisoitu, joissa on kolme tai useampia atomeja. Se on erityisen hyödyllinen aromaattisille matikkamolekyyleille, kuten bentseenille. Tällöin kaikki renkaan kuusi C-atomia ovat yhtä lailla mukana delokalisoituneessa pi-elektronipilvessä, joka ympäröi koko molekyylin., MO-teoria voidaan laajentaa jopa kompleksisiin ioneihin ja kiinteisiin aineisiin, kuten suprajohteisiin ja puolijohteisiin.