teorie molekulárního orbitalu (MO) je způsob, jak se podívat na strukturu molekuly pomocí molekulárních orbitálů, které patří do molekuly jako celek
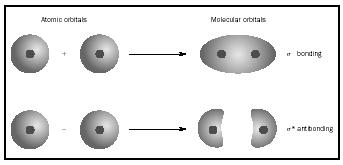
spíše než na jednotlivé atomy. Když dojde k jednoduchému spojení mezi dvěma atomy, dvojice elektronů tvořících vazbu zaujímá MO, což je matematická kombinace vlnových funkcí atomových orbitalů dvou zúčastněných atomů. Metoda MO vznikla v díle Friedricha hunda a Roberta s. Mullikena.
když se atomy spojí a vytvoří molekulu, počet orbitalů v molekule se rovná počtu orbitalů v kombinujících atomech. Když se spojí dva velmi jednoduché atomy, z nichž každý má jeden atomový orbital, vytvoří se dva molekulární orbitaly., Jedním z nich je spojovací orbital, nižší v energii než atomové orbitaly a odvozené z jejich součtu. Říká se tomu sigma. Druhý je antibonding orbital, vyšší v energii než atomové orbitaly, a vyplývající z jejich rozdílu. To se nazývá sigma-hrál (σ*). (Viz obrázek na obrázku 1.)
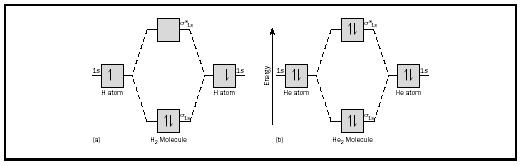
základní myšlenka by mohla být nejlépe ilustrována zvážením diatomických molekul vodíku a helia. Energetické diagramy jsou znázorněny na obrázku 2. Každý atom vodíku má jeden 1 s elektron. V molekule H 2 jdou dva vodíkové elektrony do nejnižšího energetického moku, který je k dispozici, Sigma orbital., V případě helia má každý atom helia dva elektrony,takže molekula He 2 by měla čtyři. Dva by šli do orbitalu s nižší energií, ale další dva by museli jít do orbitalu s vyšší energií Sigma.
pořadí vazeb
pořadí vazeb pro molekulu lze stanovit následovně: pořadí vazeb = ½ (lepení elektronů − antibondingové elektrony). Proto má molekula H 2 Řád vazby ½ (2 − 0) = 1. Jinými slovy, existuje jedna vazba spojující dva atomy H v molekule H 2. V případě He 2 je naopak pořadí dluhopisů ½ (2 − 2) = 0. To znamená, že He 2 není stabilní molekula.,
vícenásobné vazby
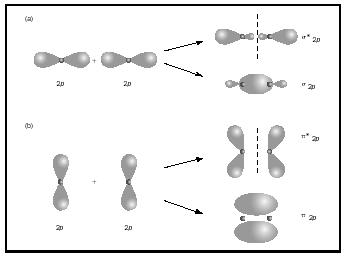
dvojité nebo trojité vazby zahrnují dva nebo tři páry vazebných elektronů. Jednotlivé vazby jsou vždy Sigma dluhopisy, ale ve více vazeb první vazba je sigma, zatímco každá druhá nebo třetí dluhopisy jsou pi dluhopisy. Překrytí P orbitalů může přinést buď pi nebo sigma MOs, jak je znázorněno na obrázku 3. Když se překrývají od konce do konce, tvoří Sigma orbitaly, ale když se překrývají ze strany na stranu, tvoří pi orbitaly.
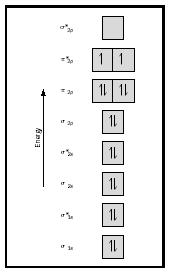
zvažte nyní molekulu kyslíku., Lewis struktura pro kyslík je :Ö::Ö: dvojná vazba je nezbytná pro splnění octet pravidlo pro oba atomy kyslíku. Měřená délka vazby pro kyslík podporuje přítomnost dvojité vazby. Přesto víme, že tento Lewisův vzorec nemůže být správnou strukturou kyslíku, protože kyslík je paramagnetický, což znamená, že molekula kyslíku musí mít nepárové elektrony.
podívejte se nyní na schéma MO pro kyslík, které je znázorněno na obrázku 4. Stále označuje pořadí vazby 2, ale také ukazuje dva nepárové elektrony.
teorie MO také funguje dobře pro větší molekuly, jako jsou N 2 O , CO 2 a BF 3 a pro ionty , jako je NO 3 − a CO 3 2−, ve kterých jsou vazební MOs delokalizovány, zahrnující tři nebo více atomů. To je zvláště užitečné pro aromatické matické molekuly, jako je benzen. V tomto případě je všech šest atomů C v kruhu stejně zapojeno do delokalizovaného oblaku pi elektronů, který obklopuje celou molekulu., Teorie MO může být dokonce rozšířena na složité ionty a na pevné látky, včetně materiálů, jako jsou supravodiče a polovodiče.