The molecular orbital (MO) teori er en måte å se på strukturen av et molekyl ved hjelp av molekylære orbitals som tilhører molekylet som helhet
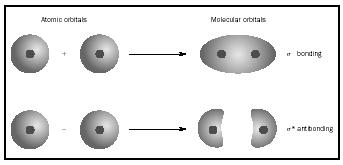
snarere enn til den enkelte atomer. Når enkel binding oppstår mellom to atomer, de to elektroner og danner bond ligger i en MO som er en matematisk kombinasjon av bølge funksjoner av atom-orbitals av to atomer som er involvert. MO metoden oppsto i arbeidet til Friedrich Hund og Robert S. Mulliken.
Når atomer kombineres for å danne et molekyl, antall orbitals i molekylet er lik antall orbitals i å kombinere atomer. Når to veldig enkle atomer, hver med en atomic orbital, er kombinert, to molecular orbitals er dannet., Den ene er en bonding orbital, lavere energi enn atom-orbitals, og er avledet fra sin sum. Det heter sigma. Den andre er en antibonding orbital, høyere energi enn atom-orbitals, og som følge av deres forskjellen. Det heter sigma-stjerne ( σ *). (Se diagram i Figur 1.)
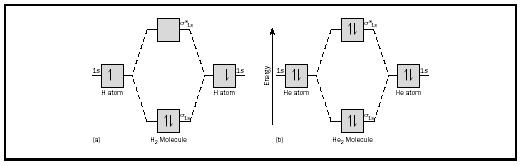
Den grunnleggende ideen kan kanskje best illustreres ved å tenke på diatomic molekyler av hydrogen og helium. Energi-diagrammer er vist i Figur 2. Hver hydrogen atom har en 1 s elektron. I H 2 molekyl de to hydrogen atomer gå til lavest mulig energi MO tilgjengelig, sigma-orbital., I tilfelle av helium, hver helium atom har to elektroner, så Han 2 molekyl ville ha fire. To ville gå inn i den lavere energi bonding orbital, men de to andre ville ha til å gå inn i de høyere energi sigma-stjerne og klokker.
Bond Order
The bond for et molekyl kan fastsettes som følger: bond order = ½ (bonding elektroner − antibonding elektroner). Derfor, H 2 molekyl har en bond bestilling av ½ (2 − 0) = 1. Med andre ord, det er et enkelt bånd som forbinder de to H-atomene i H 2-molekylet. I tilfelle av Han 2 , på den annen side, bond for ½ (2 − 2) = 0. Dette betyr at Han 2 er ikke et stabilt molekyl.,
Flere Obligasjoner
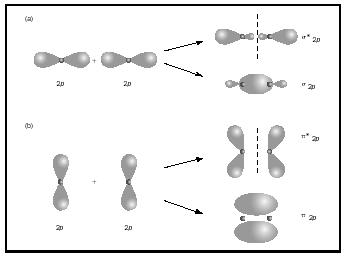
Dobbel eller trippel obligasjoner involvere to eller tre par av bonding elektroner. Enkelt obligasjoner er alltid sigma obligasjoner, men i flere obligasjoner den første bond er sigma, mens noen andre eller tredje obligasjoner er pi obligasjoner. Overlappingen av p-orbitals kan gi enten pi eller sigma MOs, som vist i Figur 3. Når de overlapper ende til ende, og de danner sigma orbitals, men når de overlapper side til side, danner de pi orbitals.
Vurdere nå oksygen-molekyl., Lewis-struktur for oksygen er :Ö::Ö: dobbeltbindingen er nødvendig for å tilfredsstille octet regel for både oksygen atomer. Den målte bond-lengde for oksygen støtter tilstedeværelsen av en dobbel binding. Likevel vet vi at dette Lewis formel kan ikke være riktig struktur for oksygen fordi oksygen er paramagnetiske, noe som betyr at oksygen-molekyl må ha kort uten par elektroner.
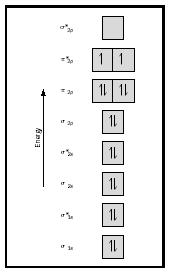
Se nå på MO-diagram for oksygen, som er vist i Figur 4. Det er fortsatt viser en obligasjon for 2 , men det viser også to kort uten par elektroner.
MO-teorien fungerer også godt for større molekyler slik som N 2 O, CO 2 , og BF 3 og for ioner som NR 3 − og CO 3 2− , som bonding MOs er delocalized, som involverer tre eller flere atomer. Det er spesielt nyttig for aromatiske matic molekyler slik som bensin. I dette tilfellet vil alle seks C-atomer i ringen er like involvert i en delocalized pi electron sky som dekker hele molekylet., MO-teori kan også bli utvidet til komplekse ioner og til faste stoffer, inkludert materialer som superledere og halvledere.