molecular orbital (MO) theory är ett sätt att titta på strukturen hos en molekyl genom att använda molekylära orbitaler som hör till molekylen som helhet
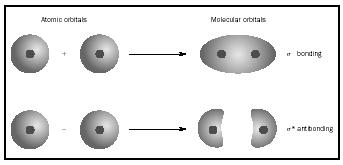
i stället för de enskilda atomerna. När enkel bindning sker mellan två atomer, upptar paret elektroner som bildar bindningen en MO som är en matematisk kombination av vågfunktionerna hos de atomära orbitalerna hos de två atomer som är involverade. MO-metoden har sitt ursprung i Friedrich hunds och Robert S. Mullikens arbete.
när atomer kombineras för att bilda en molekyl, är antalet orbitaler i molekylen lika med antalet orbitaler i de kombinerade atomerna. När två mycket enkla atomer, var och en med en atom orbital, kombineras bildas två molekylära orbitaler., En är en bindning orbital, lägre i energi än de atomära orbitalerna, och härrör från deras summa. Det kallas sigma. Den andra är en antibonding orbital, högre i energi än de atomära orbitalerna, och som härrör från deras skillnad. Det kallas sigma-starred (σ *). (Se diagrammet i Figur 1.)
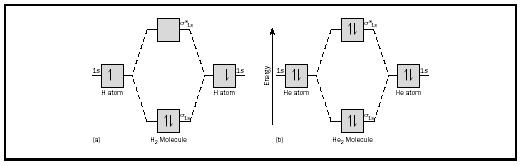
den grundläggande idén kan bäst illustreras med tanke på diatomiska molekyler av väte och helium. Energidiagrammen visas i Figur 2. Varje väteatom har en 1 s elektron. I h 2-molekylen går de två väteelektronerna in i den lägsta energin MO tillgänglig, sigma orbital., När det gäller helium har varje heliumatom två elektroner, så att he 2-molekylen skulle ha fyra. Två skulle gå in i den lägre energibindningen orbital, men de andra två skulle behöva gå in i högre energi sigma-stjärnmärkta orbital.
Bond Order
bond order för en molekyl kan bestämmas enligt följande: bond order = ½ (bonding elektroner − antibonding elektroner). Därför har h 2-molekylen en bindningsordning på ½ (2 − 0) = 1. Med andra ord finns det en enda bindning som förbinder de två H-atomerna i h 2-molekylen. I fallet med Han 2 är å andra sidan obligationsordern ½ (2 − 2) = 0. Detta innebär att han 2 inte är en stabil molekyl.,
flera bindningar
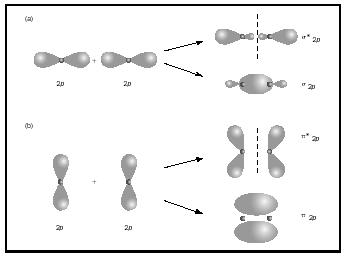
dubbel-eller trippelbindningar involverar två eller tre par bindningselektroner. Enskilda obligationer är alltid sigma obligationer, men i flera obligationer är den första obligationen sigma, medan andra eller tredje obligationer är pi obligationer. Överlappningen av p-orbitaler kan ge antingen pi eller sigma MOs, som visas i Figur 3. När de överlappar slut till slut bildar de sigma orbitaler, men när de överlappar sida till sida bildar de Pi-orbitaler.
överväga nu syremolekylen., Lewis-strukturen för syre är: Ö:: Ö: dubbelbindningen är nödvändig för att uppfylla oktettregeln för båda syreatomerna. Den uppmätta bindningslängden för syre stöder närvaron av en dubbelbindning. Men vi vet att denna Lewis formel inte kan vara den korrekta strukturen för syre eftersom syre är paramagnetisk, vilket innebär att syremolekylen måste ha oparade elektroner.
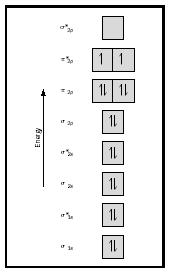
Titta nu på Mo-diagrammet för syre, vilket visas i Figur 4. Det indikerar fortfarande en bindningsordning på 2, men det visar också två oparade elektroner.
MO − teorin fungerar också bra för större molekyler som N 2 O, CO 2 och BF 3 och för joner som nr 3− och CO 3 2 -, där bindningsmosna delokaliseras , involverar tre eller flera atomer. Det är särskilt användbart för aromatiska matiska molekyler som bensen. I detta fall är alla sex C-atomer i ringen lika involverade i ett delokaliserat pi-elektronmoln som omsluter hela molekylen., MO-teorin kan till och med utvidgas till komplexa joner och fasta ämnen, inklusive material som supraledare och halvledare.