molecular orbital (MO) teoria este un mod de a privi structura unei molecule cu ajutorul orbitali moleculari care aparțin moleculei ca un întreg
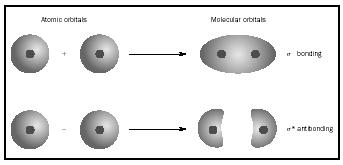
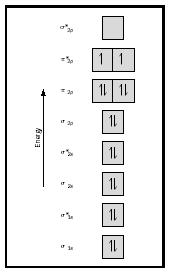
mai degrabă decât la atomii individuali. Când are loc o legătură simplă între doi atomi, perechea de electroni care formează legătura ocupă un MO care este o combinație matematică a funcțiilor de undă ale orbitalilor atomici ai celor doi atomi implicați. Metoda MO își are originea în opera lui Friedrich Hund și Robert S. Mulliken. când atomii se combină pentru a forma o moleculă, numărul de orbitali din moleculă este egal cu numărul de orbitali din atomii care combină. Când doi atomi foarte simpli, fiecare cu un orbital atomic, sunt combinați, se formează două orbite moleculare., Unul este un orbital de legătură, mai mic în energie decât orbitalii atomici și derivat din suma lor. Se numește sigma. Celălalt este un orbital antibonding, mai mare în energie decât orbitalii atomici și care rezultă din diferența lor. Se numește stea sigma (σ *). (Vezi diagrama din Figura 1.)
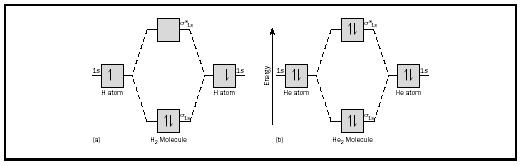
ideea de bază ar putea fi ilustrată cel mai bine prin luarea în considerare a moleculelor diatomice de hidrogen și heliu. Diagramele energetice sunt prezentate în Figura 2. Fiecare atom de hidrogen are un electron de 1 S. În molecula H 2, cei doi electroni de hidrogen intră în cea mai mică energie mo disponibilă, orbitalul sigma., În cazul heliului, fiecare atom de heliu are doi electroni, deci molecula He 2 ar avea patru. Doi ar intra în orbitalul de legare a energiei inferioare, dar ceilalți doi ar trebui să intre în orbitalul cu stea sigma cu energie superioară.
ordinea de legătură
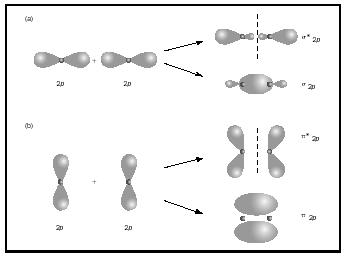
ordinea de legătură pentru o moleculă poate fi determinată după cum urmează: ordinea de legătură = ½ (electroni de legătură − electroni antibondanți). Prin urmare, molecula H 2 are o ordine de legătură de ½ (2 − 0) = 1. Cu alte cuvinte, există o singură legătură care leagă cei doi atomi H în molecula H 2. În cazul He 2, pe de altă parte, ordinea obligațiunilor este ½ (2 − 2) = 0. Aceasta înseamnă că He 2 nu este o moleculă stabilă., legăturile duble sau triple implică două sau trei perechi de electroni de legătură. Obligațiunile unice sunt întotdeauna obligațiuni sigma, dar în obligațiuni multiple prima legătură este sigma, în timp ce ORICE a doua sau a treia obligațiuni sunt obligațiuni pi. Suprapunerea orbitalilor p poate produce fie pi, fie Sigma MOs, așa cum se arată în Figura 3. Când se suprapun de la un capăt la altul, formează orbitali sigma, dar când se suprapun dintr-o parte în alta, formează orbitali pi. luați în considerare acum molecula de oxigen., Structura Lewis pentru oxigen este: Ö:: Ö: legătura dublă este necesară pentru a satisface regula octetului pentru ambii atomi de oxigen. Lungimea măsurată a legăturii pentru oxigen susține prezența unei legături duble. Cu toate acestea, știm că această formulă Lewis nu poate fi structura corectă pentru oxigen, deoarece oxigenul este paramagnetic, ceea ce înseamnă că molecula de oxigen trebuie să aibă electroni nepereche. Uită-te acum la diagrama MO pentru oxigen, care este prezentată în Figura 4. Încă indică un ordin de legătură de 2, dar arată și doi electroni nepereche.