teoria orbitali molekularnych (MO) jest sposobem patrzenia na strukturę cząsteczki za pomocą orbitali molekularnych, które należą do cząsteczki jako całość
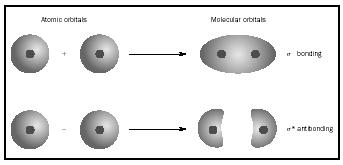
zamiast do poszczególnych atomów. Gdy między dwoma atomami zachodzi proste Wiązanie, para elektronów tworzących Wiązanie zajmuje MO, które jest matematyczną kombinacją funkcji falowych orbitali atomowych dwóch zaangażowanych atomów. Metoda MO powstała w twórczości Friedricha Hunda i Roberta S. Mullikena.
gdy atomy łączą się tworząc cząsteczkę, liczba orbitali w cząsteczce jest równa liczbie orbitali w atomach łączących. Kiedy dwa bardzo proste Atomy, każdy z jednym orbitalem atomowym, są połączone, powstają dwa orbitale molekularne., Jeden z nich jest orbitalem wiązania, o mniejszej energii niż orbitale atomowe i pochodnej ich sumy. Nazywa się sigma. Drugi jest orbitalem antybalistycznym, o większej energii niż orbitale atomowe i wynikającej z ich różnicy. Nazywa się ją sigma-gwiazdką (σ*). (Patrz rysunek 1.)
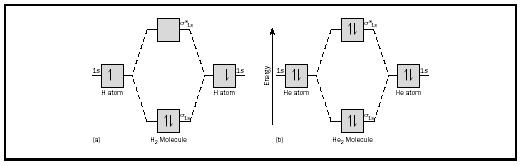
podstawową ideę najlepiej zilustrować rozważając dwuatomowe cząsteczki wodoru i helu. Schematy energii przedstawiono na rysunku 2. Każdy atom wodoru ma jeden elektron 1 s. W cząsteczce H2 dwa elektrony wodoru przechodzą w najniższą dostępną energię MO, orbital sigma., W przypadku helu, każdy atom helu ma dwa elektrony, więc cząsteczka He 2 miałaby cztery. Dwa z nich trafiłyby na Orbital wiązania o niższej energii, a pozostałe dwa na Orbital sigma o wyższej energii.
kolejność wiązania
kolejność wiązania dla cząsteczki można określić w następujący sposób: kolejność wiązania = ½ (Wiązanie elektronów-antybondowanie elektronów). Dlatego cząsteczka H 2 ma kolejność wiązania ½ (2-0) = 1. Innymi słowy, istnieje jedno wiązanie łączące dwa atomy h w cząsteczce H 2. W przypadku He 2, z drugiej strony, kolejność wiązania wynosi ½ (2 − 2) = 0. Oznacza to, że He 2 nie jest stabilną cząsteczką.,
wiązania wielokrotne
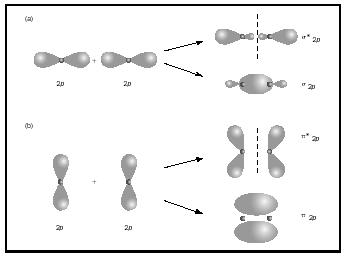
wiązania podwójne lub potrójne obejmują dwie lub trzy pary elektronów wiążących. Wiązania pojedyncze są zawsze wiązaniami sigma, ale w wiązaniach wielokrotnych pierwsze Wiązanie to sigma, podczas gdy każde drugie lub trzecie Wiązanie to wiązania pi. Nakładanie się orbitali p może dawać pi lub sigma MOs, jak pokazano na rysunku 3. Kiedy nakładają się na siebie, tworzą orbitale sigma, ale gdy nakładają się na siebie, tworzą orbitale pi.
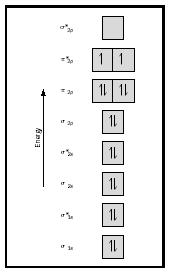
rozważmy teraz cząsteczkę tlenu., Struktura Lewisa dla tlenu to: Ö:: Ö: wiązanie podwójne jest konieczne, aby spełnić zasadę oktetu dla obu atomów tlenu. Zmierzona długość wiązania dla tlenu wspiera obecność wiązania podwójnego. Wiemy jednak, że ten wzór Lewisa nie może być prawidłową strukturą dla tlenu, ponieważ tlen jest paramagnetyczny, co oznacza, że cząsteczka tlenu musi mieć niesparowane elektrony.
spójrz teraz na diagram MO dla tlenu, który jest pokazany na rysunku 4. Nadal wskazuje na Wiązanie rzędu 2, ale pokazuje również dwa niesparowane elektrony.
teoria MO działa również dobrze dla większych cząsteczek, takich jak N 2 O, CO 2 i BF 3 oraz dla jonów, takich jak NO 3-i CO 3 2 -, w których Wiązanie MOS jest delokalizowane, z udziałem trzech lub więcej atomów. Jest to szczególnie przydatne dla aromatycznych cząsteczek maty, takich jak benzen. W tym przypadku wszystkie sześć atomów C w pierścieniu są jednakowo zaangażowane w delokalizowaną chmurę elektronową pi, która otacza całą cząsteczkę., Teoria MO może być nawet rozszerzona na jony złożone i ciała stałe, w tym materiały takie jak nadprzewodniki i Półprzewodniki.