De moleculaire orbitaal (MO) theorie is een manier van kijken naar de structuur van een molecuul met behulp van moleculaire montuur die behoren tot het molecuul als geheel met
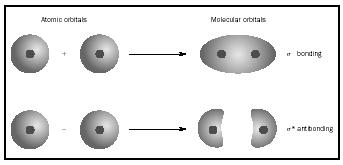
in plaats van de afzonderlijke atomen. Wanneer een eenvoudige binding plaatsvindt tussen twee atomen, neemt het paar elektronen die de binding vormen een MO in beslag dat een wiskundige combinatie is van de golffuncties van de atomaire orbitalen van de twee betrokken atomen. De MO-methode is ontstaan in het werk van Friedrich Hund en Robert S. Mulliken.
wanneer atomen samen een molecuul vormen, is het aantal orbitalen in het molecuul gelijk aan het aantal orbitalen in de combinerende atomen. Wanneer twee zeer eenvoudige atomen, elk met een atomaire orbitaal, worden gecombineerd, worden twee moleculaire orbitalen gevormd., Een is een bindingsorbitaal, lager in energie dan de atomaire orbitalen, en afgeleid van hun som. Het heet sigma. De andere is een antibonding orbitaal, hoger in energie dan de atomaire orbitalen, en het gevolg van hun verschil. Het heet sigma-starred (σ *). (Zie het diagram in Figuur 1.)
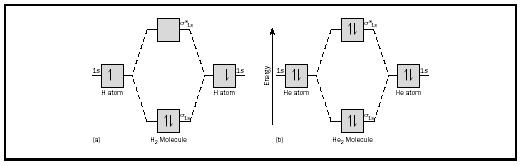
het basisidee kan het best worden geïllustreerd door het overwegen van diatomaire moleculen van waterstof en helium. De energiediagrammen zijn weergegeven in Figuur 2. Elk waterstofatoom heeft één elektron van 1 s. In het H 2-molecuul gaan de twee waterstofelektronen naar de laagste beschikbare energiemo, de Sigma-orbitaal., In het geval van helium heeft elk heliumatoom twee elektronen, dus het He 2-molecuul zou er vier hebben. Twee zouden in de lagere energie bindingsbaan gaan, maar de andere twee zouden in de hogere energie Sigma-ster orbitaal moeten gaan.
bindingsvolgorde
de bindingsvolgorde voor een molecuul kan als volgt worden bepaald: bindingsvolgorde = ½ (bindingselektronen-antibonderende elektronen). Daarom heeft het H 2-molecuul een bindingsorde van ½ (2-0) = 1. Met andere woorden, er is een enkele binding die de twee H-atomen in het H 2-molecuul verbindt. In het geval van He 2 is de obligatieorde daarentegen ½ (2-2) = 0. Dit betekent dat He 2 geen stabiel molecuul is.,
meerdere bindingen
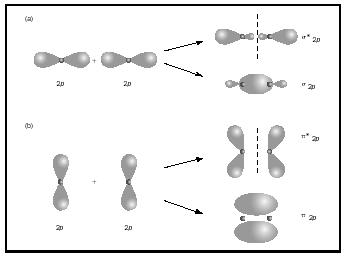
dubbele of drievoudige bindingen hebben twee of drie paren bindingselektronen. Enkelvoudige bindingen zijn altijd sigma-bindingen, maar in meervoudige bindingen is de eerste bindingen sigma, terwijl elke tweede of derde bindingen pi-bindingen zijn. De overlapping van p orbitalen kan ofwel pi of sigma MOs opleveren, zoals weergegeven in Figuur 3. Als ze elkaar van begin tot eind overlappen, vormen ze sigma-orbitalen, maar als ze elkaar van kant tot kant overlappen, vormen ze pi-orbitalen.
overweeg nu het zuurstofmolecuul., De Lewis-structuur voor zuurstof is :Ö:: Ö: de dubbele binding is noodzakelijk om aan de octetregel voor beide zuurstofatomen te voldoen. De gemeten bindingslengte voor zuurstof ondersteunt de aanwezigheid van een dubbele binding. Toch weten we dat deze Lewis formule niet de juiste structuur voor zuurstof kan zijn omdat zuurstof paramagnetisch is, wat betekent dat het zuurstofmolecuul ongepaarde elektronen moet hebben.
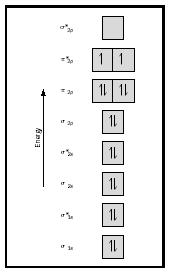
Kijk nu naar het MO-diagram voor zuurstof, dat is weergegeven in Figuur 4. Het geeft nog steeds een bindingsorde van 2 aan, maar het toont ook twee ongepaarde elektronen.
De Mo-theorie werkt ook goed voor grotere moleculen zoals N 2 O, CO 2 en BF 3 en voor ionen zoals NO 3 – en CO 3 2 -, waarin de bindingsmo ‘ s worden gedelokaliseerd, waarbij drie of meer atomen betrokken zijn. Het is vooral nuttig voor aromatische matische moleculen zoals benzeen. In dit geval zijn alle zes C-atomen in de ring even betrokken bij een gedelokaliseerde pi-elektronwolk die het gehele molecuul omhult., De MO-theorie kan zelfs worden uitgebreid tot complexe ionen en vaste stoffen, waaronder materialen zoals supergeleiders en halfgeleiders.