A molekuláris orbitális (MO) elmélet egy nézőpont a szerkezet egy molekula segítségével molekuláris elektronpályák tartoznak a molekula egészének
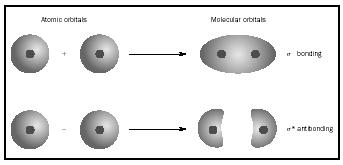
az egyes atomok helyett. Amikor két atom között egyszerű kötés történik, a kötést alkotó elektronpár egy MO-t foglal el, amely az érintett két atom atompályáinak hullámfüggvényeinek matematikai kombinációja. A MO módszer Friedrich Hund és Robert S. Mulliken munkáiból származik.
amikor az atomok egy molekulát alkotnak, a molekulában lévő pályák száma megegyezik a kombináló atomok pályáinak számával. Amikor két nagyon egyszerű atomot kombinálnak, mindegyik egy atomi orbitállal, két molekuláris orbitális alakul ki., Az egyik egy kötő orbitális, alacsonyabb energiájú, mint az atomi orbitális, és az összegükből származik. Ez az úgynevezett sigma. A másik egy antibonding orbitális, nagyobb energiájú, mint az atomi pályák, és ezek különbsége miatt. Ezt sigma-csillagnak ( σ*) nevezik. (Lásd az 1. ábrán látható ábrát.)
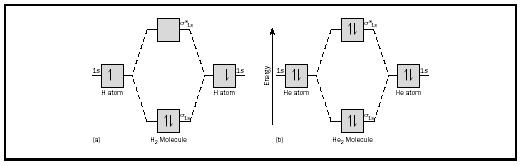
az alapötletet leginkább a hidrogén és a hélium diatomikus molekuláinak figyelembe vételével lehet szemléltetni. Az energiagazdálkodási ábrák a 2. ábrán láthatók. Minden hidrogénatomnak van egy 1 s elektronja. A H 2 molekulában a két hidrogén elektron a rendelkezésre álló legalacsonyabb energiájú MO-ba, a sigma orbitálisba kerül., Hélium esetében minden hélium atomnak két elektronja van, így a He 2 molekulának négy lenne. Kettő az alacsonyabb energiatartalmú orbitális pályára kerülne, de a másik kettőnek a magasabb energiájú sigma-csillagú orbitális pályára kell mennie.
Bond Order
a molekula kötési sorrendje a következőképpen határozható meg: bond order = ½ (bonding electrons − antibonding electrons). Ezért a H 2 molekula ½ (2 − 0) = 1 kötési sorrendben van. Más szavakkal, van egy kötés, amely összeköti a két H atomot a H 2 molekulában. A 2 esetében viszont a kötési sorrend ½ (2-2) = 0. Ez azt jelenti, hogy ő 2 nem stabil molekula.,
több kötés
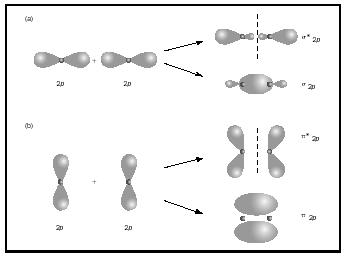
a kettős vagy hármas kötések két vagy három pár kötési elektronot tartalmaznak. Az egykötvények mindig sigma kötvények, de több kötésben az első kötvény a sigma, míg a második vagy harmadik kötések pi kötvények. A P pályák átfedése Pi vagy sigma MOs értéket eredményezhet, amint azt a 3.ábra mutatja. Amikor átfedik egymást a végtől a végéig, sigma orbitákat alkotnak, de amikor átfedik egymást, pi orbitákat alkotnak.
fontolja meg most az oxigénmolekulát., Az oxigén Lewis szerkezete: Ö: Ö: Ö: a kettős kötés szükséges ahhoz, hogy mindkét oxigénatom oktettszabályát kielégítsék. Az oxigén mért kötési hossza támogatja a kettős kötés jelenlétét. Tudjuk azonban, hogy ez a Lewis-képlet nem lehet az oxigén megfelelő szerkezete, mivel az oxigén paramágneses, ami azt jelenti, hogy az oxigénmolekulának párosítatlan elektronokkal kell rendelkeznie.
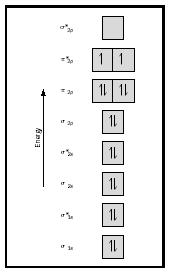
nézze meg most az oxigén MO diagramját, amely a 4.ábrán látható. Még mindig 2-es kötési sorrendet jelez, de két páratlan elektronot is mutat.
A MO-elmélet jól működik olyan nagyobb molekulák esetében is, mint az N 2 O , CO 2 és BF 3 , valamint olyan ionok esetében, mint a NO 3 − és CO 3 2−, amelyekben a kötési MOs delokalizálódik, három vagy több atomot foglal magában. Különösen hasznos az aromás matikus molekulák, például a benzol esetében. Ebben az esetben a gyűrű mind a hat C atomja egyformán részt vesz egy delokalizált pi elektronfelhőben, amely az egész molekulát borítja., A MO-elmélet akár komplex ionokra és szilárd anyagokra is kiterjeszthető, beleértve az olyan anyagokat, mint a szupravezetők és félvezetők.