Les orbitales moléculaires (MO) la théorie est une façon de regarder la structure d’une molécule en utilisant des orbitales moléculaires qui appartiennent à la molécule dans son ensemble
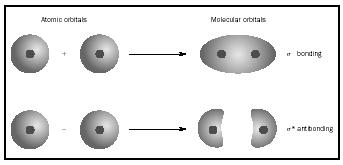
plutôt que pour les atomes individuels. Quand une simple liaison entre deux atomes, la paire d’électrons formant le lien occupe un MO qui est une combinaison mathématique des fonctions d’onde des orbitales atomiques des deux atomes impliqués. La méthode MO est née dans les travaux de Friedrich Hund et Robert S. Mulliken.
Quand les atomes se combinent pour former une molécule, le nombre d’orbitales dans la molécule est égal au nombre d’orbitales dans la combinaison des atomes. Lorsque deux atomes très simples, chacun avec une orbitale atomique, sont combinés, deux orbitales moléculaires sont formées., L’une est une orbitale de liaison, plus faible en énergie que les orbitales atomiques, et dérivée de leur somme. Il est appelé sigma. L’autre est une orbitale antibondante, plus élevée en énergie que les orbitales atomiques, et résultant de leur différence. Il est appelé sigma étoilé ( σ *). (Voir le diagramme de la Figure 1.)
l’idée de base pourrait être mieux illustrée en considérant les molécules diatomiques d’hydrogène et d’hélium. Les diagrammes d’énergie sont illustrés à la Figure 2. Chaque atome d’hydrogène a un électron 1 s. Dans la molécule H 2, les deux électrons d’hydrogène vont dans la MO d’énergie la plus basse disponible, l’orbitale sigma., Dans le cas de l’hélium, chaque atome d’hélium a deux électrons, de sorte que la molécule He 2 en aurait quatre. Deux iraient dans l’orbitale de liaison d’énergie inférieure, mais les deux autres devraient aller dans l’orbitale sigma-étoilée d’énergie supérieure.
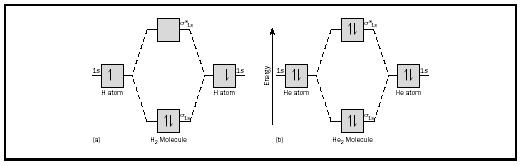
ordre de liaison
l’ordre de liaison pour une molécule peut être déterminé comme suit: ordre de liaison = ½ (électrons de liaison − électrons antibondants). Par conséquent, la molécule H 2 a une liaison d’ordre ½ (2 − 0) = 1. En d’autres termes, il existe une seule liaison reliant les deux atomes H dans la molécule H 2. Dans le cas de He 2, en revanche, l’ordre de liaison est ½ (2 − 2) = 0. Cela signifie que He 2 n’est pas une molécule stable.,
liaisons multiples
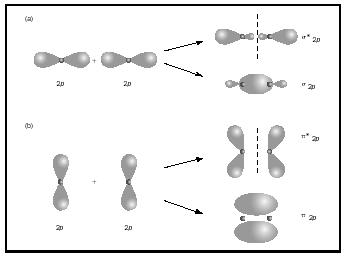
Les liaisons doubles ou triples impliquent deux ou trois paires d’électrons de liaison. Les liaisons simples sont toujours des liaisons sigma, mais dans les liaisons multiples, la première liaison est sigma, tandis que les deuxièmes ou troisièmes liaisons sont des liaisons pi. Le chevauchement des orbitales p peut produire pi ou sigma MOs, comme le montre la Figure 3. Quand ils se chevauchent bout à bout, ils forment sigma orbitales, mais quand ils se chevauchent un côté à l’autre, ils forment des orbitales pi.
Considérons maintenant la molécule d’oxygène., La structure de Lewis pour l’oxygène est :√::Ö: La double liaison est nécessaire pour satisfaire la règle de l’octet pour les atomes d’oxygène. La longueur de liaison mesurée pour l’oxygène soutient la présence d’une double liaison. Pourtant, nous savons que cette formule de Lewis ne peut pas être la structure correcte pour l’oxygène car l’oxygène est paramagnétique, ce qui signifie que la molécule d’oxygène doit avoir des électrons non appariés.
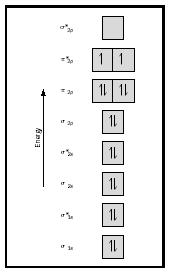
regardez maintenant le diagramme MO pour l’oxygène, qui est illustré à la Figure 4. Il indique toujours un ordre de liaison de 2 , mais il montre également deux électrons non appariés.
la théorie MO fonctionne également bien pour les molécules plus grandes telles que N 2 O, CO 2 et BF 3 et pour les ions tels que NO 3 − et CO 3 2−, dans lesquels les Mo de liaison sont délocalisés , impliquant trois atomes ou plus. Il est particulièrement utile pour les molécules matiques aromatiques telles que le benzène. Dans ce cas, les six atomes C du cycle sont également impliqués dans un nuage d’électrons Pi délocalisé qui enveloppe la molécule entière., La théorie MO peut même être étendue aux ions complexes et aux solides, y compris aux matériaux tels que les supraconducteurs et les semi-conducteurs.