molecular orbital (MO) teorien er en måde at se på strukturen af et molekyle ved hjælp af molekylære orbitals, der hører til molekylet som helhed
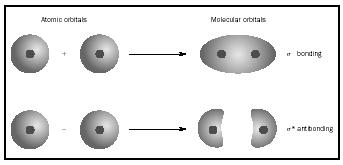
snarere end til de enkelte atomer. Når der opstår simpel binding mellem to atomer, optager parret af elektroner, der danner bindingen, en MO, der er en matematisk kombination af bølgefunktionerne i atomorbitalerne i de to involverede atomer. MO-metoden stammer fra Friedrich hunds og Robert S. Mulliken ‘ s arbejde. når atomer kombineres for at danne et molekyle, er antallet af orbitaler i molekylet lig med antallet af orbitaler i de kombinerende atomer. Når to meget enkle atomer, hver med en atomisk orbitale, kombineres, dannes to molekylære orbitaler., Den ene er en bindende orbital, lavere i energi end atomare orbitaler og afledt af deres sum. Det hedder sigma. Den anden er en antibonding orbitale, højere i energi end atomare orbitaler, og som følge af deres forskel. Det hedder sigma-starred (σ *). (Se diagrammet i Figur 1.)
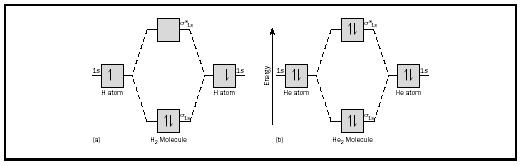
den grundlæggende id.kan bedst illustreres ved at overveje diatomiske molekyler af hydrogen og helium. Energidiagrammerne er vist i figur 2. Hvert hydrogenatom har en 1 s elektron. I H 2-molekylet går de to brintelektroner ind i den laveste energi MO, der er tilgængelig, sigma-orbital., I tilfælde af helium har hvert heliumatom to elektroner, så He 2-molekylet ville have fire. To ville gå ind i den nedre energibindende orbital, men de to andre skulle gå ind i den højere energi sigma-stjernede orbital.
Bond Order
bond order for et molekyle kan bestemmes som følger: bond order=. (bonding electrons − antibonding electrons). Derfor har H 2-molekylet en bindingsordre på. (2 − 0) = 1. Med andre ord er der en enkelt binding, der forbinder de to H-atomer i H 2-molekylet. I tilfælde af He 2 er obligationsordren på den anden side = (2 − 2) = 0. Det betyder, at He 2 ikke er et stabilt molekyle.,
flere bindinger
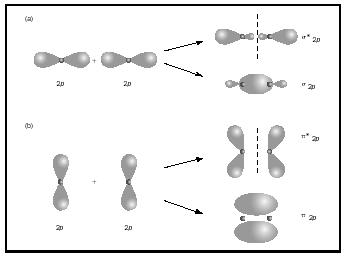
Dobbelt-eller tredobbeltbindinger involverer to eller tre par bindingselektroner. Enkeltobligationer er altid sigma-obligationer, men i flere obligationer er den første obligation sigma, mens enhver anden eller tredje obligation er pi-obligationer. Overlapningen af p orbitaler kan give enten pi eller sigma MOs, som vist i figur 3. Når de overlapper ende til ende, danner de sigma orbitaler, men når de overlapper side til side, danner de pi orbitaler.
overvej nu iltmolekylet., Le .is-strukturen for ilt er :Ö::Ö: dobbeltbindingen er nødvendig for at tilfredsstille oktetreglen for begge iltatomer. Den målte bindingslængde for ilt understøtter tilstedeværelsen af en dobbeltbinding. Alligevel ved vi, at denne Le .is-formel ikke kan være den rigtige struktur for ilt, fordi ilt er paramagnetisk, hvilket betyder, at iltmolekylet skal have uparrede elektroner.
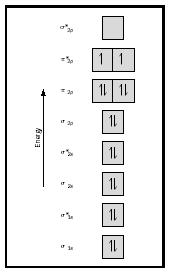
Se nu på MO-diagrammet for ilt, som er vist i figur 4. Det angiver stadig en bindingsordre på 2, men det viser også to uparrede elektroner.
Den MO-teorien fungerer også godt for større molekyler såsom N 2 O, CO 2 , og BF 3 og for ioner som NR 3 − og CO 3 2− , hvor limning MOs er delocalized, der involverer tre eller flere atomer. Det er især nyttigt til aromatiske matiske molekyler såsom ben .en. I dette tilfælde er alle seks C-atomer i ringen lige involveret i en delokaliseret pi-elektronsky, der omslutter hele molekylet., MO-teorien kan endda udvides til komplekse ioner og til faste stoffer, herunder materialer som superledere og halvledere.