Lásd az előző bejegyzést a 6 fontos EAS reakciók tudni a DAT.
most a benzol szubsztituensekre kell összpontosítanunk, és hogyan befolyásolják a későbbi kiegészítések helyét., Itt a lista, akiket nagy valószínűséggel lásd:
Elektron Adományozók / Aktivátorok (legerősebb, hogy a leggyengébb): -O–, -NR2, -NH2, -Ó, -VAGY, -R
Elektron Withdrawers / Deactivators (legerősebb, hogy a leggyengébb): -NO2-NR3+, -NH3+, -SO3H, -KN-CO2H, -CO2R, -HOPP, -X (Halogén)
Általánosságban elmondható, hogy elektron adományozók / aktivátorok egy magányos pár elektronok, vagy egy elektron sűrűség, hogy “tolja” a benzol. Az elektronkivonók / deaktivátorok pozitív töltéssel rendelkeznek a szubsztituensre vagy egy nagyon elektronegatív atomra, amely “kihúzza” az elektronokat a benzolból.,
– minden aktivátor Orto-para rendező.
– A Deaktivátorok (halogének) Orto-para irányúak.
– Deaktivátorok (nem halogének) meta-rendezés.
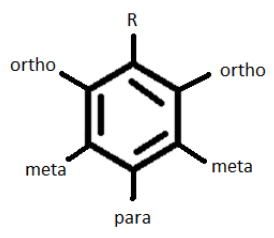
ezért a kezdeti szubsztituens (R) jellegétől függően egy későbbi szubsztituens kerül az ortho vagy para pozícióba, ha R aktivátor / halogén vagy meta pozíció, ha deaktivátor (de nem halogén).,
egyéb tények, amelyeket tudni kell:
- minél több elektron adományozó csoport van a benzolgyűrűben, annál gyorsabban fordul elő EAS reakció (a megnövekedett elektronsűrűség miatt, hogy a benzol jobb nukleofil legyen).
- ha már két vagy több szubsztituens van a gyűrűn, akkor a legerősebb adományozó csoport elsőbbséget élvez a hozzáadott szubsztituens helyének kiválasztásakor.
- ortho / para választás esetén a szubsztituensek a legkevésbé steril törzsű helyre kerülnek.