podívejte se na náš předchozí příspěvek o 6 důležitých reakcích EAS, které znáte pro dat.
nyní se musíme zaměřit na substituenty benzenu a na to, jak ovlivňují umístění následných přírůstků., Zde je seznam těch, které byste s největší pravděpodobností viděli:
elektronové donátory / aktivátory (nejsilnější až nejslabší): -o–,- NR2,- NH2,- OH,- nebo,- r
elektronové stahovače / deaktivátory (nejsilnější až nejslabší): -NO2,- NR3+,- NH3+,- SO3H,- CN,- CO2H,- CO2R,- COH,- X (halogeny)
obecně řečeno, elektronogeny donátory / aktivátory mají osamělý pár elektronů nebo elektronovou hustotu, která „tlačí“ do benzenu. Elektronové stahovače / deaktivátory mají kladný náboj na substituentu nebo velmi elektronegativní atom, který je k němu připojen, což „vytáhne“ elektrony z benzenu.,
– všechny aktivátory jsou Orto-para ředitelé.
– deaktivátory (halogeny) jsou Orto-para režie.
– deaktivátory (ne halogeny) jsou meta-režie.
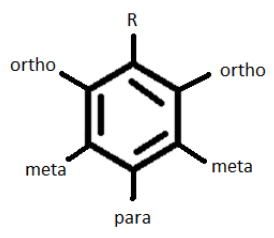
v závislosti na charakteru počátečního substituentu (R) by byl následný substituent umístěn na pozici Orto nebo para, pokud je R aktivátorem / halogenem nebo na pozici meta, pokud se jedná o deaktivátor (r).ale ne halogen).,
další fakta, která je třeba vědět:
- čím více elektronových dárcovských skupin má benzenový kroužek, tím rychleji dojde k reakci EAS (kvůli zvýšené hustotě elektronů, aby se benzen stal lepším nukleofilem).
- Pokud jsou již dva nebo více substituentů na kruhu, nejsilnější darování skupina dostane přednost při výběru umístění přidáno substituent.
- při podání volby Orto / para přejdou substituenti na místo s nejmenším sterickým kmenem.