Kristalline Linse und Katarakt
Joah F. Aliancy, MD und Nick Mamalis, MD
EINFÜHRUNG
Die Linse des Auges ist eine bikonvexe, relativ akelluläre, optisch transparente intraokulare Struktur, die mit der Hornhaut dazu dient, Licht mit minimalem Licht auf die Netzhaut zu streuung (Abb. 1a). Frühe Anatomen betrachteten die Linse als Ort einer sinnvollen Visualisierung., Wir wissen jetzt, dass dies die Funktion der Netzhaut ist, wobei die Linse als Leitung der Lichtdurchlässigkeit und des Fokus auf die Netzhaut dient. Die Linse kann mit Hilfe der Ziliarmuskeln ihre Form verändern, wodurch die Brennweite zur Netzhaut verändert und das Bild scharf auf die Netzhaut fokussiert wird. Diese Einstellung des Objektivs wird als Akkommodation bezeichnet (ähnlich der Fokussierung einer Fotokamera über die Bewegung ihrer Objektive). Die Linse ist auf ihrer Vorderseite flacher als auf ihrer hinteren Seite. (Abb. 1b).
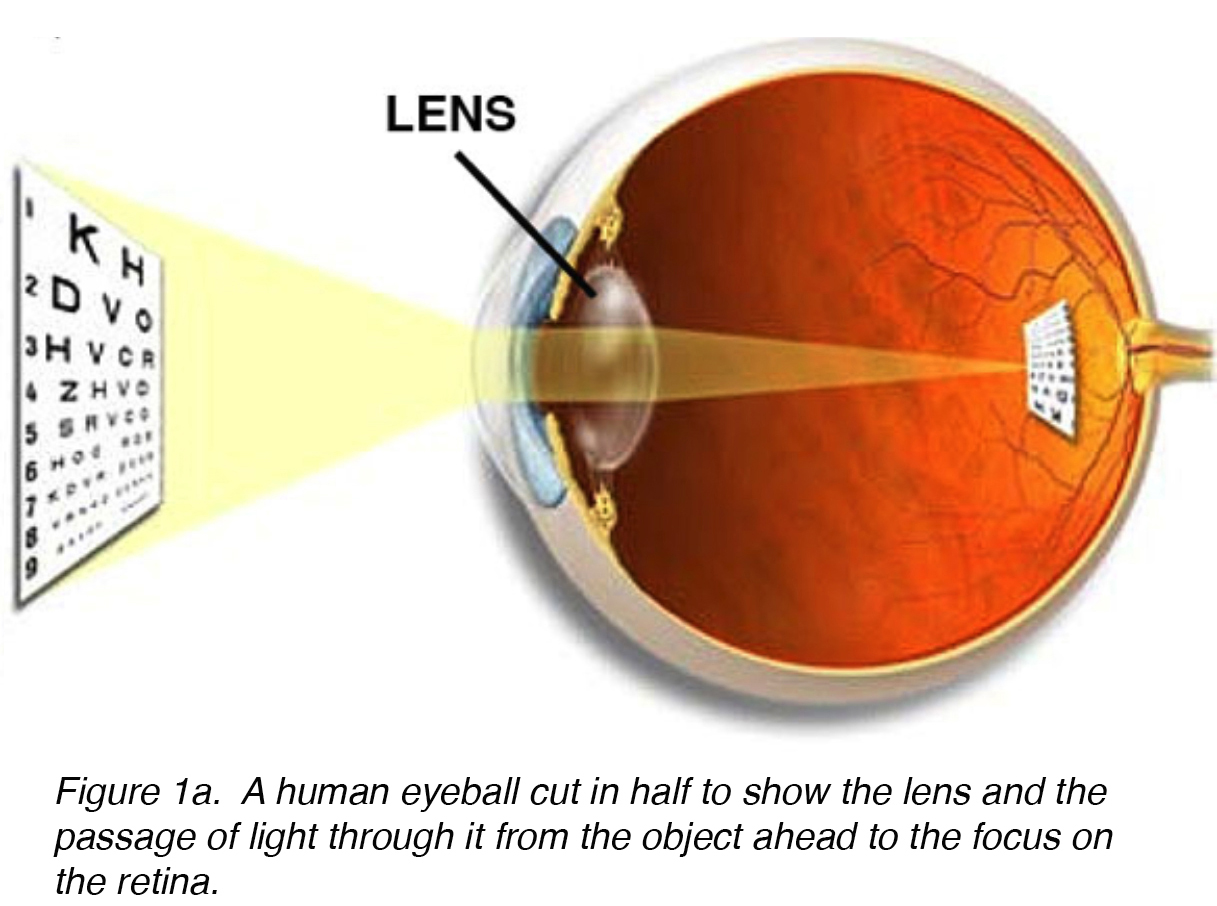
Abbildung 1a)., Ein halbierter menschlicher Augapfel zeigt die Linse und den Lichtdurchgang vom vorausgehenden Objekt zum Fokus auf der Netzhaut.
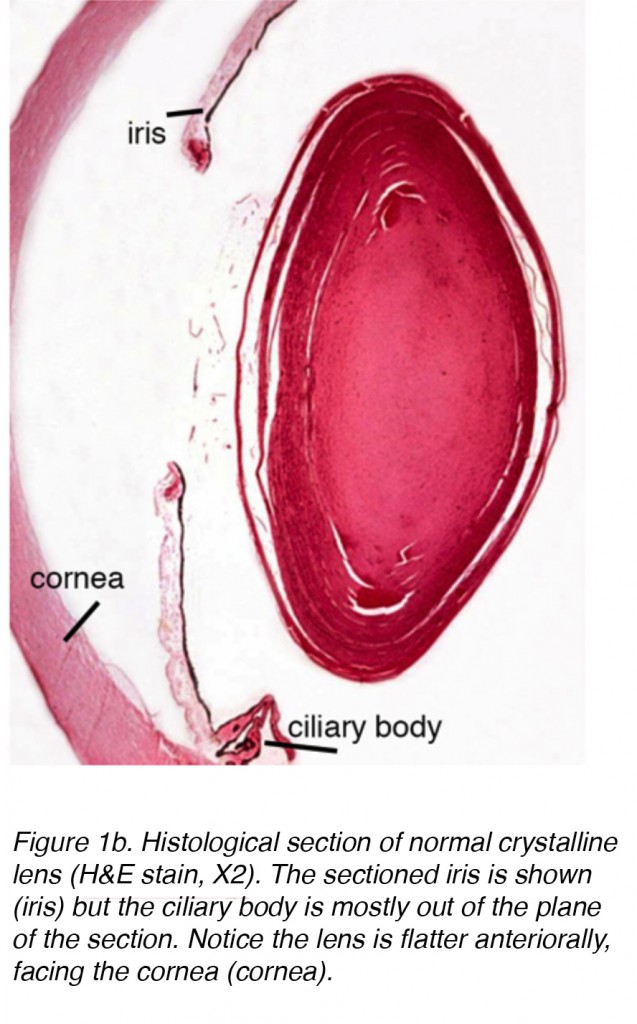
Abbildung 1b. Histologischer Abschnitt der normalen kristallinen Linse (HEcc, X2). Die abgeschnittene Iris wird gezeigt (Iris), aber der Ziliarkörper befindet sich größtenteils außerhalb der Schnittebene. Beachten Sie, dass die Linse anterior flacher ist und der Hornhaut (Hornhaut) zugewandt ist.,
ENTWICKLUNG DER LINSE
Die reife Linse stammt aus dem Oberflächen-Ektoderm und entwickelt sich durch einen hochorganisierten Prozess, der mit der neuroektodermen Keimzellschicht korreliert. Früh in der Embryogenese bildet das Diencephalon, neuroektoderm abgeleitetes Gewebe, zwei Ausdünstungen, die als optische Vesikel bezeichnet werden. Die optischen Vesikel induzieren die Bildung der unreifen Linsenzellen, wenn sie mit Oberflächen-Ektoderm in Kontakt kommen. Die unreifen Linsenzellen verdicken sich, um die Linsenplacode zu bilden. Gleichzeitig dringen die optischen Vesikel ein und verursachen eine Vertiefung auf der Linsenplacode, die Linsengrube genannt wird (Abb., 2a).
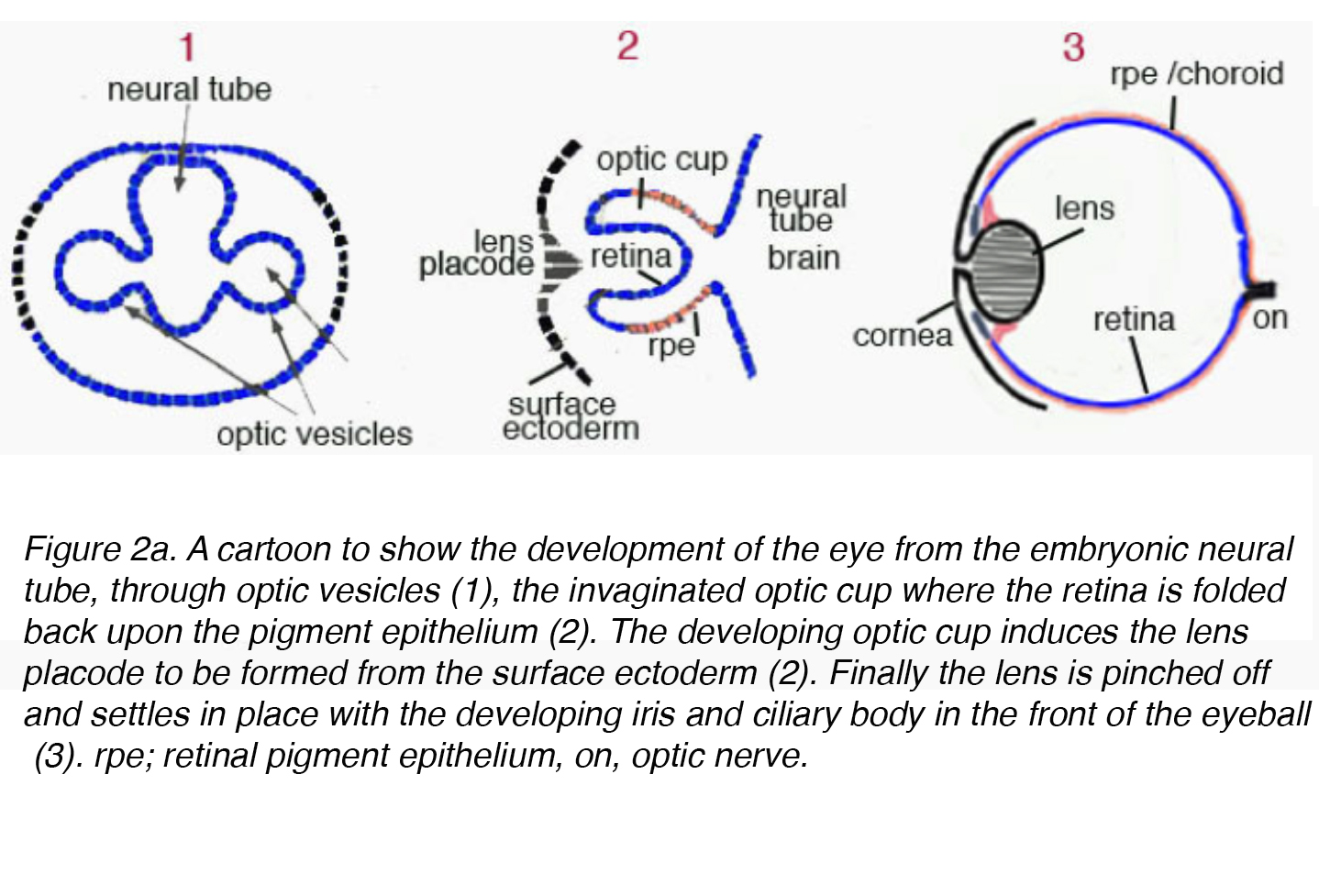
Abbildung 2a. Ein Cartoon, der die Entwicklung des Auges aus dem embryonalen Neuralrohr durch optische Vesikel (1), den invaginierten Optikbecher, zeigt, in dem die Netzhaut auf das Pigmentepithel zurückgefaltet ist (2). Der sich entwickelnde Optikbecher induziert die Bildung der Linsenplacode aus dem Oberflächen-Ektoderm (2). Schließlich wird die Linse abgeklemmt und setzt sich mit der sich entwickelnden Iris und dem Ziliarkörper an der Vorderseite des Augapfels ab (3). rpe; retinales Pigmentepithel, auf, Sehnerv.,
An dieser Stelle besteht das Linsenbläschen aus einer einzigen Zellschicht, die von einer äußeren Basalmembran umhüllt ist. Diese Basalmembran bildet schließlich die Linsenkapsel. Während sie in der Basalmembran eingeschlossen sind, erstrecken sich die Zellen im hinteren Pol des Linsenbläschens nach vorne, um die primären Linsenfasern zu bilden (Abb. 2a)
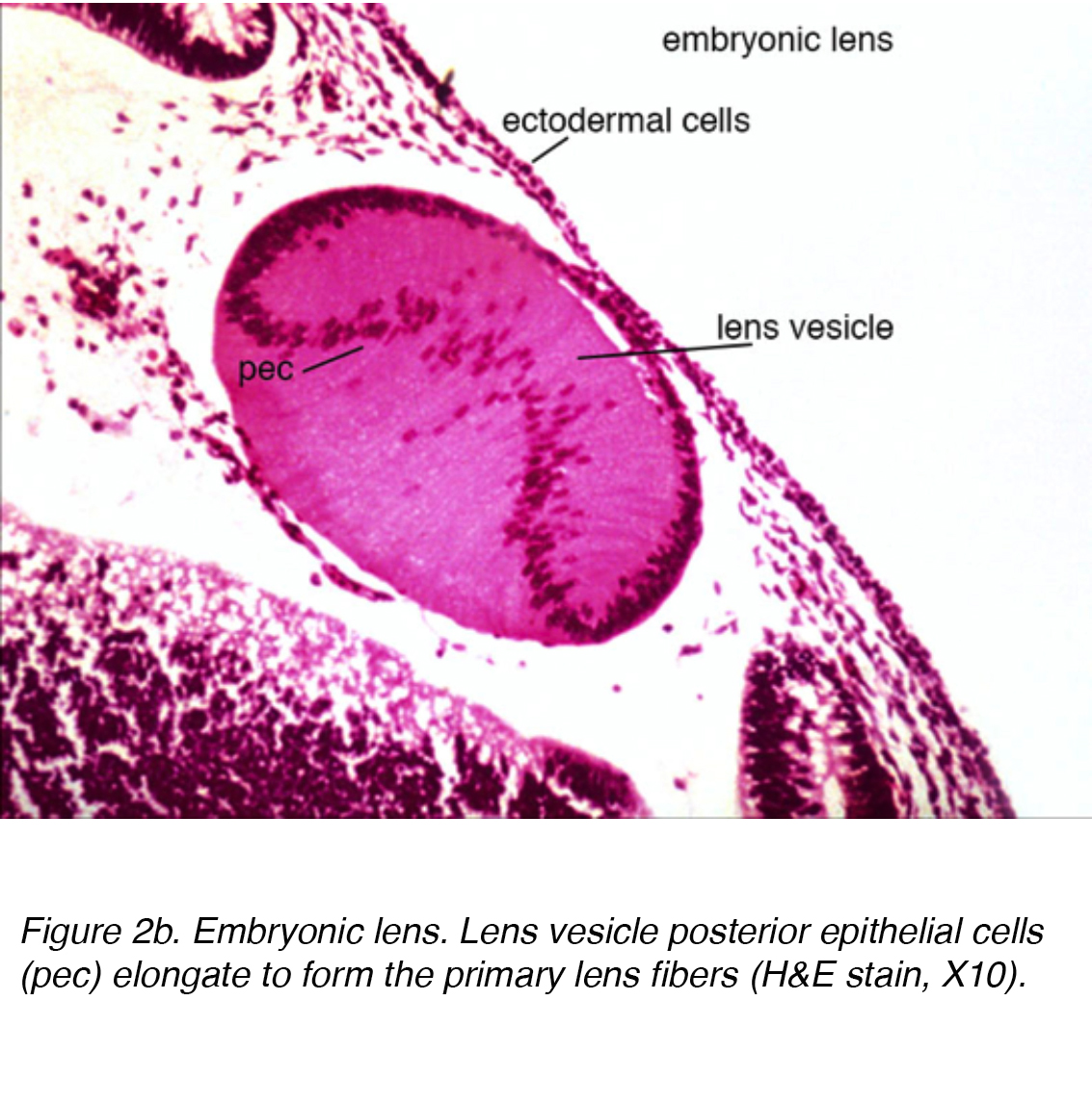 Abbildung 2b. Embryonale Linse. Linsenbläschen posteriore Epithelzellen (pec) dehnen sich aus, um die primären Linsenfasern zu bilden (HE10, X10).,
Abbildung 2b. Embryonale Linse. Linsenbläschen posteriore Epithelzellen (pec) dehnen sich aus, um die primären Linsenfasern zu bilden (HE10, X10).,
Die vorderen Zellen werden zu den Linsenepithelzellen, während die primären Linsenfasern gemeinsam den embryonalen Kern bilden. Anschließend beginnen sich sekundäre Linsenfasern aus den Linsenepithelzellen zu dehnen, um den fötalen Kern während der Tragzeit zu bilden, und wachsen weiter in mehreren Schichten. Da sich die sekundären Linsenfasern vom Äquator aus dehnen, bilden sie Y-förmige Nähte, indem sie sich während des fetalen Wachstums nach vorne und nach hinten treffen. Die sekundären Linsenfasern wachsen schließlich, um den erwachsenen Kern mit neuen Schichten von Linsenfasern zu bilden, die den lentikulären Kortex bilden., Während der Linsenentwicklung liefert die Arteria hyaloideus Nährstoffe und Wachstumsfaktoren durch die Tunica vasculosa lentis, eine Gefäßstruktur, die den Linsenkern umhüllt. Diese Struktur erfährt jedoch vor der Geburt eine Involution, um der beim Erwachsenen beobachteten avaskulären Linse zu ähneln. Ein festes Verständnis der Embryologie und Entwicklung der Linse wird einen guten Einblick in die Pathologie geben, die mit der Kataraktbildung verbunden ist.,
HISTOLOGIE DER LINSE
Abbildung 3 zeigt einen befleckten Abschnitt der erwachsenen menschlichen Linse mit dem vorderen Teil der Linse im oberen Abschnitt und dem hinteren Teil im unteren Abschnitt.
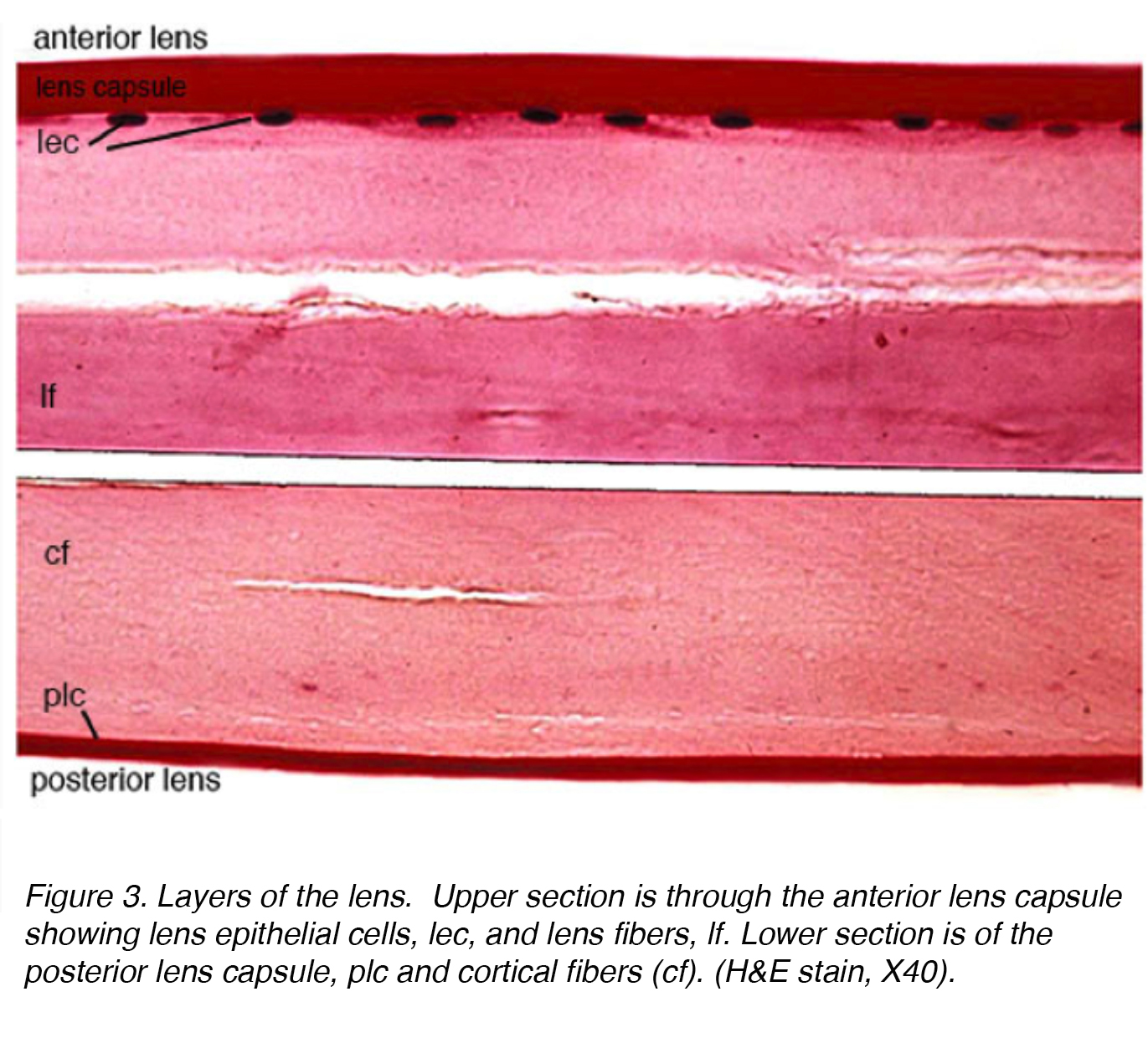
Abbildung 3. Schichten der Linse. Oberer Abschnitt ist durch die vordere Linsenkapsel zeigt Linsenepithelzellen, lec und Linsenfasern, lf. Der untere Abschnitt besteht aus der hinteren Linsenkapsel, plc und kortikalen Fasern (cf). (H&Ecc, X40).
Die Linse besteht aus 4 Strukturen: Kapsel, Epithel, Kortex und Kern (Abb. 3)., Die Kapsel ist die Basalmembran mit Kollagen vom Typ VI, das von der Epithelschicht ausgearbeitet wird, und färbt sich positiv mit periodischem Säure-Shiff (PAS) – Fleck. Es ist optisch klar und azellulär. Die Linse wird durch zonuläre Fasern, die auch als Zonulare von Zinn bekannt sind, an Ort und Stelle gehalten (Abb. 4). Diese elastischen Fasern stammen aus der nichtpigmentierten Epithelschicht des Ziliarkörpers und artikulieren sich mit der äußeren Schicht der Kapsel, der kapsellamellaren Schicht., Es gibt eine Verringerung der zonulären Spannung mit Kontraktion des Ziliarmuskels, die zu einer kugelförmigeren Form führt, die den Fokus auf proximalere Objekte ermöglicht. Dieser Prozess wird als Unterkunft bezeichnet.
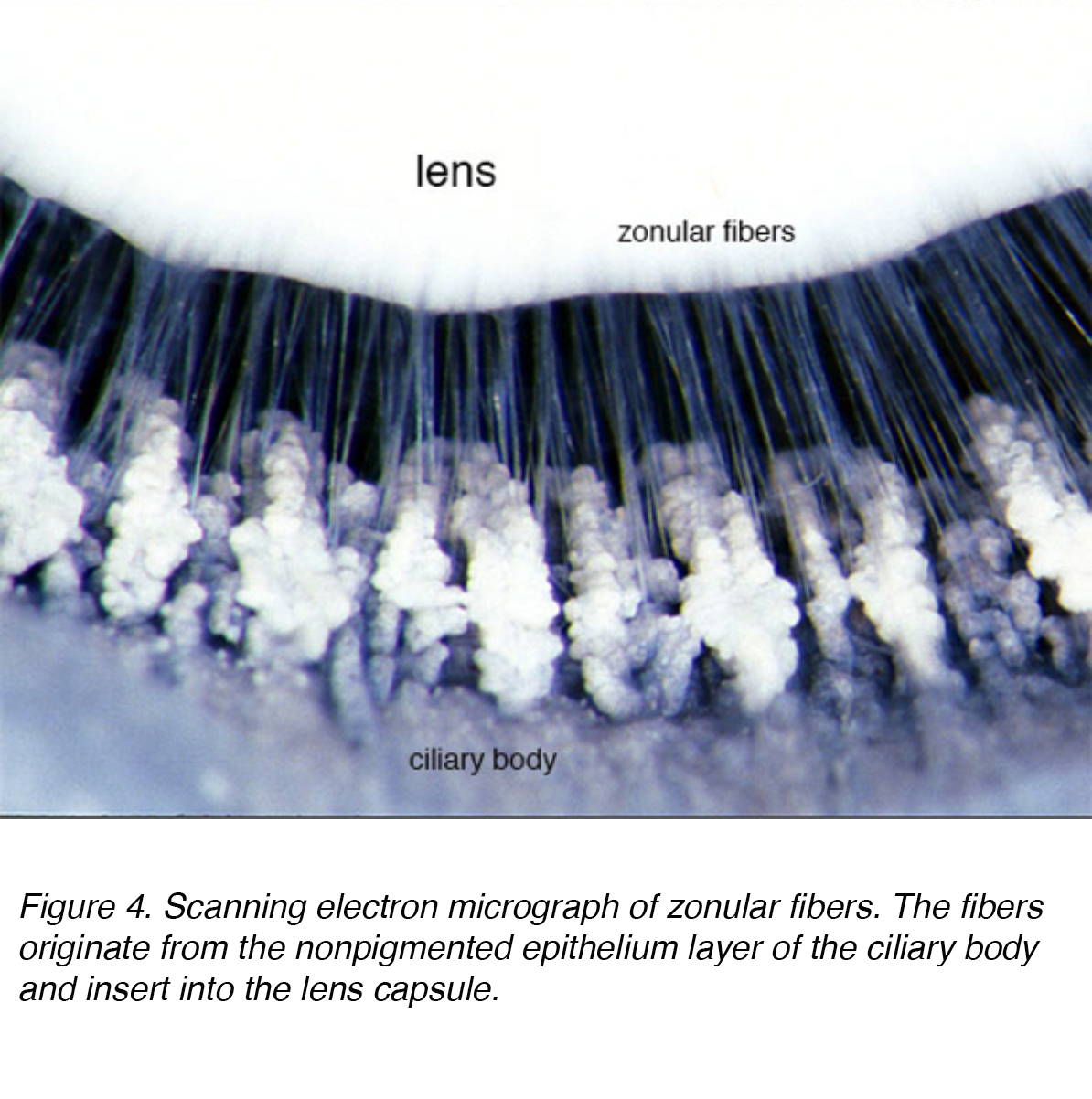
Abbildung 4. Rasterelektronenmikrograph von Zonularfasern. Die Fasern stammen aus der nichtpigmentierten Epithelschicht des Ziliarkörpers und werden in die Linsenkapsel eingeführt.
Das Linsenepithel hat mitotisch aktive Zellen, die über einen Verlängerungsprozess, eine Zunahme des intrazellulären Proteins und einen Verlust von Organellen einer weiteren Differenzierung unterzogen werden., Diese Zellen sind in einer Schicht über den hinteren Aspekt der vorderen Kapsel angeordnet. Im äquatorialen Bogenbereich der Linse dehnen sich Linsenepithelzellen aus, um Linsenfaserzellen zu bilden (Abb.5). Die terminale Differenzierung des Epithels führt schließlich zu den Faserschichten sowohl des Kortex als auch des Kerns, wobei ältere Fasern zentraler angeordnet sind.
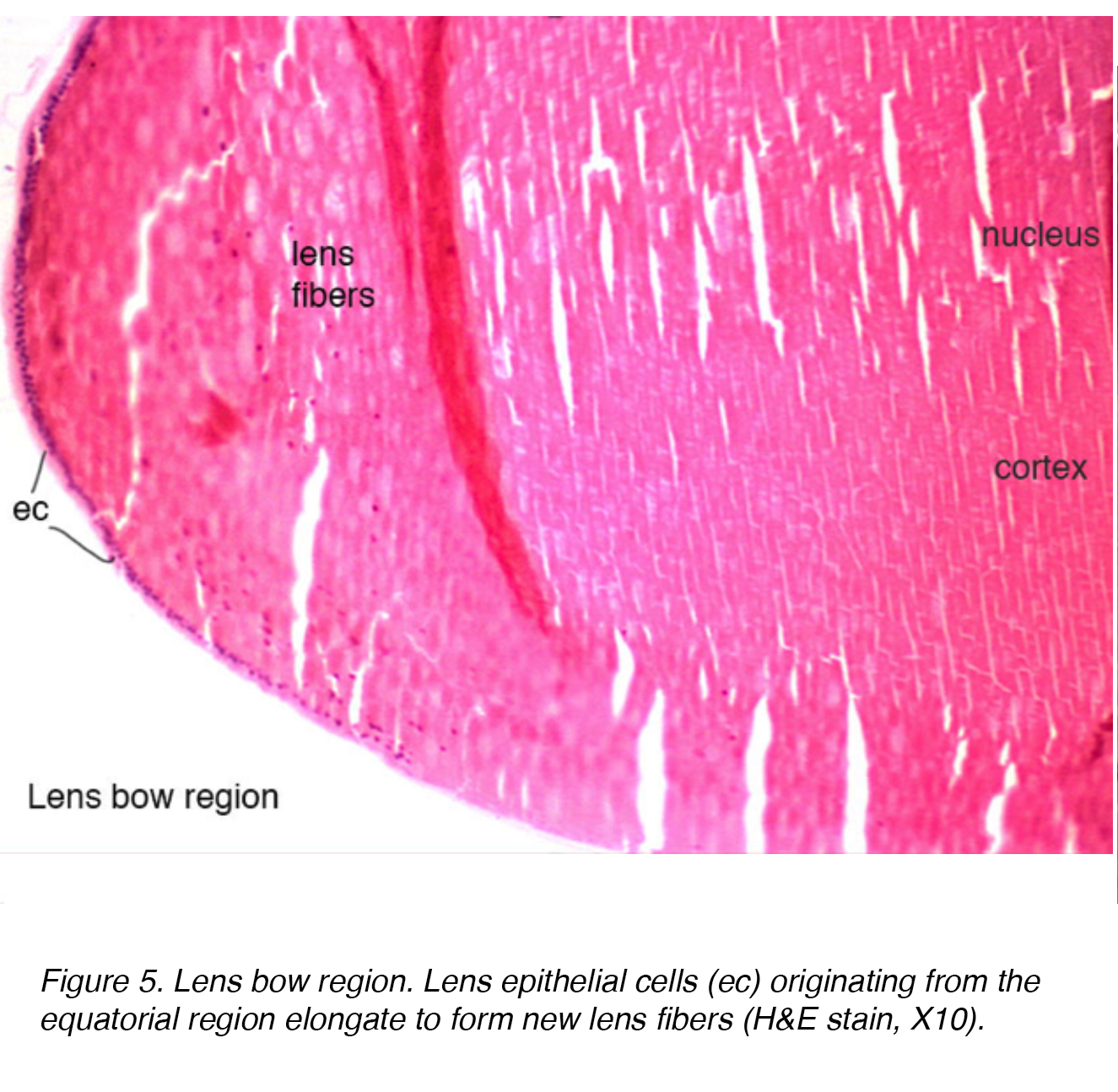
Abbildung 5. Objektiv bogen region. Linsenepithelzellen (ec), die aus der äquatorialen Region stammen, dehnen sich zu neuen Linsenfasern aus (H&E10, X10).,
Während der Kern histologisch dichter ist, gibt es keinen Unterschied zwischen Kortex und Kern (Abb. 5). Der einzige nennenswerte Unterschied ist das Alter, wobei ältere Schichten zentraler liegen. Interessanterweise nimmt die gesamte Dioptrienstärke der Linse aufgrund des erhöhten Durchmessers und der Krümmung der Linse zu, wenn die Kortex-und Kernschichten wachsen. Der Mangel an Organellen innerhalb des Kerns und Kortex dient dazu, ein optisch klares Medium für die Lichtdurchlässigkeit bereitzustellen. Die erwachsene Linse ist fast dreimal so groß wie die entsprechende neonatale Version, 90 mg bis 250 mg.,
Bei Erwachsenen fehlt es der Linse an Vaskularität oder Innervation Somit wird der metabolische Bedarf der Linse durch einen konstanten Fluss von wässrigem Humor gedeckt, der sowohl als Leitung für die Entfernung von Abfällen als auch für die Zufuhr von Nährstoffen dient.
KATARAKTBILDUNG UND ARTEN VON KATARAKTEN
1) ANGEBORENE KATARAKTE
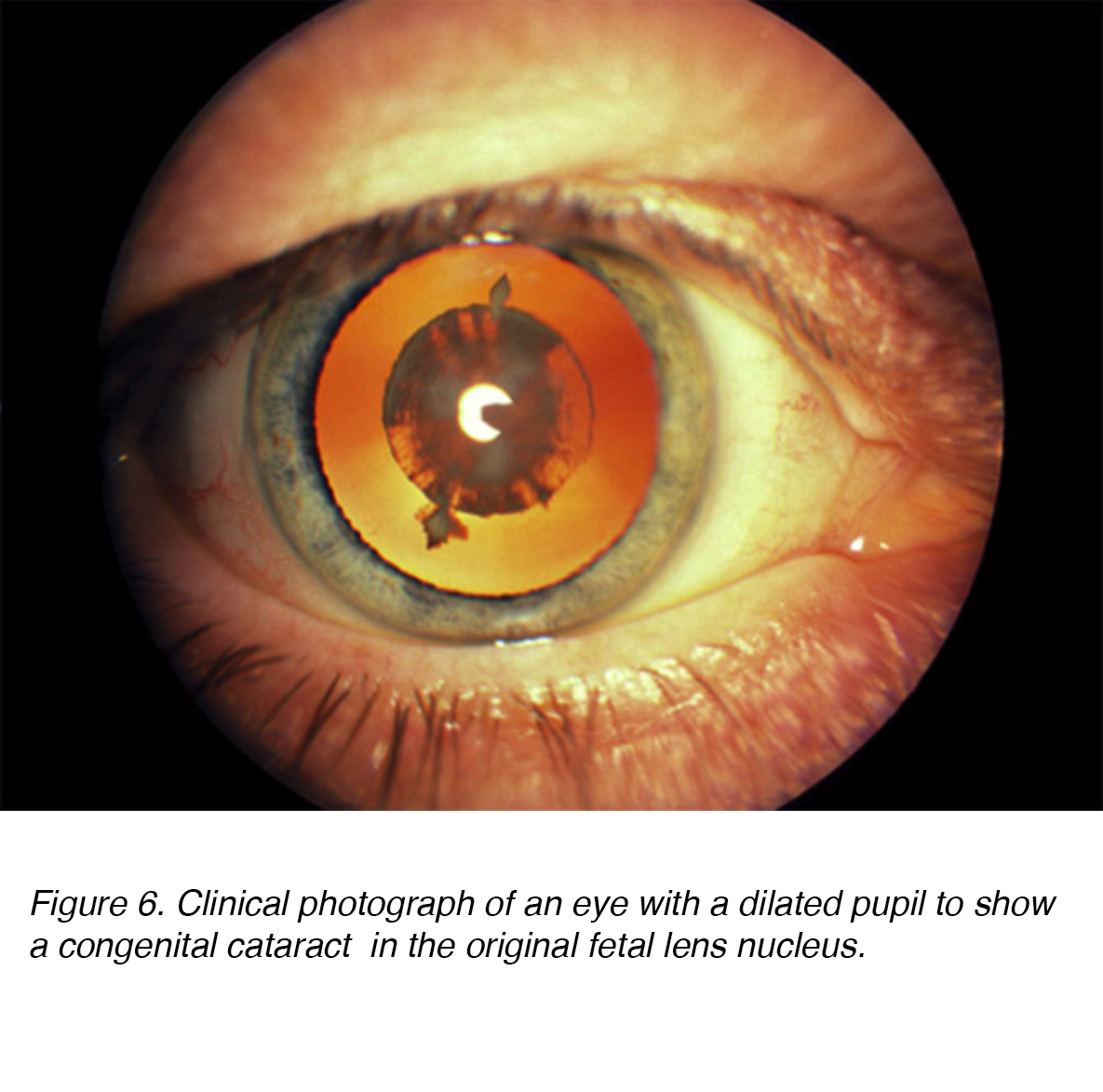
Abbildung 6. Klinisches Foto eines Auges mit einer erweiterten Pupille, um einen angeborenen Katarakt im ursprünglichen fötalen Linsenkern zu zeigen.,
Kongenitale Katarakte sind linsenförmige Trübungen, die bei der Geburt oder kurz danach eine signifikante Lichtstreuung verursachen (Abb. 6). Schätzungsweise 200.000 Kinder weltweit sind infolge angeborener Katarakte blind, 40.000 davon in Entwicklungsländern. In Bezug auf die Lateralität scheint die Prävalenz für einseitige vs. bilaterale gleich zu sein. Chirurgische Intervention für einseitige und bilaterale Katarakt ist von größter Bedeutung, um langfristige Deprivation Amblyopie oder Sehverlust zu verhindern., Amblyopie ist definiert als eine Funktionsstörung der visuellen Verarbeitung, die durch eine schlechte Sehschärfe in einem oder beiden Augen und eine abnormale binokulare Tiefenwahrnehmung gekennzeichnet ist. Während beide kritisch zu erkennen sind, scheint der langfristige Schweregrad der bilateralen visuellen Deprivation geringer zu sein als sein einseitiges Gegenstück. .
Die wichtigsten morphologischen Arten angeborener Katarakte werden als zonulär, polar, total und membranös eingestuft. Angeborene zonuläre Katarakte werden als Opazität beschrieben, die in einer bestimmten Linsenregion lokalisiert ist., Je nach Zeitpunkt der Verletzung oder des Entwicklungsfehlers kann ein unterschiedlicher Subtyp auftreten. Wenn die Beleidigung während der ersten 2 Monate der Schwangerschaft auftritt, kann ein embryonaler nuklearer Katarakt auftreten. Verletzungen, die im dritten Schwangerschaftsmonat auftreten, können einen fetalen nuklearen Katarakt bilden, der durch Trübungen zwischen den vorderen und hinteren Y-Nähten gekennzeichnet ist und als Nahtkatarakt bekannt ist. Eine teratologische Ätiologie kann die Arborisierung einer Nahttrübung erklären., Polare Katarakte sind unterschiedliche Trübungen innerhalb des subkapsulären Kortex in den Polarregionen mit anterioren und posterioren Subtypen. Ein Mittendorf-Punkt ergibt sich, wenn das Hyaloidgefäß nicht involviert ist. Es ist als kleiner, dichter weißer Fleck auf der hinteren Oberfläche der Linsenkapsel gekennzeichnet. Die Ätiologie von Katarakten im Säuglingsalter ist breit, einschließlich intrauteriner Infektion, drogeninduzierten Stoffwechselstörungen, Traumata, Augenerkrankungen, erblichem Syndrom und idiopathischen.,
2) NUKLEARER KATARAKT
Eine häufige Ursache für Sehstörungen bei älteren Erwachsenen ist der altersbedingte Katarakt, der als nuklearer, kortikaler oder subkapsulärer Typ unterkategorisiert ist. Kumulative Inzidenz von nuklearen, kortikalen und posterioren kortikalen sind 29,7%, 22,9% bzw. Kernkatarakt ist das häufigste altersbedingte Problem (Abb. 7 und 8).
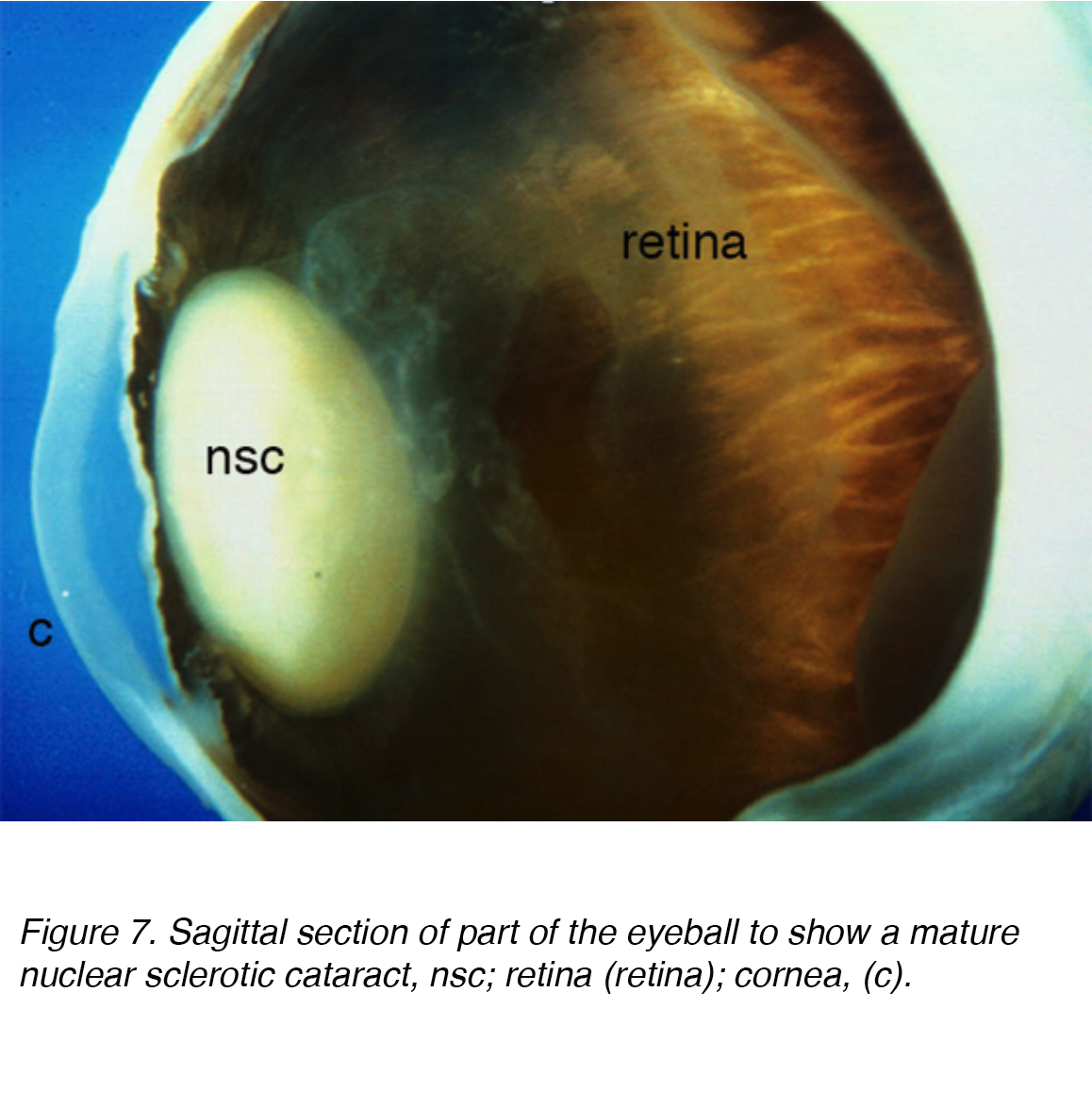
Abbildung 7. Sagittaler Abschnitt eines Teils des Augapfels, um einen reifen kernsklerotischen Katarakt zu zeigen, nsc; Netzhaut (Netzhaut); Hornhaut, (c).
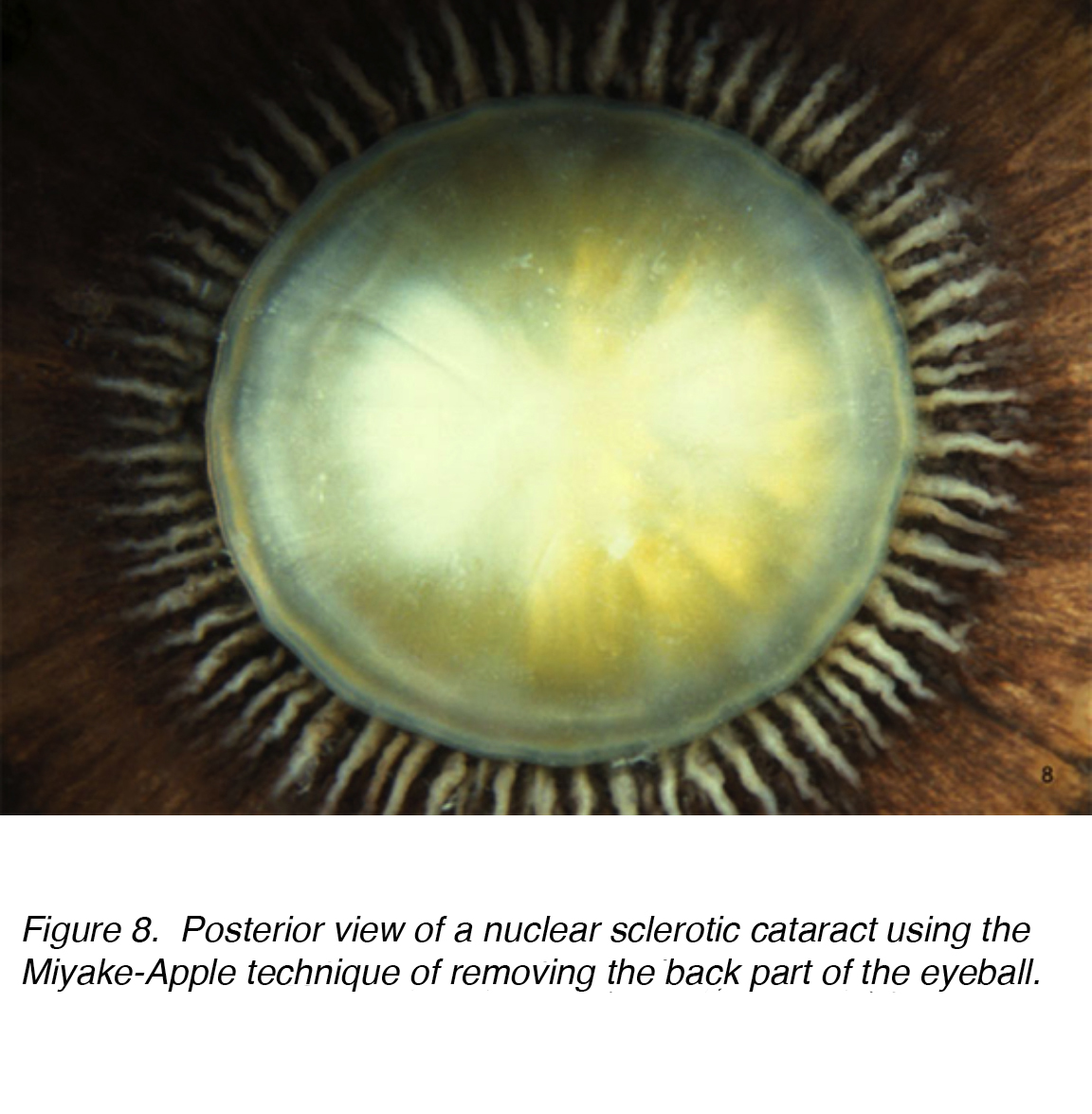
Abbildung 8., Hintere Ansicht eines nuklearen sklerotischen Katarakts mit der Miyake-Apple-Technik zum Entfernen des hinteren Teils des Augapfels.
Mit zunehmendem Alter werden Kernfasern stärker verdichtet und verursachen eine erhöhte Lichtstreuung. Infolgedessen verringern sklerotische Linsenkerne die Transparenz und führen nachts zu visuellen Aberrationen und lästiger Blendung. Klinisch ändert sich die sklerotische Kernlinse in der Farbe, von einem klaren transparenten Material zu gelb oder orange, schließlich sogar zu braun (fluoreszierend), wenn sie reifen gelassen wird (Abb. 9)., Histologisch sind kernsklerotische Linsen durch ein dichtes homogenes Material gekennzeichnet.

Abbildung 9. Isolierter fluoreszierender Katarakt. Kernsklerotischer Katarakt hat mit zunehmendem Alter eine tiefbraune Farbe.
Durch Alterung nimmt das Linsenmaterial an Gesamtgröße zu und wird amorpher. Wenn die Linsenfasern weiter altern, wird der Kern kompakter und weniger biegsam, wodurch die Fähigkeit der Linse, sie effektiv aufzunehmen, verringert wird., Die erhöhte Färbung ist auf die Proteinaggregation in der Kernlinse zurückzuführen, die ihre Transparenz verringert und zu verschiedenen Symptomen führt, einschließlich Sehstörungen, Abnahme der Kontrastempfindlichkeit, dumpfer Farbwahrnehmung und einer kurzsichtigen Verschiebung
Wenn der Katarakt weiter reift, beginnt sich das kortikale Material zu verflüssigen und der Kern nimmt an Opazität zu. Ein hyperreifer Katarakt ist das letzte Stadium des Alterungsprozesses. Der verflüssigte Kortex wird resorbiert und der dichte Kern sinkt innerhalb des Kapselbeutels., Unbehandelt kann proteinhaltiges Material über die Kapselauskleidung austreten und zu einer Obstruktion des trabekulären Netzes (TM) führen, die zu einer phakolytischen glaukomatösen Reaktion führt. Diese Entzündungsreaktion wird durch Makrophagen vermittelt, die auf das Austreten von Linsenprotein reagieren und zur TM-Obstruktion beitragen. Veränderungen innerhalb des Linsenkerns treten nicht unabhängig von der anderen Linsenstruktur auf, sondern kortikale subkapsuläre Katarakte können und treten typischerweise gleichzeitig auf. Der nukleare sklerotische Katarakt ist jedoch bei weitem die häufigste altersbedingte linsenförmige Trübung.,
Abbildung 10 zeigt ein Foto des Auges eines Patienten mit dichtem, reifem Katarakt, der sowohl nukleare als auch kortikale (siehe unten) Komponenten aufweist. Offensichtlich war der Patient in diesem Auge“ blind“, und dieser Katarakt musste entfernt werden, um das Sehvermögen wiederherzustellen.
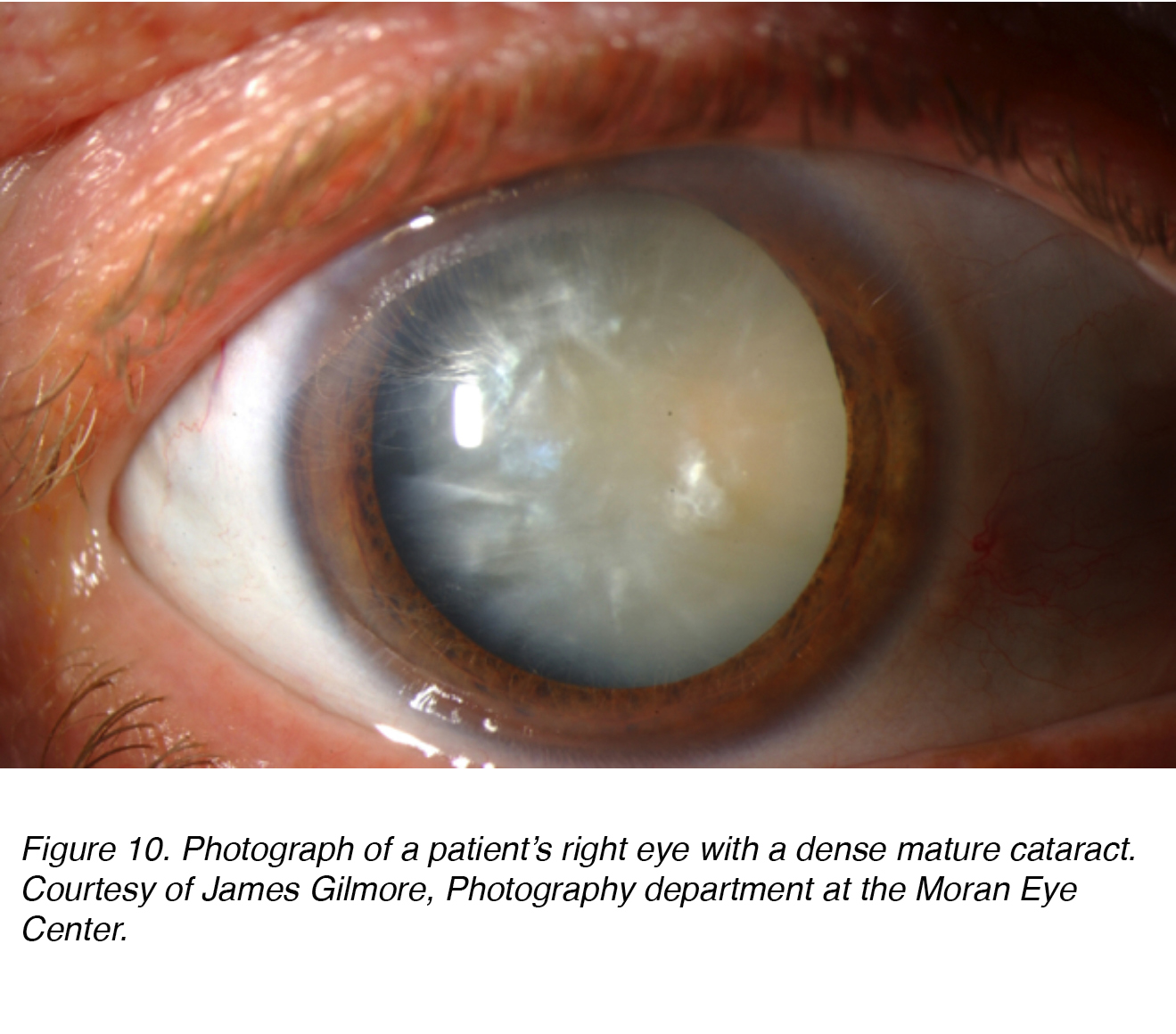
Abbildung 10. Foto des rechten Auges eines Patienten mit einem dichten reifen Katarakt. Mit freundlicher Genehmigung von James Gilmore, Fotografie-Abteilung am Moran Eye Center.
3) KORTIKALE KATARAKTE
Wie bei nuklearen sklerotischen Linsenveränderungen kann das Altern ähnliche degenerative Veränderungen in der Linsenrinde verursachen., Die Trübungen, die innerhalb der Linsenrinde gebildet werden, sind ziemlich einzigartig. Scharfe klare Flüssigkeitsspalten ähneln undurchsichtigen Speichen innerhalb der Linsenrinde, sind zu sehen (Abb. 11,12).
Die Abbildungen 11 und 12 zeigen das typische Erscheinungsbild des kortikalen Katerakts von vorne (Abb. 11) und der Rücken (Abb. 12).
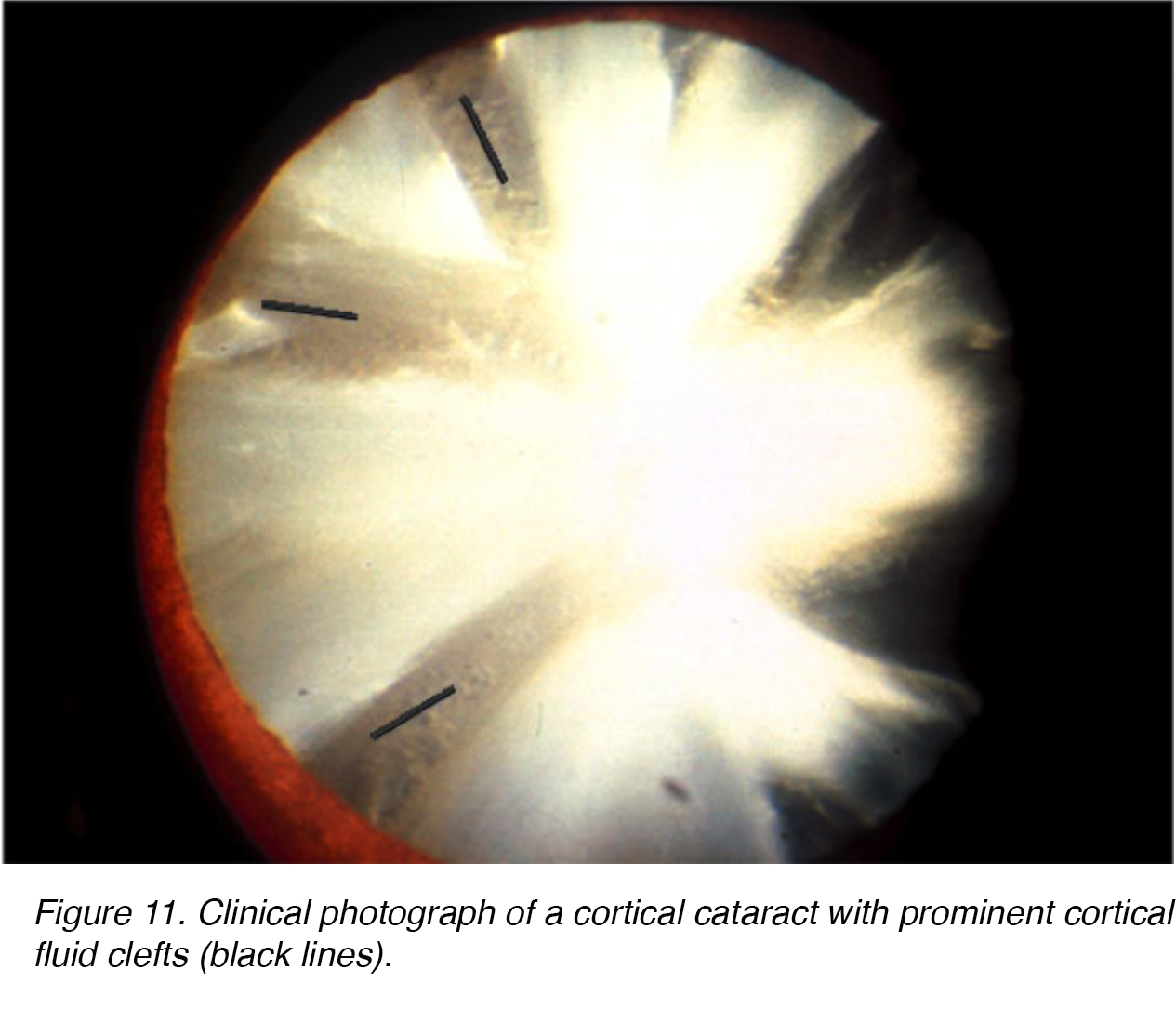
Abbildung 11. Klinisches Foto eines kortikalen Katarakts mit ausgeprägten kortikalen Flüssigkeitsspalten (schwarze Linien).

Abbildung 12. Hintere Ansicht eines kortikalen Katarakts mit der Miyake-Apple-Technik zur Anzeige der Linse., Die flüssigen Spalten sind offensichtlich (schwarze Linien).
Histologisch sind kortikale Katarakte durch eine Ansammlung von rosa färbender eosinophiler Flüssigkeit zwischen kortikalen Fasern gekennzeichnet (Abb. 13).
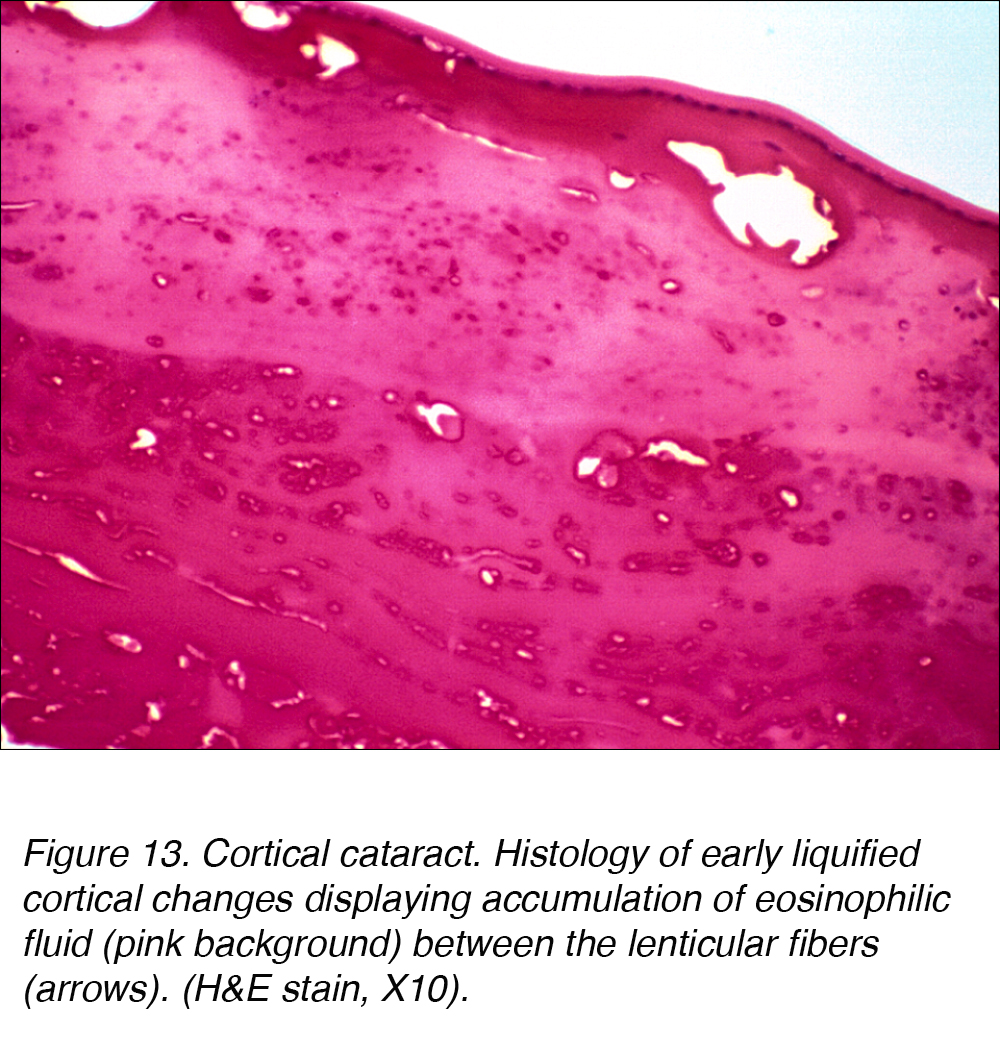
Abbildung 13. Kortikaler Katarakt. Histologie früh verflüssigter kortikaler Veränderungen, Ansammlung von eosinophiler Flüssigkeit (rosa Hintergrund) zwischen den Linsenfasern (Pfeile). (H&E10, X10).
Diese Flüssigkeitsansammlung verursacht Verschiebungen zwischen Linsenzellen, die zu einer Verschiebung und Degeneration angrenzender Zellen führen., Die Verschiebung macht die klinisch gesehenen Speichen aus (Abb.11 und 12). Globuli aus proteinhaltigem Material, sogenannte Morgagnian Globuli, können aus der Degeneration der kortikalen Linsenzellen freigesetzt werden (Abb. 14). Wenn der kortikale Katarakt weiter reift, kann die gesamte kortikale Region durch diese Globuli ersetzt werden und wird so zu einem reifen Morgagnianischen Katarakt (Abb. 15).
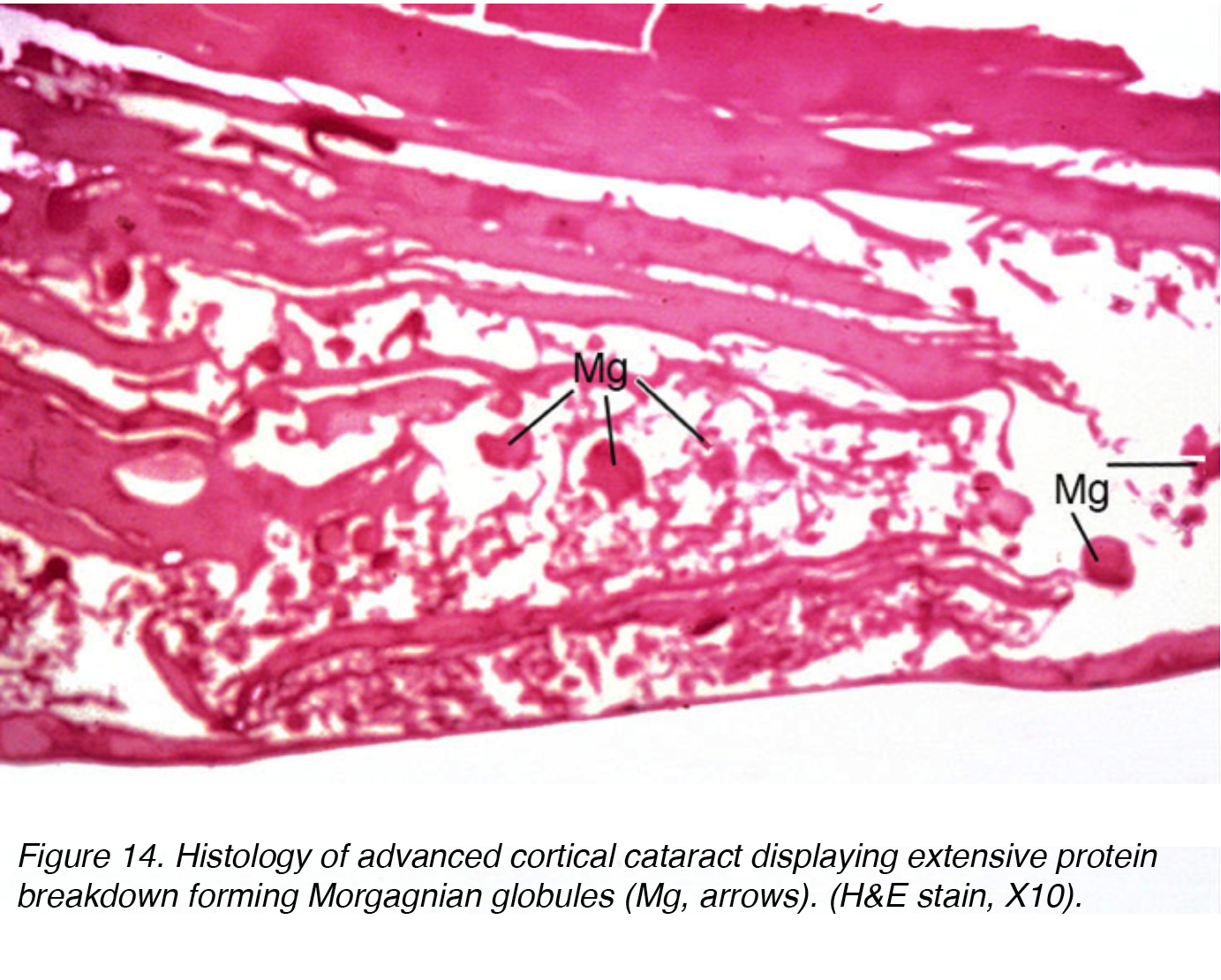
Abbildung 14. Histologie des fortgeschrittenen kortikalen Katarakts mit ausgedehntem Proteinabbau, der Morgagnianische Globuli bildet (Mg, Mg). (H&E10, X10).,
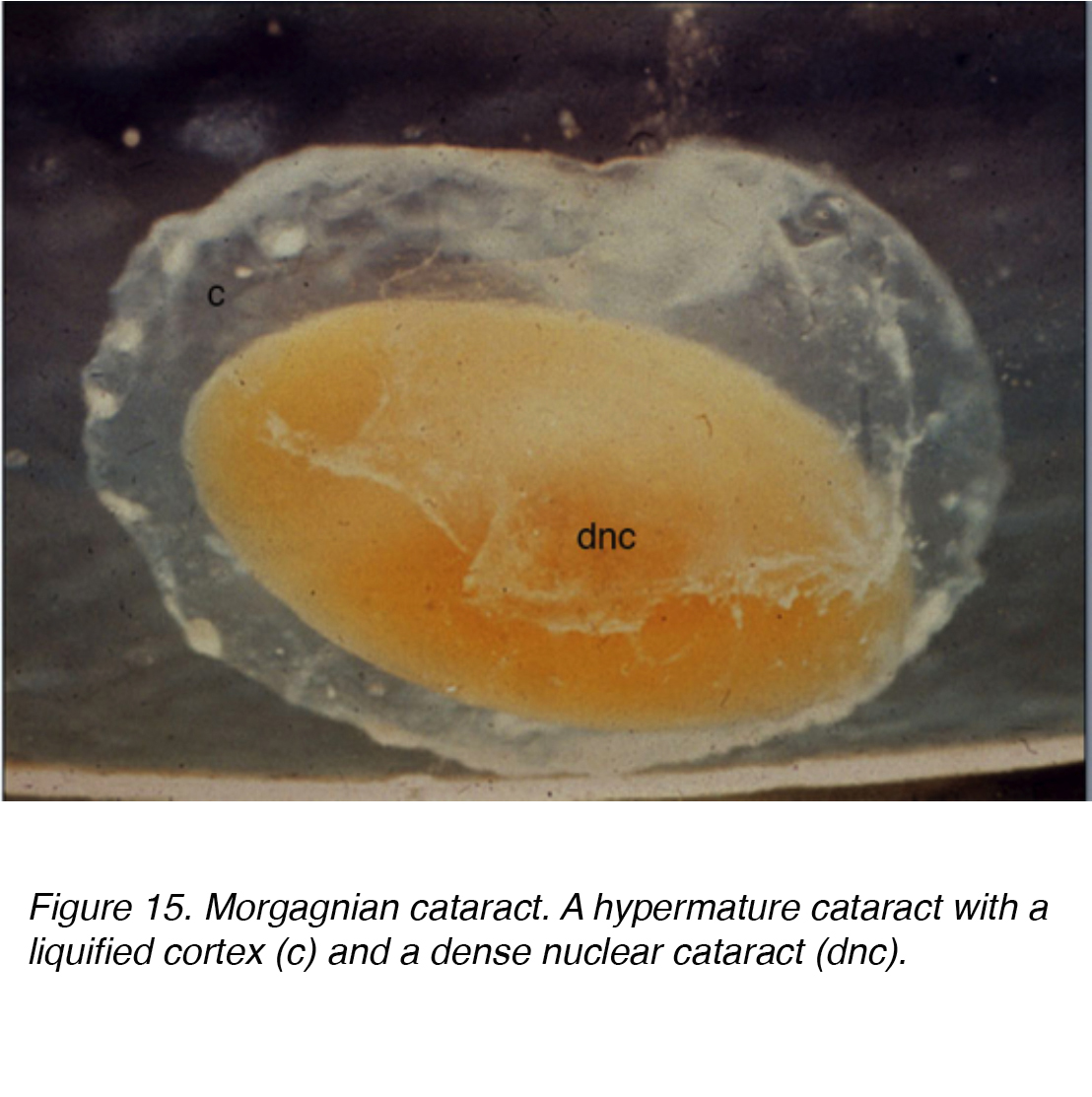
Abbildung 15. Morgagnischer Katarakt. Ein hypermature Katarakt mit einem verflüssigten Kortex (c) und einem dichten nuklearen Katarakt (dnc).
Ein weiteres charakteristisches Aussehen des kortikalen Katarakts ist ein Weihnachtsbaum Katarakt. Dies tritt auf, wenn sich Kristalle innerhalb des tiefen Kortex bilden. Diese Kristalle bestehen typischerweise aus Cholesterin, Lipiden, Kalzium oder anderen Verbindungen. Interessanterweise verursachen Weihnachtsbaum-Katarakte normalerweise keine signifikanten Sehstörungen.,
Während ein kortikaler Katarakt unabhängig von einem nuklearen sklerotischen Katarakt auftreten kann, können biomechanische Veränderungen innerhalb des Linsenkerns tatsächlich kataraktöse Veränderungen in der Linsenrinde hervorrufen. Die Fähigkeit, effektiv unterzubringen, nimmt im Allgemeinen mit dem Alter ab. Die veränderte Biomechanik zwischen dem sklerotischen Kern und dem Kortex erzeugt Reststress und führt zu parallelen Mikrorücken im Bereich der lamellaren Trennung. Dieser Prozess hilft, die histologischen Muster bei kortikalen Katarakten zu erklären.,
4) POSTERIOR SUBKAPSULÄRER KATARAKT
Posteriore subkapsuläre Katarakte (PSC) entwickeln sich aufgrund der posterioren Migration von Linsenepithelzellen als Reaktion auf äußere Reize. Obwohl die meisten Fälle spontan sind, kann sich PSC auch sekundär zu metabolischen Ursachen wie Diabetes, Entzündungen, Uveitis oder durch langfristige topische oder systemische Kortikosteroidanwendung entwickeln. PSC tritt tendenziell bei jüngeren Patienten auf und schreitet schneller voran als die anderen Kataraktsubtypen. Die Opazität befindet sich am hinteren Pol der Linse auf der vorderen Oberfläche der hinteren Kapsel (Abbildung 16 und 17).,
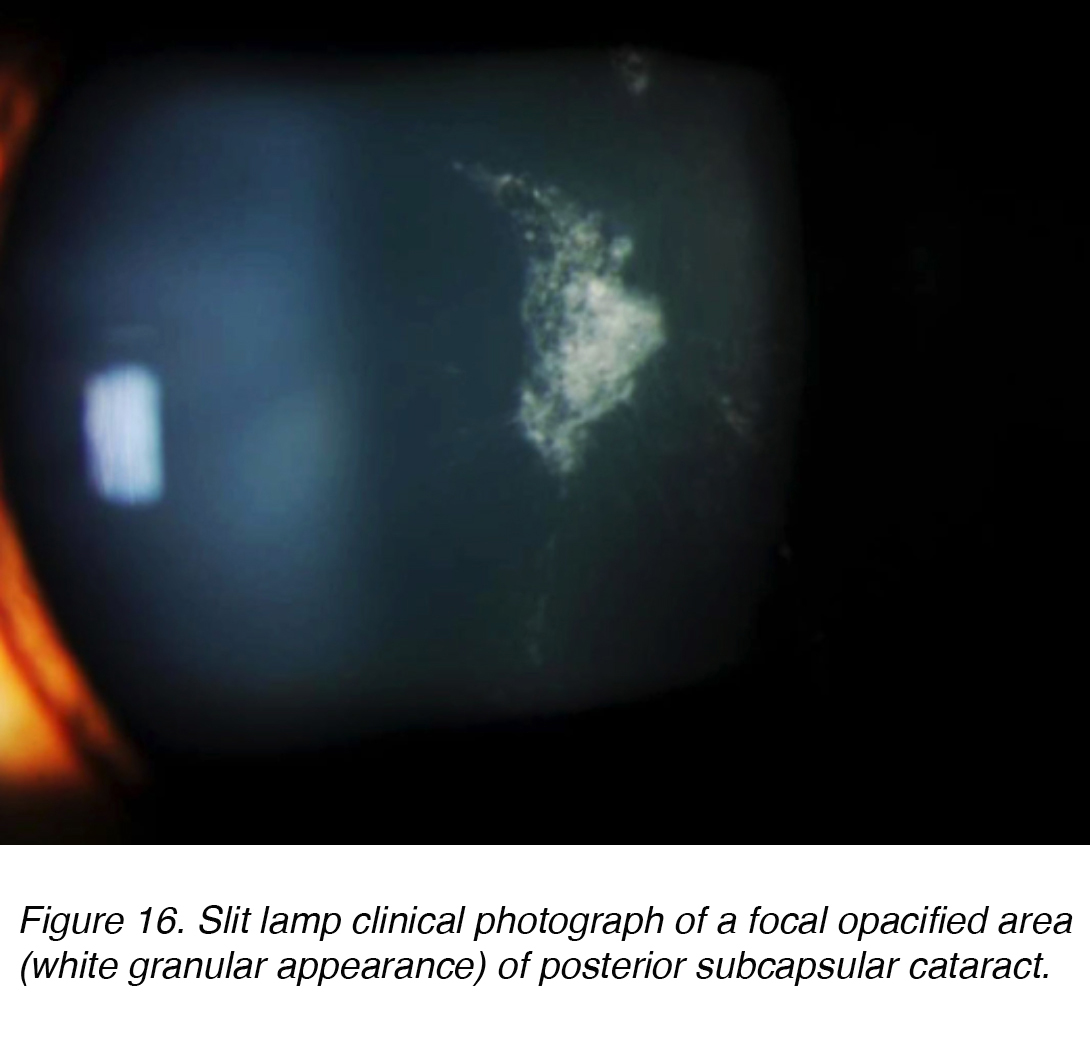
Abbildung 16. Spaltlampe klinische Fotografie eines fokalen trüben Bereichs (weißes körniges Aussehen) des hinteren subkapsulären Katarakts.
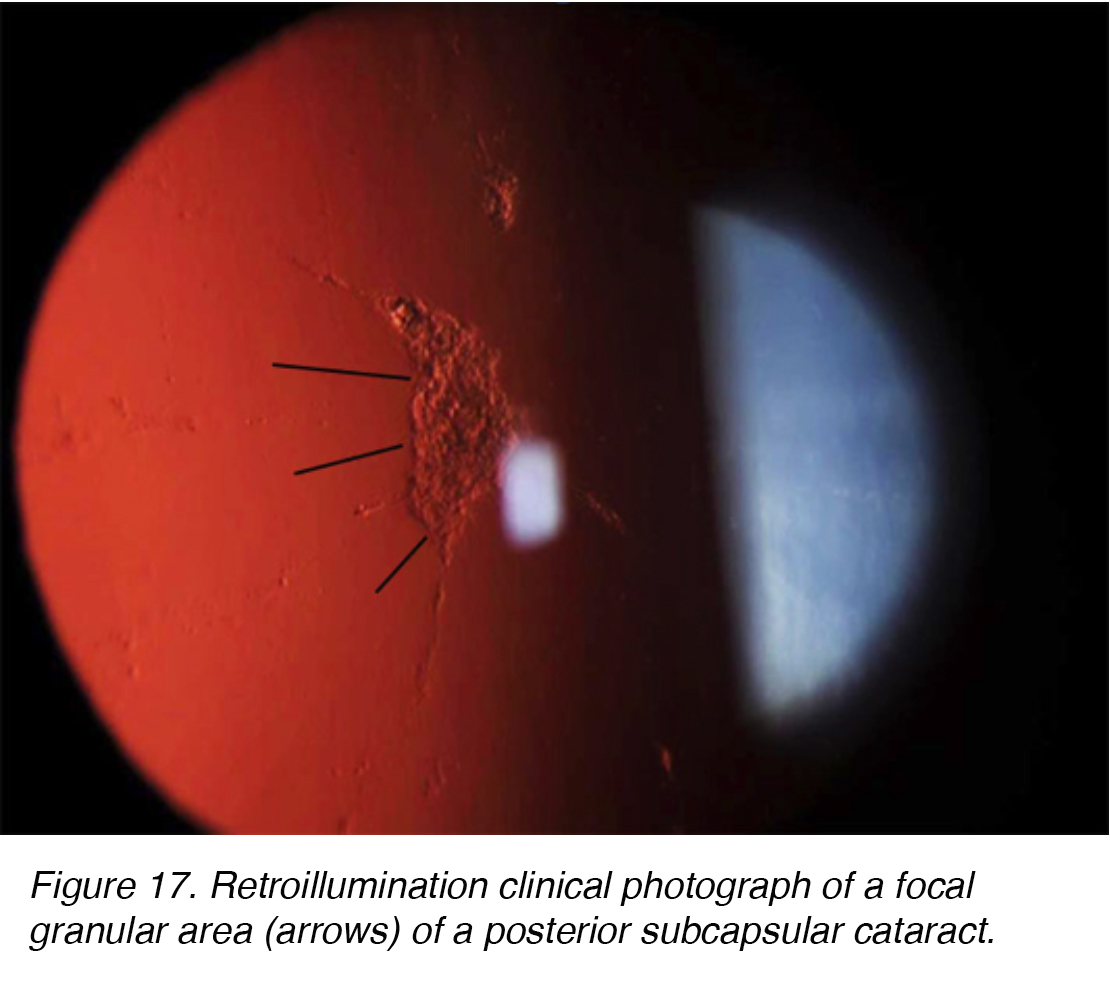
Abbildung 17. Retroillumination klinische Fotografie eines fokalen körnigen Bereichs (Pfeile) eines hinteren subkapsulären Katarakts.
Eine ultrastrukturelle Studie mit 13 Augen mit PSC zeigte die Veränderungen, die stattfanden, als Linsenepithelzellen vom Äquator der Linse in die PSC-Region wanderten., Die Studie kam zu dem Schluss, dass es eine mitotische Veränderung gab, als Zellen in Richtung des hinteren Pols wanderten. Die Zellen der äquatorialen Region ähnelten normalen Linsenepithelzellen, aber die Zellen in der Nähe des PSC zeigten eine erhöhte mitotische Aktivität. Die Autoren schlugen vor, dass die Zellen auf irgendeine Art von schädlichen Reizen am hinteren Pol reagierten. Die resultierende Aktivität führte dazu, dass die Zellen zu Linsenfasern reiften oder sich zu blasenartigen Zellen, sogenannten Wedl-Zellen, vergrößerten und PSC bildeten (Abb. 18)., Die wandernden Zellen tragen wahrscheinlich zur Kataraktbildung bei, indem sie extrazelluläre Materialien, Zytolyse, Zellauflösung und möglicherweise Freisetzung lysosomaler Enzyme sezernieren.
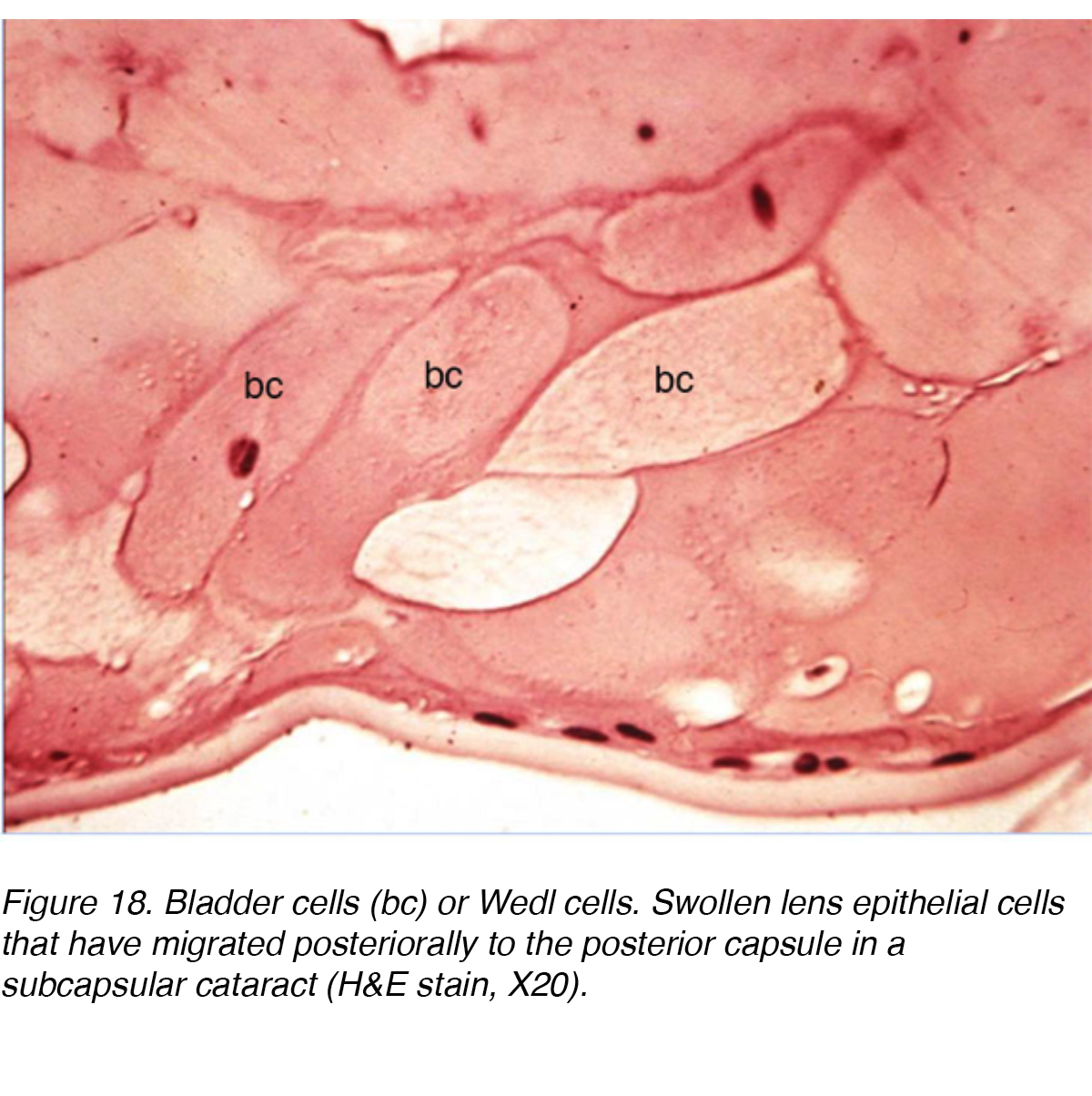
Abbildung 18. Blasenzellen (bc) oder Wedl-Zellen. Geschwollene Linsenepithelzellen, die in einem subkapsulären Katarakt posterior zur hinteren Kapsel migriert sind (HE20, X20).
5) Der VORDERE SUBKAPSULÄRE KATARAKT
Der vordere subkapsuläre Katarakt (ASC) entwickelt sich aufgrund der Degeneration der Epithelzellen der vorderen Linse., Sie können sekundär zu Trauma, medizinische Behandlung iatrogene Ursachen oder spontan entwickeln. Der Bereich der Schädigung verursacht eine Migration von Linsenepithelzellen in den Bereich und anschließende Umwandlung der Zellen in Myofibroblasten in einem Prozess, der als fibröse Metaplasie bekannt ist. Dies führt zu einer Opazität auf der vorderen Oberfläche der Linse unter der vorderen Kapsel.
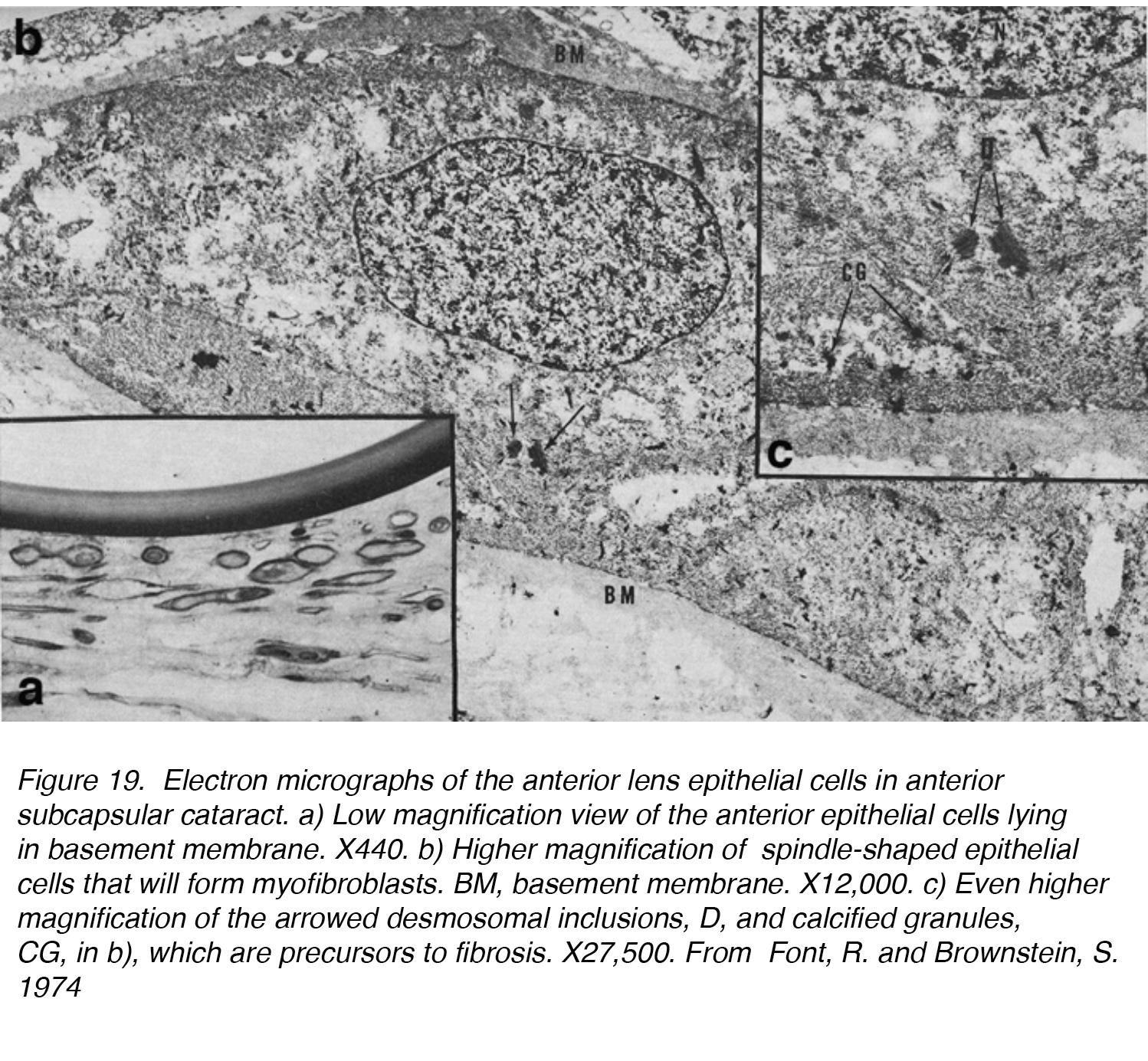
Abbildung 19. Elektronenmikrographen der Epithelzellen der vorderen Linse im vorderen subkapsulären Katarakt. a) Ansicht mit geringer Vergrößerung der in der Basalmembran liegenden vorderen Epithelzellen., X440. b) Höhere Vergrößerung von spindelförmigen Epithelzellen, die Myofibroblasten bilden. BM, Basalmembran. X12,000. c) Noch höhere Vergrößerung der pfeilförmigen desmosomalen Einschlüsse, D, und verkalkten Granulaten, CG, in b), die Vorläufer der Fibrose sind. X27,500. Aus Font, R. und Brownstein, S. 1974.
In einer der ersten Studien an ASC wurden 5 Linsen mit ASC durch Licht – und Elektronenmikroskopie untersucht und die Fähigkeit des Linsenepithels bestätigt, sich in eine fibröse Plaque zu verwandeln., Die Linsenepithelzellen verloren ihre normale Quaderform und verlängerten sich zu einer spindelförmigeren Zelle (Abb. 19a, b, c). Diese Zellen fanden sich Häufig in Kontakt mit einer anderen, die sich in der fibrösen plaque bekannt als ASC. Dieser Prozess kann in zwei Phasen unterteilt werden: eine proliferative und eine degenerative Phase. Die proliferative Phase war am offensichtlichsten in der Nähe der Peripherie der Plaque und zeigte zahlreiche spindelförmige Zellen und mitotisch aktive Zellen. Es folgt eine degenerative Phase, die zu einer fast strukturlosen hyalinen Masse mit weniger spindelförmigen Zellen führt.,
Obwohl die Ursache von ASC vielfältig ist, wurde ein Zusammenhang zwischen ASC und der Bildung von Synechien nach Trauma oder Entzündung vermutet. Die Synechien würden sich zwischen der hinteren Iris und der vorderen Linsenkapsel bilden, was zu einer Stagnation des wässrigen Humors und einer Ansammlung toxischer Metaboliten führt, die eine toxische Wirkung auf das vordere Linsenepithel haben könnten.
6) TRAUMATISCHER KATARAKT
Eine direkte Verletzung des Kopfes oder Auges kann zu erheblichen mechanischen Störungen führen und zur Kataraktbildung führen., Ein Vossiusring kann auftreten, wenn die Beleidigung dazu führte, dass das hintere Irispigmentepithel auf die Linsenkapsel eindrang. Die Pigmentablagerung kann nachlassen und sich mit der Zeit vollständig auflösen. Eine schwere stumpfe Verletzung kann zu sternförmigen linsenförmigen Trübungen im Kortex und in der Kapsel führen. Eine solche Beleidigung kann zu einer Dysfunktion des Linsenepithels führen, was zu einer signifikanten ödematösen Reaktion auf die oberflächliche kortikale Linse führt. Vakuolentaschen können dann dauerhaft in der Lamellenzone eingeschlossen werden und in die Linsenfasern integriert werden, während neue Schichten über der Läsion ausgearbeitet werden., Alternativ kann ein stumpfes Trauma auch eine Kataraktbildung innerhalb aller Linsenschichten verursachen, was zu einer diffusen fibrösen Metaplasie führt (Abb. 20). Andere Formen von Traumata, die zu Kataraktbildung führen können, sind Strahlung, Infrarot, extreme Hitze und elektrische Verletzungen.
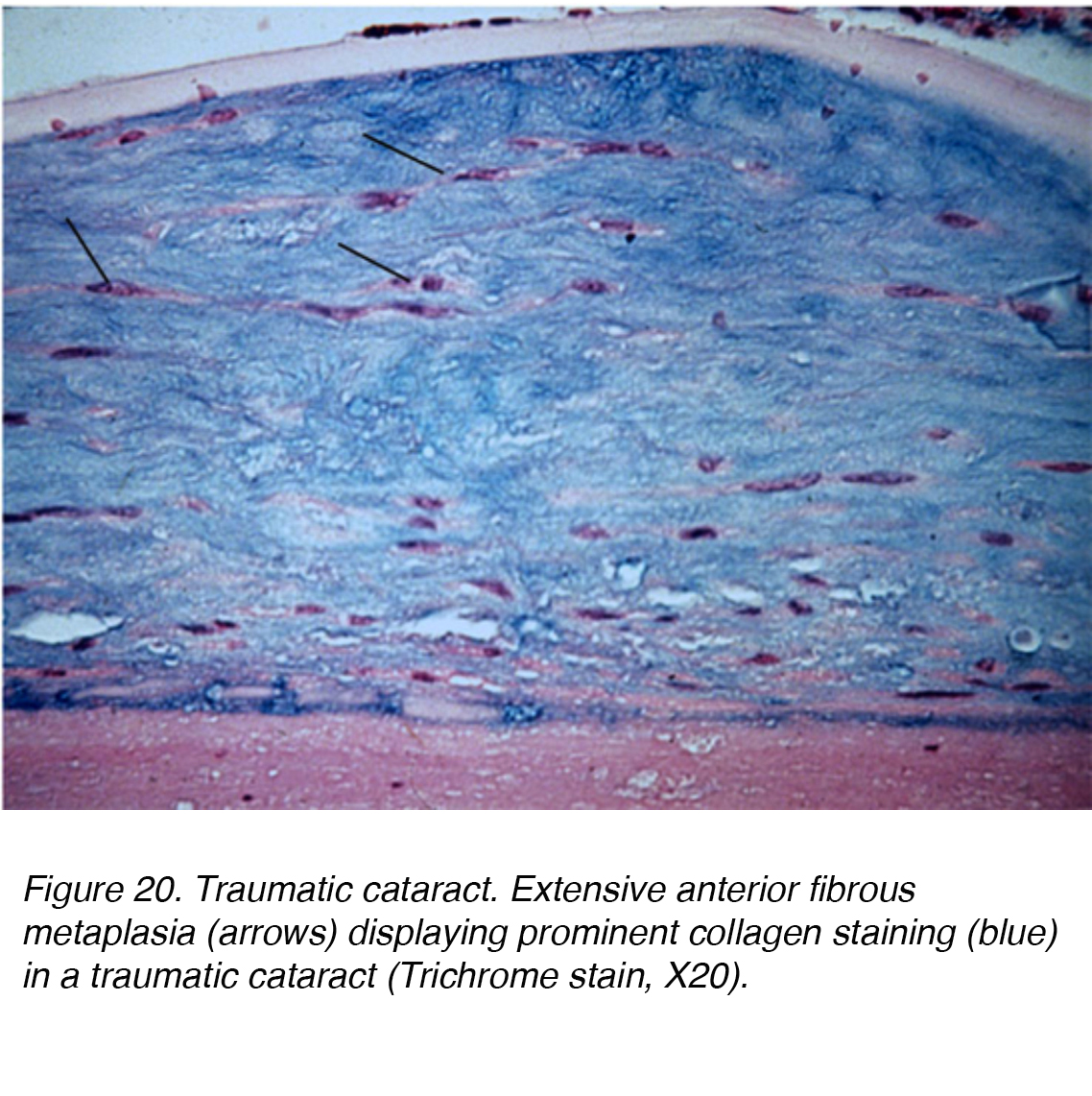
Abbildung 20. Traumatischer Katarakt. Ausgedehnte vordere fibröse Metaplasie (Pfeile) mit ausgeprägter Kollagenfärbung (blau) in einem traumatischen Katarakt (Trichromfleck, X20).,
7) ARZNEIMITTELINDUZIERTER KATARAKT
Es wurde gezeigt, dass mehrere pharmakologische Wirkstoffe eine Kataraktbildung verursachen. Langfristige Kortikosteroidtherapie und anabole Steroide gehören zu den häufigsten Mitteln im Zusammenhang mit Kataraktbildung, insbesondere posteriorem subkapsulärem Katarakt. Die Inzidenz und Schwere von PSC hängt direkt mit der Dosis und Dauer der Anwendung zusammen. Interessanterweise ist die Steroidtherapie zu einer häufigen Behandlungsoption bei der Behandlung von Netzhautpathologien geworden und erhöht wiederum die Rate der Kataraktbildung., Es scheint keinen Unterschied zwischen PSC, das durch Steroidkonsum induziert wird, oder einem reinen altersbedingten PSC zu geben. Phenothiazin ist ein weiteres therapeutisches Mittel, das Linsentrübungen verursachen kann. Psychotrope Mittel, insbesondere Phenothiazin, induzieren die Ablagerung von pigmentiertem Material in das vordere Linsenepithel in einer sehr ausgeprägten axialen Konfiguration . Andere pharmazeutische Mittel, von denen bekannt ist, dass sie linsenförmige Katarakte verursachen, umfassen Miotika und Amiodaron .,
8) ANDERE URSACHEN FÜR KATARAKT
Während altersbedingte Veränderungen der Hauptfaktor für die Kataraktbildung sind, insbesondere seniler Katarakt, umfassen andere Faktoren Rauchen, systemische Erkrankungen, übermäßige Sonneneinstrahlung und die oben genannten pharmakologischen Wirkstoffe . Viele systemische Erkrankungen können Katarakte verursachen, wie Diabetes mellitus, Hypokalzämie, myotonische Dystrophie und Morbus Wilson . Bei Diabetikern treten kortikale und PSCs früher auf, insbesondere bei Patienten mit schlechter Blutzuckerkontrolle., Hypokalzämie-induzierte Katarakte treten normalerweise als kleine weiße Punkttrübungen auf, die zu größeren Flocken verschmelzen können.
Rauchen, Sonneneinstrahlung und systemisches Krankheitsmanagement sind veränderbare Risikofaktoren, so dass Maßnahmen zur Verringerung dieser Faktoren den Beginn und das Fortschreiten der Kataraktbildung verzögern können. Phytonährstoffe wie Xanthophyll-Carotinoide, Lutein und Zeaxanthin können eine potenzielle Rolle bei der Begrenzung oder Neutralisierung lichtinduzierter oxidativer Veränderungen in der Linse spielen . Derzeit gibt es mehrere laufende Studien, in denen andere mögliche Schutzmittel bewertet werden., Obwohl es keine endgültige Maßnahme zur Verhinderung der Kataraktbildung gibt, bleibt die Kataraktoperation eine äußerst sichere und äußerst erfolgreiche Intervention.
KATARAKTCHIRURGIE
Zwei Videos zeigen kataraktchirurgische Eingriffe aus der vorderen und hinteren Ansicht des vorderen Segments des menschlichen Auges.
Aus der vorderen Ansicht (MP4-Datei).
Aus der hinteren Ansicht (MP4-Datei).
Die Chirurgie bei Katarakten hat eine umfangreiche Entwicklung erfahren. Altes Wissen betrachtete das kataratöse Auge als ein Ungleichgewicht des Humors, das Verschiebung brauchte, um das Sehvermögen wiederherzustellen., Mit einer Nadel würde der Chirurg fortfahren, den abnormalen Humor zu verdrängen, bis sich die kristalline Linse disloziert. Die moderne Kataraktchirurgie hat erhebliche Veränderungen erfahren und ist jetzt durch mehrere Schritte gekennzeichnet: Hornhautinzision, kontinuierliche krummlinige Kapsulorrhexis (CCC), Hydrodissektion, Phakoemulsifikation, kortikale Aspiration und Intraokularlinsenimplantation (IOL).
Ein früherer chirurgischer Eingriff zur Entfernung der gesamten Kataraktlinse erforderte einen 12-mm-Einschnitt mit anschließendem Nahtverschluss. Allerdings eine kleine 2.4 zu 2.,8 mm breiter klarer Hornhautschnitt reicht aus, um den Eintritt des Phaco-Handstücks zu erleichtern, während es zum Schließen nahtlos bleibt. Die CCC-Technik wurde in den 1980er Jahren von Gimbel und Neuhann entwickelt und revolutionierte die Phakoemulsifikationstechnik. Bei CCC wird ein Riss in der vorderen Kapsel erzeugt und der Riss dann kreisförmig kontinuierlich fortgesetzt, während die auf die Zonularfasern ausgeübten Scherkräfte minimiert werden. Nach der Erstellung des CCC wird die Phakoemulsifikation verwendet, um sowohl das kortikale als auch das Kernmaterial zu fragmentieren und zu emulgieren., Ursprünglich 1967 von Kelman Pionierarbeit geleistet, bleibt die Phakoemulsifikation ein wesentlicher Bestandteil der Kataraktchirurgie . Die CCC-Öffnung ist groß genug, um die Implantation der gesamten Optik und Haptik einer Intraokularlinse (IOL) in den Restlinsenkapselbeutel zu ermöglichen. Die vorherige Verwendung von nicht faltbaren Polymethylmethacrylatlinsen erforderte einen relativ großen klaren Hornhautinzision für die Implantation. Die Entwicklung der faltbaren Silikon-und Acryl-IOLe ermöglichte jedoch das Einführen durch einen kleinen Einschnitt von meist weniger als 4,0 mm Länge., Innovation verbessert ständig diese Schritte der Kataraktchirurgie, von neuartigen IOLs mit einzigartigem Design, um die Hornhautinzision zu minimieren, bis hin zur Verwendung des Femtosekundenlasers, um einen automatisierten Hornhautinzision, CCC, zu erstellen und den Kern vor der Aspiration zu fragmentieren.
Details zu den Arten von Intraokularlinsen, die derzeit in der Kataraktchirurgie eingesetzt werden, finden Sie im folgenden Kapitel in webvision von Jason Nguyen und Liliana Werner.
Sheeladevi et al. 2016. Globale Prävalenz von Katarakt im Kindesalter: eine systematische Überprüfung. Auge. 30, 9 (2016), 1160–1169.
Birke, E., et al. 2009. Die kritische Periode für die chirurgische Behandlung von dichten kongenitalen bilateralen Katarakten. Zeitschrift der American Association für pädiatrische Augenheilkunde und Strabismus. 13, 1 (2009), 67–71.
Holmes, J. M. und Clarke, M. P. 2006. Amblyopie. Lancet (London, England). 367, 9519 (Apr. 2006), 1343–1351.
Streeten, B. W. 1978. Menschlicher Posteriorer subkapsulärer Katarakt. Archiv der Augenheilkunde. 96, 9 (Jan. 1978), 1653.
Urban, R. C. und Cotlier, E. 1986. Kortikosteroid-induzierte Katarakte. Umfrage der Augenheilkunde. 31, 2 (1986), 102–110.
Kelman, C. D. 1979., Phakoemulsifikation in der Vorderkammer. Augenheilkunde. 86, 11 (1979), 1980–1982.
die Autoren

Joah, F. Aliancy, MD, ursprünglich aus Haiti, erhielt seinen Bachelor-Abschluss von der University of South Florida in Chemie mit Auszeichnung Auszeichnung und seinen medizinischen Abschluss von der Florida State University. Derzeit ist er ein Ocular Pathology Research Fellow am John A. Moran Eye Center. In einem Jahr wird Dr. Aliancy das Harkness Eye Institute an der Columbia University für seine Augenheilkunde-Residency-Ausbildung besuchen., Seine Forschungsinteressen umfassen neuartige Intraokularlinsentechnologie, Mechanismen zur Verringerung der Trübung der Kapsellinse, toxisches Vordersegmentsyndrom und Stickoxid als Behandlungsmethode bei glaukomatösen Erkrankungen. Er wurde sowohl mit Alpha Omega Alpha als auch mit Gold Humanism Honor Societies ausgezeichnet und erhielt den Rabb-Venable Award der National Medical Association. Dr. Aliancy kann kontaktiert werden unter [email protected]

Nick Mamalis ist Professor für Augenheilkunde an der John A., Moran Eye Center der Universität von Utah in Salt Lake City, Utah. Er erhielt seinen BA in Biochemie von der Harvard University und seinen MD von der University of Utah, School of Medicine. Nach einem Fellowship in Ophthalmic Pathology an der University of Utah schloss er seine Residency in Ophthalmology am Loyola University Medical Center ab. Derzeit ist er Direktor für Augenpathologie sowie Co-Direktor des Intermountain Ocular Research Center an der University of Utah., Er ist Herausgeber des Journal of Cataract und Refraktive Chirurgie sowie Mitglied des Cataract Clinical Committee und des Executive Committee der American Society of Cataract and Refractive Surgery (ASCRS). Dr. Mamalis ist ein ehemaliger Präsident der Utah Ophthalmologie-Gesellschaft. Er erhielt 1994 den Ehrenpreis der American Academy of Ophthalmology, 2005 den Senior Achievement Award und 2015 den Life Achievement Award. Er wurde 2013 vom ASCRS mit der Brinkhorst-Ehrenmedaille ausgezeichnet., Er ist national und international bekannt und hat über 200 Peer Review-Artikel veröffentlicht und mehrere Lehrbücher und Lehrbuchkapitel geschrieben. Dr. Mamalis kann kontaktiert werden unter [email protected]