the study of cinetics enables scientists to determine the relationship between the changes in conditions and the speed of a particular chemical reaction. Um dos fatores mais importantes que afetam a velocidade de uma reação é a reatividade dos produtos químicos envolvidos nessa reação específica; além disso, existem várias variáveis que também podem impactar a taxa de uma reação (concentração, temperatura, catalisador, etc.).
uma dessas variáveis é considerada uma colisão., cada reação química requer colisões entre as partículas reagentes (átomos e/ou moléculas). Por outro lado, nem todas as colisões promovem a reacção a ter lugar. Em vez disso, se as partículas que colidem não tiverem energia cinética suficiente ou orientação adequada no espaço, a reação não ocorrerá. mas o que significa “energia suficiente” ou “orientação adequada”? Para obter uma melhor idéia dos conceitos mencionados anteriormente, o artigo fornecerá algumas definições gerais acompanhadas por exemplos correspondentes e problemas de amostra.,
nosso principal objetivo é definir o conceito de energia de ativação e explicar por que algumas das colisões não resultam em uma reação. deste modo, este artigo centrar-se-á principalmente no conceito de colisão reactiva. Juntamente com isso, vamos brevemente analisar alguns cenários envolvendo colisões não reativas. Uma vez que as colisões estão associadas com duas características principais, energia e orientação espacial, vamos discutir estes termos também.,
teoria de colisão
como já mencionamos acima, colisões entre duas ou mais moléculas devem ocorrer para que uma reação química ocorra. Mas a colisão não é suficiente para transformar os reagentes em produtos. As moléculas devem ter energia suficiente, e elas devem colidir com a orientação espacial correta. como você já deve saber, Existem diferentes tipos de reações, incluindo síntese, decomposição, deslocamento e combustão., Considerando o fato de que a colisão teoria concentra-se em reações que envolvem colisões entre duas espécies, você não tem que se preocupar muito com a decomposição reações, pois, em tais casos, um único composto é desfez, e não há necessidade de se considerar colisões ou orientação de partículas no espaço.
no caso de reações envolvendo duas espécies, colisões entre as moléculas são cruciais para a reação prosseguir; mas, apenas colisões de moléculas com energia cinética suficiente e orientação espacial relevante podem causar uma reação., Assim, a energia é necessária para quebrar as ligações dentro das moléculas reagentes, enquanto a orientação das moléculas no espaço desempenha um papel importante na formação de átomos próprios uns com os outros para reformar as ligações quebradas da maneira correta.
Quando ambos os critérios são satisfeitos, a colisão é considerada como uma colisão bem sucedida, eficaz ou reativa. considerando a importância dos dois fatores mencionados acima (energia e orientação), devemos continuar a explicação adicional dos Termos e conceitos para entender melhor os princípios da teoria da colisão.,
energia de ativação
como já mencionamos anteriormente, as partículas devem colidir com energia suficiente para uma reação ocorrer. Esta energia mínima necessária para a reacção prosseguir é definida como a energia de activação.,
Como você sabe, existem dois tipos de reações relativas a liberação de energia ou de absorção, que são as seguintes:
- Endothermic reação – a energia é absorvida em uma reação (geralmente em formas de calor)
- reação Exotérmica – a energia é liberada em uma reação (geralmente em formas de calor)
À primeira vista, pode parecer que, desde que a energia é liberada em uma reação exotérmica, não deve haver qualquer necessidade de entrada de energia para a reação ocorrer. Pelo contrário, tanto as reações químicas endotérmicas quanto exotérmicas requerem energia para começar.,parece um pouco estranho, certo? Porque é que uma reacção precisa de energia se a energia é consequentemente libertada? consideremos os seguintes exemplos de reacções exotérmicas que ocorrem na nossa vida quotidiana.

Exemplo #1 – Queima de uma Vela
A queima de uma vela libera energia na forma de calor; portanto, a reação que ocorrem durante o processo é exotérmico. Obviamente, você precisa acender a vela usando um fósforo ou isqueiro., O que isso significa é que você tem que introduzir alguma energia para que a vela acenda. Depois disso, a reação tem energia suficiente para avançar para os próximos passos, e a vela continua a queimar energia. no entanto, uma vela nunca arderá sozinha, certo?
Exemplo #2 – acende um fósforo

Uma partida típica de cabeça é composta de enxofre misturado com diferentes agentes oxidantes. Para acender o fósforo, deve esfregar a cabeça do fósforo no lado especial de uma caixa de fósforos., Durante este processo, uma reação ocorre e libera energia em formas de luz e calor. Assim, a reação é considerada exotérmica. Embora, você ainda precisa de introduzir alguma energia para o fósforo para começar a queimar. Esta energia é definida através do termo “energia de ativação”.”Da mesma forma que o exemplo anterior, desde que você forneça energia suficiente para que o fósforo acenda, ele continuará a queimar e liberar calor por conta própria.
o grafo de energia de ativação retrata as mudanças de energia que ocorrem durante uma reação química.,
Para plotar o gráfico da energia de ativação, é crucial considerar duas variáveis:
- o Número de colisões entre moléculas diferentes
- energia Cinética da colisão de moléculas
A primeira variável é bastante fácil de entender, pois tem significado direto – define o número de colisões entre as partículas de duas espécies por segundo.
A segunda variável é a energia cinética das moléculas colidindo, que pode ser definida como a energia do movimento das moléculas.a energia da reacção endotérmica é absorvida., A energia dos reagentes é menor que a energia dos produtos.
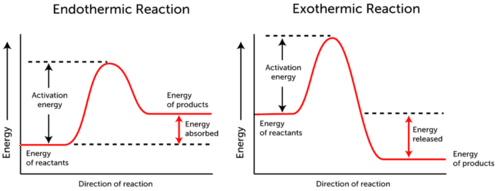
- Reação Exotérmica de energia é liberada. A energia dos reagentes é mais do que a energia dos produtos.
Como pode ver nos dois gráficos acima, a energia de ativação para ambas as reações endotérmicas e exotérmicas é a mesma.,
Desde endothermic reação não pode produzir a energia que ele precisa consumir para que a reação ocorra, a energia é absorvida; portanto, a energia dos produtos é maior que a energia dos reagentes.pelo contrário, as reacções exotérmicas produzem mais energia do que a que utilizam como energia de activação. Como resultado, a energia é liberada, e os produtos têm menor energia do que os reagentes.,
Como conclusão, pode-se afirmar que mesmo que moléculas reagentes colidam rapidamente entre si, é essencial que as moléculas tenham energia suficiente para que a reação ocorra.
orientação espacial
de acordo com a teoria da colisão, nem todas as colisões são bem sucedidas, mesmo que as moléculas reagentes tenham energia de ativação suficiente. As moléculas também devem colidir no caminho certo.
assim, o segundo aspecto que influencia colisões reativas é considerado como orientação espacial (orientação das moléculas no espaço).,
O que significa a orientação “adequada” das moléculas em uma reação?
Quando duas moléculas colidem, ambas as moléculas devem estar situadas da maneira que é fácil para elas reagirem. Para compreender plenamente o conceito, é importante destacar o mecanismo da reação.
Vamos considerar a reação entre propileno (ou propeno) e brometo de hidrogénio como um exemplo:

Como você pode ver acima, a reação prossegue em 2 etapas.,
Passo 1: a ligação dupla é quebrada
Passo 2: o bromo está ligado
nesta reacção, as orientações moleculares de HBr e C3H6 desempenham um papel importante, uma vez que um deles estava situado de outra forma, não teria sido possível para o átomo H aproximar-se da molécula de propileno.
isto é verdadeiro para cada reacção. Cada molécula deve ter a orientação adequada no espaço para que a reação ocorra. A orientação correta garante que as moléculas estão situadas da forma que é relativamente fácil para elas colidirem e reagirem.,
Podemos concluir que a orientação favorável das moléculas reagentes é tão essencial quanto suficiente energia de ativação.
Resumo
Termos e conceitos definidos ao longo do artigo são resumidos na tabela abaixo:
| Colisão Teoria | Explica como as partículas devem interagir ou uns com os outros para provocar uma reação., De acordo com a teoria da colisão, dois critérios devem ser cumpridos para que uma reação química ocorra: moléculas devem colidir com energia de ativação suficiente para quebrar e re-formar ligações existentes; moléculas devem colidir com orientação espacial favorável. |
| colisão bem sucedida (também referida como colisão efetiva ou reativa) | uma colisão de moléculas com energia de ativação suficiente e orientação adequada no espaço que resulta em uma reação química.,a energia mínima necessária para a reacção ocorrer. A entrada de energia é necessária no caso de reações endotérmicas e exotérmicas. a energia (calor) é absorvida; a energia dos reagentes é inferior à energia dos produtos; não pode produzir tanta energia como consome durante a reacção.,é libertada energia (calor); a energia dos reagentes é superior à energia dos produtos; pode produzir mais energia do que consome durante a reacção. |
| orientação Molecular | orientação espacial das moléculas., |
Three different scenarios are represented in the picture attached below:
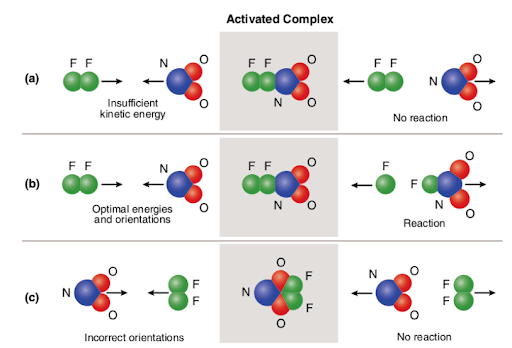
The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride.,
no caso de (a), as moléculas reagentes têm orientação espacial adequada, mas não têm energia de ativação suficiente; portanto, a reação não ocorre devido ao fato de que não há energia suficiente para quebrar ligações. Assim, a colisão entre as duas moléculas é considerada não reativa.
no caso de (b), as moléculas reagentes têm energia de ativação suficiente e orientação adequada no espaço. Devido às características ótimas das moléculas, a reação prossegue e o oxifluoreto de nitrogênio é formado., Assim, a colisão entre as duas moléculas é considerada reativa.
no caso de (C), As moléculas reagentes têm energia de ativação suficiente, mas não estão corretamente situadas no espaço; portanto, a reação não ocorre uma vez que não é possível para as moléculas alcançarem-se na forma que quebra as ligações. Assim, similarmente ao primeiro caso, a colisão entre as duas moléculas é considerada não reativa.