Introduction
However, several animal studies have shown that CBD produces inverted U-shaped dose-response curves. Estas curvas foram descritas pela primeira vez em ratos testados no modelo de ansiedade “elevated plus maze” (EPM) (Guimarães et al., 1990). Nesse estudo, a CBD aumentou a exploração do braço aberto (um efeito ansiolítico) em doses de 2, 5–10 mg/kg, mas não a 20 mg/Kg (Guimarães et al., 1990)., Curvas de dose-resposta semelhantes em forma de sino foram descritas em outros estudos que investigam os efeitos comportamentais da CBD. Por exemplo, o peixe-zebra tratado com 0,5 mg/kg de CBD passou significativamente mais tempo na zona superior do aquário (que é interpretado como um efeito ansiolítico), enquanto o comportamento dos peixes tratados com as doses mais baixas (0,1 mg/kg) e mais altas (5 e 10 mg/kg) não diferia dos controles (Nazario et al., 2015). Um padrão semelhante também foi observado em ratos espontaneamente hipertensos (SHRs), que apresentam um fenótipo comportamental semelhante à esquizofrenia., A inibição da preparação nesta estirpe de ratos foi invertida por 30 mg/kg de CBD, mas não pelas doses de 15 e 60 mg / kg (Levin et al., 2014). O mesmo foi observado utilizando o modelo de disfunção cognitiva induzida pela reserpina em ratos, um modelo animal tanto da doença de Parkinson como da discinésia tardia. Enquanto a CBD, na dose de 0, 5 mg/kg, atenuou o défice de memória induzida pela reserpina na tarefa discriminativa, a dose de 5 mg/kg revelou-se ineficaz (Peres et al., 2016).,existe uma clara necessidade de explorar novas formas de gerir os distúrbios da ansiedade, uma vez que o seu tratamento continua problemático e geralmente envolve uma combinação de medicamentos, incluindo benzodiazepinas e antidepressivos. Estes medicamentos têm as suas desvantagens, tais como risco de dependência e síndrome de abstinência, efeitos secundários sexuais, deficiência cognitiva e psicomotora, início tardio de Acção (antidepressivos), baixa aceitação e exigência de controlo cuidadoso da dose (Katzman et al., 2014; Bandelow et al., 2015; Sgnaolin et al., 2016)., A CBD não parece induzir efeitos adversos significativos nos seres humanos (Bergamaschi et al., 2011b). No entanto, de uma possível perspectiva terapêutica, é essencial determinar se um padrão de resposta dose-resposta semelhante invertida em U também está presente no ser humano. Para investigar esta possibilidade, escolhemos um dos efeitos mais consistentes da CBD, a diminuição aguda da ansiedade. Este efeito tem sido descrito em vários modelos animais e em voluntários saudáveis e pacientes com transtorno de ansiedade social (Sad) (Guimarães et al., 1990; Zuardi et al., 1993; Bergamaschi et al., 2011a; Crippa et al., No entanto, não foi investigada a utilização de doses múltiplas em seres humanos.
um método amplamente utilizado para induzir ansiedade experimental em seres humanos é a tarefa de fala pública simulada (SPST-Graeff et al., 2003). O SPST é muito consistente em elevar a ansiedade auto-avaliada. No entanto, os seus efeitos sobre as respostas fisiológicas (frequência cardíaca, pressão arterial e secreção de cortisol) são menos consistentes (Palma et al., 1994; Hetem et al., 1996; de-Paris et al., 2003)., Uma meta-análise de 11 estudos que utilizaram o SPST confirmou esta observação, mostrando um aumento significativo do efeito global sobre a ansiedade subjectiva, mas não sobre a pressão arterial sistólica (PAS) e a frequência cardíaca (Zuardi et al., 2013). Evidências escassas na literatura sugerem que falar em público em uma situação real é mais eficiente para aumentar as respostas fisiológicas (Turner et al., 1990; Dickerson and Kemeny, 2004). Em um estudo recente, comparamos o teste de falar em público em uma situação real (TPSRS) e o SPST., Os resultados mostraram que ambos os métodos foram eficazes no aumento da ansiedade subjetiva, mas apenas as TPSRS aumentaram a frequência cardíaca, SBP e pressão arterial diastólica (DBP) (Zuardi et al., 2013).
O presente estudo, portanto, foi concebido para testar a hipótese de que o aumento das doses de CBD produziria efeitos ansiolíticos num padrão invertido de resposta à dose em U em voluntários saudáveis submetidos às TPSRS.,
materiais e métodos
indivíduos
sessenta homens e mulheres saudáveis com idades entre 18 e 35 anos, sem história de doença psiquiátrica passada ou atual, álcool ou outra dependência de drogas foram recrutados através de propaganda no campus da Universidade de São Paulo em Ribeirão Preto. Os participantes com grandes condições médicas ou que estavam tomando medicamentos com o potencial de interferir com os resultados do estudo não foram incluídos., Os voluntários foram entrevistados a fim de avaliar a elegibilidade e medir a sua propensão para a ansiedade através da versão característica do inventário de ansiedade Estado-traço de Spielberger (STAI – Spielberger et al., 1970). Participantes elegíveis que concordaram em participar foram instruídos a abster-se de drogas na semana anterior aos testes e de álcool e cafeína nas 24 horas antes do teste., Todos os voluntários deram consentimento informado e por escrito para participar depois de estarem plenamente informados sobre os procedimentos de pesquisa, que se conformaram com os termos atuais da Declaração de Helsinque e foram aprovados pelo Comitê de Ética do Hospital Universitário da Escola de Medicina Ribeirão Preto (HCRP-No. 12407/09).
os voluntários foram distribuídos aleatoriamente a cinco grupos com 12 indivíduos cada um a receber doses diferentes de CBD (100, 300 e 900 mg), clonazepam (1 mg) ou placebo, em dupla ocultação, aleatorizados., Os grupos foram combinados de acordo com o sexo, idade, Índice de Massa Corporal (IMC), e pontuação STAI-trait. Um voluntário do grupo CBD-300 não pôde comparecer à sessão experimental devido a problemas pessoais e foi retirado do estudo.
Drogas
Canabidiol em pó com 99,6% de pureza (sem outros canabinóides presentes) dissolvido em óleo de milho em doses de 100 e 200 mg/ml foi gentilmente fornecida pela Biossíntese Pharma Group (BSPG-Pharm, Sanduíche, reino UNIDO). A solução CBD, os comprimidos clonazepam (Rivotril®, Roche Lab) e placebo (corn oil) foram embalados em cápsulas de gelatina idênticas., Todos os voluntários receberam cinco cápsulas de um mililitro de cada um, nas seguintes combinações: cinco cápsulas contendo óleo de milho (grupo placebo); uma cápsula de CDB 100 mg/ml e quatro cápsulas de óleo de milho (CBD-grupo de 100); três cápsulas de CDB 100 mg/ml e duas cápsulas de óleo de milho (CBD-grupo de 300); quatro cápsulas de CDB 200 mg/ml e uma cápsula de CDB 100 mg/ml (CBD-900 grupo); e uma cápsula com clonazepam e quatro cápsulas de óleo de milho (clonazepam grupo – CLON)., Cada tratamento recebeu um número aleatório e tanto o investigador responsável pela distribuição das cápsulas como o voluntário desconheciam o seu conteúdo (duplamente cego). Por último, a escolha do intervalo entre a administração do fármaco e as TPSRS baseou-se em estudos farmacológicos anteriores que demonstraram que as concentrações plasmáticas máximas da CBD e do CLON tomadas oralmente ocorrem geralmente entre 2 e 3 horas após a ingestão (Agurell et ai., 1981; Crevoisier et al., 2003; Borgwardt et al., 2008; Fusar-Poli et al., 2009; Martin-Santos et al., 2012)., A CBD sofre um efeito de primeira passagem significativo que levou à formação de vários metabolitos e verificou-se que a sua semi-vida no ser humano se situava entre 2 e 5 dias após a administração oral. A biodisponibilidade oral da CBD em seres humanos é de cerca de 6%, apoiando assim a opinião de que tem um efeito de primeira passagem substancial (Zhornitsky e Potvin, 2012). O nível plasmático médio da CBD em 1, 2 e 3 h após a administração aguda de 600 mg foi de 0, 36, 1, 62 e 3, 4 ng/ml, respectivamente (Martin-Santos et al., 2012)., A escolha das doses utilizadas neste estudo baseou-se em provas anteriores que demonstraram que a administração oral aguda de 300 mg de CBD tinha efeitos ansiolíticos no SPST (Zuardi et al., 1993).medições psicológicas dois factores da escala visual analógica do humor (VAMS), traduzidos e validados em português por Zuardi e Karniol (1981), foram utilizados para avaliar os níveis de ansiedade e os efeitos sedativos durante o teste. O VAMS é um instrumento auto-administrado que consiste em 16 itens. Antes do TPSRS, cada voluntário passou por uma sessão de treinamento para completar a escala., Os sujeitos foram convidados a marcar o ponto que identificou seu estado subjetivo atual em uma linha reta de 100 mm entre duas palavras que descrevem estados de humor opostos (por exemplo, tempo relaxado). Uma análise factorial da versão portuguesa da escala identificou quatro factores (Zuardi et al.,, 1993): (1) ‘ansiedade’, compreendendo os itens calma–animado, relaxado–tenso, e tranquilo conturbado; (2) o “sedação”, incluindo os itens alerta–se sonolento e atencioso–sonhador; (3) ‘cognitivo’, incluindo perspicaz–mentalmente lento, proficiente–incompetente, enérgico–se letárgico, lúcido–muzzy, gregário–retirada, bem coordenado, desajeitado e forte–fraco; e (4) o desconforto”incluindo os itens interessado–entediado, feliz–triste, contente–se descontente e amigável–antagonista (Parente et al., 2005). Desde estudos anteriores com ambos ansiogênicos (Crippa et al., 2004; Parente et al.,, 2005) e drogas ansiolíticas, incluindo CBD (Crippa et al., 2004, 2011; Bergamaschi et al., 2011a) mostraram que apenas os fatores de ansiedade e sedação apresentam mudanças durante as tarefas de fala pública, usamos apenas os itens destes fatores do VAMS para reduzir o tempo de administração e permitir a execução do protocolo. Este procedimento foi utilizado anteriormente no estudo de validação do PSRST (Zuardi et al., 2013).as medidas fisiológicas foram medidas com um esfigmomanômetro digital (Omron, Brasil).,
Test of Public Speaking in a Real Situation (TPSRS)
neste procedimento, cada assunto deve falar em frente a um grupo e, na mesma sessão experimental, participar do público quando os outros membros do grupo estão falando. O público é instruído a permanecer em silêncio e com uma expressão neutra durante os discursos.foram realizadas cinco sessões experimentais com 12 indivíduos cada (excepto 1, que incluiu 11 indivíduos). No início da sessão, os voluntários foram informados do número de tratamentos que receberiam (conforme descrito acima)., Os voluntários foram então instruídos a ocupar lugares marcados com os respectivos números de tratamento. Os lugares foram numerados de tal forma que, no final das cinco sessões, os sujeitos de cada grupo de tratamento tinham ocupado todas as posições possíveis. A sequência de procedimentos sempre seguiu a mesma ordem desde a primeira até a décima segunda cadeira, em um esforço para minimizar um possível efeito de ordem na sequência de oradores., Por exemplo, os assuntos do grupo CBD-300 ocuparam as seguintes posições: primeira sessão – 3, 8; segunda sessão – 4, 9; Terceira Sessão – 5, 10; quarta sessão – 1, 6, 11; quinta sessão – 2, 7, 12.
procedimento
voluntários iniciaram a sessão experimental após um mínimo de 6 h de sono e 2 h após tomar um pequeno-almoço padrão (200 ml de leite com chocolate e 100 g de pão com margarina).,os 12 voluntários sentaram-se em cadeiras dispostas num semicírculo, seguindo uma ordem pré-determinada pelo número de tratamento atribuído a cada um deles e realizaram as medições de base, seguidas da ingestão das cinco cápsulas num intervalo de 5 minutos por cada voluntário. Esta fase foi concluída ao longo de um período de 1 h. os voluntários, em seguida, assistiram a um filme sobre aves da Floresta Amazônica com duração de cerca de 20 minutos. Depois disso, as medições foram repetidas com um intervalo de 5 minutos para cada assunto (medida pré-teste)., 2 h e 20 minutos após o primeiro voluntário ter recebido o tratamento, todos eles assistiram a um vídeo com cerca de 10 minutos com instruções gravadas para o teste de fala. 2 h e 30 minutos após o primeiro voluntário receber o tratamento, eles começaram a realizar o teste de fala, que durou 5 minutos. Posteriormente, os outros voluntários foram submetidos ao teste de fala na mesma ordem em que receberam os tratamentos., O teste de fala consistiu em preparar silenciosamente um discurso de 1 minuto sobre um tema relacionado com “as condições de um serviço público da sua cidade”, escolhido por acaso a partir de 12 opções e revelado imediatamente antes da preparação da fala. O discurso preparado foi então apresentado por 2 minutos, com os outros participantes e os investigadores servindo como o público. O discurso foi interrompido a meio da medição., A seqüência dos procedimentos desta fase foi como segue: (a) estar em uma cadeira dispostas na frente de outros; (b) escolher o discurso do tema; (c) a pensar sobre o tema durante 1 min; (d) iniciar o discurso, que foi interrompido após 1 min; (e) completar a auto-escala de avaliação (VAMS ansiedade e sedação, fatores fisiológicos e medições; (f) continuando o discurso por mais um minuto. Esta sequência durou no máximo 5 minutos, de modo que, após 1 h, todos os voluntários passaram pelo procedimento. A fase final do estudo começou 216 minutos após o primeiro voluntário ter tomado a droga., Todas as medições foram repetidas, mantendo o intervalo de 5 minutos para cada voluntário. O quadro 1 apresenta um esboço do procedimento experimental.

a TABELA 1. Calendário da sessão experimental.
a análise estatística
as características clínicas e demográficas foram analisadas com testes não paramétricos (sexo) e análise de um fator de variância (ANOVA; idade, IMC, e STAI-trait).,
as pontuações nos dois factores da VAMS, pressão sistólica e diastólica arterial e frequência cardíaca foram analisadas com uma análise de medidas repetidas da variância (ANOVA de medidas repetidas), incluindo a fase dos factores, grupos e interacção Fase-grupo. Nos casos em que as condições esféricas não foram atingidas, os graus de liberdade do fator repetido foram corrigidos com o epsilon Huynh-Feldt. Comparações entre os grupos foram feitas em cada fase usando uma ANOVA de um fator seguido por várias comparações com o teste Student-Newman-Keuls.,
a análise de dados foi realizada usando o pacote estatístico para as Ciências Sociais (SPSS) versão 17, e o nível de significância adotado foi p < 0,05.resultados
as características demográficas e clínicas dos indivíduos são apresentadas na Tabela 2. Os grupos não diferiram significativamente no que diz respeito ao gênero, idade, IMC e pontuação STAI-trait.

TABELA 2. Características demográficas e clínicas dos grupos.,
O de medidas repetidas ANOVA dos escores na ansiedade o fator de VAMS mostrou um efeito significativo de fase (F3,162 = 60.24; p < 0.001), de grupo (F4,54 = 3.25; p = 0,018), e fase-grupo a interação (F12,162 = 3.79; p < 0.001, Figura 1A). Comparações Post hoc entre os grupos em cada fase mostraram diferenças significativas (p < 0, 05) entre PLAC e CLON nas fases de fala e pós-estresse., As pontuações do grupo CBD-300 foram significativamente diferentes das do grupo CBD-900 na fase de fala e das dos grupos PLAC e CBD-100 durante a fase de pós-estresse (p < 0,05). A título ilustrativo, a figura 1B mostra a curva invertida de resposta à dose em U induzida pela CBD na fase pós-stress. Em relação ao fator de sedação do VAMS,a ANOVA de medidas repetidas mostrou efeitos significativos da fase (F2.16.116.7 = 3.11; p = 0.028) e do grupo (F4, 54 = 3.48; p = 0.013, figura 2A)., Uma comparação geral post hoc entre os grupos mostrou que o clonazepam induziu um efeito sedativo mais elevado em comparação com os outros grupos (principal efeito do tratamento). Um efeito semelhante foi observado na fase pós-stress (p < 0, 05).
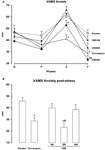
a FIGURA 1. Alterações nas pontuações do factor de ansiedade da escala visual analógica de humor (VAMS) (mm) induzida pela fala pública em voluntários saudáveis (a) durante a linha de base (B) e durante as fases pré-stress (P), fala (s) e pós-stress (F) (a)., Por uma questão de clareza, os resultados da última fase (F) também são mostrados como um gráfico de barras (B). Os pontos representam as médias ± SEM de 11-12 indivíduos. Asteriscos ( ∗ ) indicam diferenças estatisticamente significativas em comparação com o grupo placebo, ( + ) indica uma diferença significativa em comparação com o grupo CBD-900, e (&) indica uma diferença significativa em comparação com o grupo CBD-100.
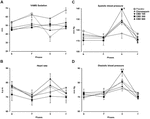
FIGURA 2., Alterações no Factor de sedação dos VAMS (mm, a), frequência cardíaca, sistólica (C) e diastólica (D) pressão arterial (mm Hg) induzidas pela fala pública em voluntários saudáveis. Os pontos representam as médias ± SEM de 11-12 indivíduos. O asterisco (∗) indicam diferenças estatisticamente significativas em comparação com os outros grupos (&) indica uma diferença significativa em comparação ao clonazepam, e ($) indica uma diferença significativa comparado com o CBD-grupo de 100.,
discussão
usámos as TPSRS para induzir experimentalmente a ansiedade e investigámos se o efeito ansiolítico da CBD nos seres humanos produz uma curva invertida de resposta à dose em forma de U. Em linha com provas anteriores (Zuardi et al., 2013), este protocolo aumentou significativamente a ansiedade subjetiva, a pressão arterial e a frequência cardíaca, como demonstrado pelo efeito significativo da fase encontrada em uma aNova medidas repetidas., Além disso, as TPSRS foram sensíveis na detecção do efeito ansiolítico do clonazepam, uma droga ansiolítica bem conhecida, sugerindo que ele pode ser usado para identificar drogas potencialmente ansiolíticas.na dose de 300 mg, a CBD diminuiu significativamente a ansiedade subjectiva em comparação com o grupo placentário durante a fase pós-fala do protocolo. No entanto, o mesmo não se verificou para uma dose menor (100 mg) ou superior (900 mg) do fármaco., Além disso, as pontuações de ansiedade subjetiva do grupo CBD-300 também diferiam significativamente das do grupo CBD-900 durante a fase de fala, e do grupo CBD-100 durante a fase pós-fala. Estes resultados sugerem que o efeito agudo ansiolítico da CBD seguiu uma curva invertida de resposta dose-resposta em forma de U, que é consistente com os resultados de Estudos em animais (Guimarães et al., 1990; Levin et al., 2014; Nazario et al., 2015; Peres et al., 2016). Curiosamente, a mesma dose de CBD que produziu efeitos ansiolíticos (300 mg) não reduziu a sistólica e DBP como clonazepam., Esta dissociação entre efeitos ansiolíticos e simpaticoinibitórios após a administração aguda da CBD é consistente com as nossas observações utilizando o SPST em voluntários saudáveis (Zuardi et al., 1993) e em pacientes com fobia social (Bergamaschi et al., 2011a).o mecanismo subjacente a este padrão de efeito dose-resposta da CBD ainda não pode ser totalmente explicado. Em humanos, áreas límbicas e paralímbicas do cérebro parecem estar envolvidas na ação ansiolítica da CBD., Por exemplo, estudos utilizando o single photon emission computed tomography (SPECT) em voluntários saudáveis e drogas ingênuo pacientes com TRISTE mostrou o envolvimento das mesmas áreas envolvidas no efeito ansiolítico do CBD 400 mg, a saber, a esquerda parahippocampal giro e para a esquerda amígdala-hipocampo complexo (Crippa et al., 2004, 2011). Usando imagiologia por ressonância magnética funcional (fMRI) em voluntários saudáveis, pesquisadores descobriram que a ativação atenuada CBD 600 mg na amígdala e no córtex cingulado anterior durante o reconhecimento de expressões faciais temíveis (Fusar-Poli et al., 2009)., Os autores explicaram ainda que esta ação da CBD foi mediada por alterações na conectividade pré-frontal subcortical via amígdala e córtex cingulado anterior (Fusar-Poli et al., 2010).apesar da identificação das áreas cerebrais que podem estar envolvidas no efeito ansiolítico da CBD, o mecanismo farmacológico específico responsável por este efeito permanece por esclarecer., CDB é uma droga com vários alvos farmacológicos, incluindo a interação com vários receptores (CB1, CB2, GPR55, TRPV1, e 5-HT1A), a interferência com a absorção e o metabolismo dos endocanabinoides, e aumento do hipocampo neurogênese no cérebro adulto (Zuardi et al., 2017). Vários estudos têm apoiado o envolvimento de receptores 5-HT1A na ação ansiolítica aguda da CBD., Por exemplo, o efeito ansiolítico induzido por injeções sistêmicas ou intra-dorsais de cinza periaqueductal (DPAG) de CBD em ratos é prevenido por um antagonista de receptores 5-HT1A (Campos e Guimarães, 2008; Soares et al., 2010). Uma interação semelhante entre receptores CBD e 5-HT1A em outras estruturas cerebrais relacionadas com o controle de comportamentos de ansiedade, como o núcleo da cama do stria terminallis ou o córtex frontal preliminar, também está envolvido na atenuação das respostas de ansiedade (Gomes et al., 2011, 2012; Fogaça et al., 2014)., Em células cultivadas, a CBD tem sido relatada como um agonista do receptor 5-HT1A (Russo et al., 2005), embora estudos recentes sugiram que este não é o caso em fatias ou condições in vivo. A facilitação da neurotransmissão mediada por 5-HT1A pela CBD não parece envolver o bloqueio da recaptação de 5-HT ou alterações na expressão de mRNA 5-HT1A na DPAG após administração crónica de CBD (Campos et al., 2013). Estas observações sugerem que a modulação de receptores 5-HT1A pela CBD é complexa e pode envolver interações alostéricas (Rock et al., 2011).,como mencionado anteriormente, os mecanismos responsáveis pela curva invertida em U da dose-resposta da CBD são mal compreendidos. Podem envolver interacções com o receptor vanilóide 1 ou TRPV1. Em altas concentrações, a CBD pode ativar estes receptores e facilitar a libertação de glutamato e Respostas defensivas (Guimarães et al., 1991; Campos e Guimarães, 2009). Este mecanismo pode mascarar o efeito ansiolítico da CBD mediado por receptores 5-HT1A., Testar esta possibilidade usando injecções intra-DPAG em ratos, Campos e Guimarães (2009) mostrou que o pré-tratamento com um antagonista TRPV1 (capsazepina) transformou uma dose maior e ineficaz de CBD em uma ansiolítica. Continua por testar se um mecanismo semelhante também está envolvido na curva dose-resposta em forma de U observada no nosso estudo. Consoante com evidências anteriores indicando que CBD tem propriedades sedativas mais fracas em comparação com benzodiazepinas (Zuardi et al., 1993), a dose ansiolítica de CBD (300 mg) induziu um nível de sedação significativamente menor do que o clonazepam., É uma vantagem que deve ser destacada, uma vez que a sedação e a deficiência de coordenação motora estão entre os efeitos adversos mais comuns das benzodiazepinas, além de dependência potencial, déficits cognitivos e sintomas de abstinência, especialmente na velhice (Sgnaolin et al., 2016). Estes efeitos secundários não foram observados com a utilização de CBD (Bergamaschi et al., 2011b).os achados aqui relatados devem ser interpretados com precaução, dadas as limitações do nosso estudo., Em primeiro lugar, teria sido desejável medir os níveis plasmáticos de CBD e clonazepam e relacionar estas medições com a magnitude dos níveis de ansiedade; sem uma curva dose-resposta, subsistem dúvidas sobre se os efeitos da CBD realmente seguem uma curva invertida em forma de U. Note-se, no entanto, que investigações anteriores não conseguiram estabelecer uma relação directa entre os níveis plasmáticos de CBD e os seus efeitos clínicos (Agurell et al., 1986). Além disso, o pequeno tamanho da amostra limita o poder estatístico do ensaio., Além disso, o projeto do estudo não nos permite descartar a possibilidade de que outra dose moderada (por exemplo, 400 ou 600 mg) possa ter tido efeitos ansiolíticos ainda maiores. Por exemplo, estudos anteriores demonstraram efeitos ansiolíticos agudos de 400 mg de CBD em estudos SPECT em voluntários saudáveis (Crippa et al., 2004) e em pacientes com fobia social (Crippa et al., 2011) e de CBD 600 mg em uma experiência de fMRI com homens saudáveis (Bhattacharyya et al., 2010)., Embora não seja necessário para esta prova de estudo conceptual, estas limitações poderiam ser superadas em estudos futuros examinando outras 2-3 doses entre 300 e 900 mg para estabelecer um verdadeiro índice terapêutico.
conclusão
nossos resultados são consonantes com evidências de estudos pré-clínicos e suportam a visão de que CBD induz efeitos ansiolíticos agudos com uma curva invertida em forma de dose-resposta em seres humanos. Estes resultados sublinham a importância da escolha cuidadosa dos intervalos de dose quando se investigam os potenciais efeitos terapêuticos da CBD., São necessários outros estudos que avaliem a curva dose-resposta da CBD noutras situações como a esquizofrenia, a dor, a epilepsia e a doença de Parkinson e que envolvam a administração crónica da CBD para traduzir evidências pré-clínicas em práticas clínicas e determinar a janela terapêutica precisa da CBD para cada condição.
contribuições dos autores
AZ, JH, e JC desenharam o estudo. NR, AS, and SB conducted the experiments. AZ e a FG realizaram a análise estatística. AZ escreveu o primeiro rascunho do manuscrito., Todos os autores contribuíram e aprovaram o manuscrito final.
Declaração de conflito de interesses
AZ, JH, FG e JC são co-inventores (Mechoulam R, JC, Guimaraes FS, AZ, JH, Breuer a) da patente “compostos fluorados CBD, composições e utilizações das mesmas. Pub. Não.: WO / 2014 / 108899. Pedido Internacional N. O: PCT / IL2014 / 050023 ” Def. Nós não. Admissao. 62193296; 29/07/2015; INPI em 19/08/2015 (BR1120150164927). A Universidade de São Paulo licenciou a patente para Pharm Phytecs (resolução USP n. º 15.1.130002.1.1)., A Universidade de São Paulo tem um acordo com Prati-Donaduzzi (Toledo, Brasil) para ” desenvolver um produto farmacêutico contendo canabidiol sintético e provar sua segurança e eficácia terapêutica no tratamento da epilepsia, esquizofrenia, doença de Parkinson e transtornos de ansiedade.”JH e JC receberam apoio de viagem da BSPG-Pharm.os outros autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.,
os revisores RWG, KA e handling Editor declararam sua afiliação compartilhada, e o handling Editor afirma que o processo, no entanto, cumpriu os padrões de uma revisão justa e objetiva.
agradecimentos
AZ, JH, FG, e JC são beneficiários do prêmio de fellowship do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, Brasil). O presente estudo foi apoiado por uma subvenção CNPq (CNPq/MS/SCTIE/DECIT N∘ 26/2014 – Pesquisas sobre Distúrbios Neuropsiquiquiátricos; 466805/2014-4) e BSPG-Pharm (Sandwich, UK) gentilmente forneceu CBD sem custo.,
Campos, A. C., and Guimarães, F. S. (2008). Envolvimento dos receptores 5HT1A nos efeitos ansiolíticos do canabidiol injectado no periaqueducto dorsolateral dos ratos. Psychopharmacology (Berl) 199, 223-230. doi: 10.1007/s00213-008-1168-x
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Campos, A. C. e Guimarães, F. S. (2009). Evidence for a potential role for TRPV1 receptors in the dorsolateral periaqueductal gray in the atenuation of the anxiolytic effects of canabinoids. Programa., Neuropsychopharmacol. Biol. Psychiatry 33, 1517–1521. doi: 10.1016/j.pnpbp.2009.08.017
PubMed Abstract | CrossRef Full Text | Google Scholar