10.2 Brønsted-Lowry Definição de Ácidos e Bases
Objetivos
- Reconhecer um composto como um Brønsted-Lowry ácido ou uma Brønsted-Lowry da base de dados.
- ilustra o processo de transferência de prótons que define uma reação ácido-base Brønsted-Lowry.amoníaco (NH3) aumenta a concentração do ião hidróxido em solução aquosa reagindo com água, em vez de libertar iões hidróxido diretamente., De fato, as definições de Arrhenius de um ácido e uma base focam em íons de hidrogênio e íons de hidróxido. Existem definições mais fundamentais para ácidos e bases?em 1923, o cientista dinamarquês Johannes Brønsted e o cientista inglês Thomas Lowry propuseram novas definições para ácidos e bases. Ao invés de considerar os íons hidrogênio e hidróxido, eles focaram apenas no íon hidrogênio. Um composto acidA Brønsted-Lowry que fornece um íon de hidrogênio (H+) em uma reação; um doador de prótons. é um composto que fornece um íon de hidrogênio em uma reação., Um composto baseA Brønsted-Lowry que aceita um íon hidrogênio (H+) em uma reação; um aceitador de prótons., inversamente, é um composto que aceita um íon hidrogênio em uma reação. Thus, the Brønsted-Lowry definitions of an acid and a base focus on the movement of hydrogen ions in a reaction, rather than on the production of hydrogen ions and hydroxide ions in an aqueous solution.vamos usar a reação de amônia na água para demonstrar as definições Brønsted-Lowry de um ácido e uma base., Amônia e moléculas de água são reagentes, enquanto o íon amônio e o íon hidróxido são produtos:
NH3(aq) + H2O(ℓ) → NH4+(aq) + OH−(aq)
O que aconteceu nesta reação é que a molécula de água original doou um íon hidrogênio para a molécula de amônia original, que por sua vez aceitou o íon hidrogênio. Podemos ilustrar isso da seguinte forma:
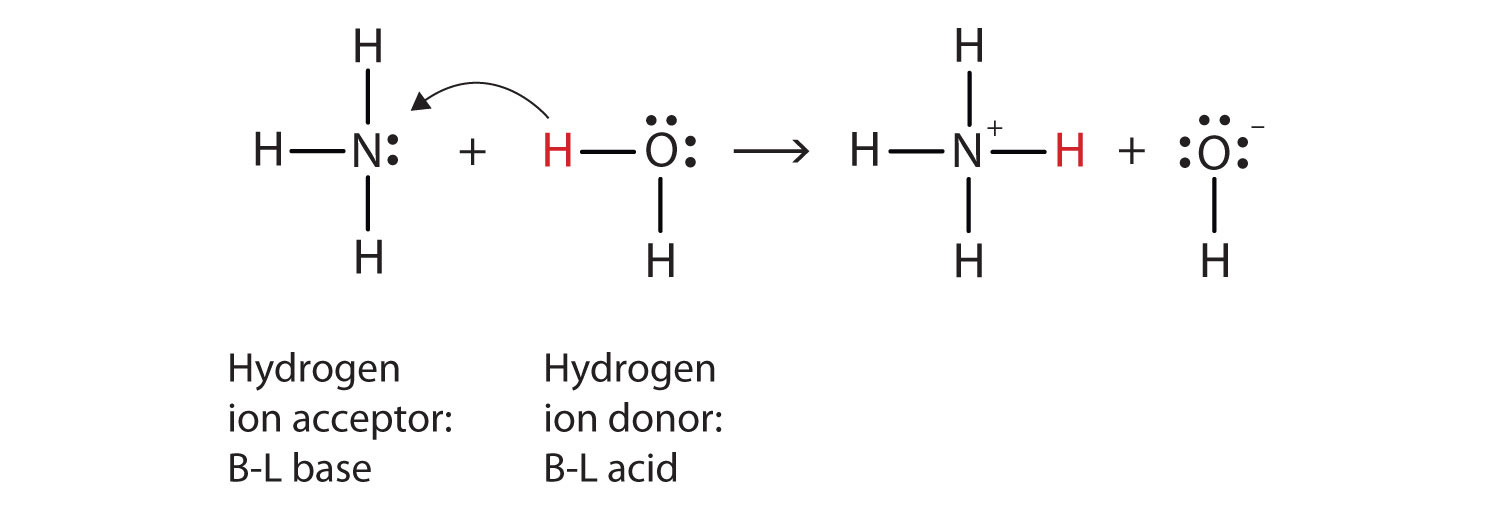
Porque a molécula de água doa um íon de hidrogênio da amônia, é o Brønsted-Lowry, ácido, enquanto a molécula de amônia—que aceita o íon de hidrogênio—é o Brønsted-Lowry da base de dados., Assim, a amônia atua como uma base tanto no sentido Arrhenius quanto no sentido Brønsted-Lowry.um ácido de Arrhenius ainda é um ácido no sentido Brønsted-Lowry? Sim, mas requer que entendamos o que realmente acontece quando HCl é dissolvido em água. Lembre-se que o átomo de hidrogênio é um único próton rodeado por um único elétron. Para fazer o íon de hidrogênio, removemos o elétron, deixando um próton. Temos mesmo protões nus a flutuar em solução aquosa? Não, Não temos., O que realmente acontece é que o íon h+ se liga a H2O para fazer H3O+, que é chamado de íon hidrônio. Para a maioria dos propósitos, H+ E H3O+ representam a mesma espécie, mas escrever H3O+ em vez de H+ mostra que entendemos que não existem protões nus flutuando em solução. Em vez disso, estes protões estão na verdade ligados às moléculas do solvente.
Nota
Um próton em solução aquosa pode ser rodeado por mais de uma molécula de água, levando a fórmulas como H5O2+ ou H9O4+ em vez de H3O+. É mais simples, no entanto, usar H3O+.,com isso em mente, como definimos HCl como um ácido no sentido Brønsted-Lowry? Considere o que acontece quando HCl é dissolvido em H2O:
HCl + H2O(ℓ) → H3O+(aq) + Cl−(aq)
podemos representar esse processo de utilização de Lewis elétron ponto diagramas:
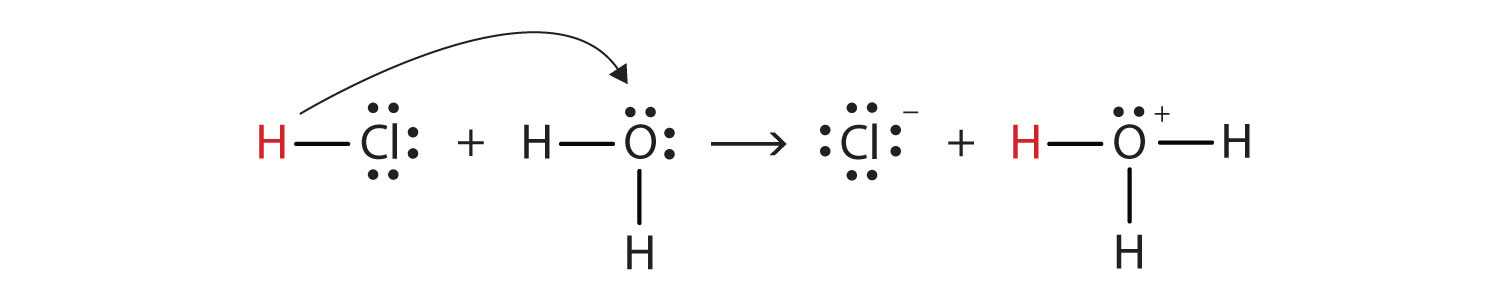
Agora, pois, vemos que um íon de hidrogênio é transferido do HCl molécula a molécula de H2O para fazer íons de cloreto e um hidrônio íons. Como doador de íons de hidrogênio, HCl atua como um ácido Brønsted-Lowry; como um aceitador de íons de hidrogênio, H2O é uma base Brønsted-Lowry., Então HCl é um ácido não apenas no sentido de Arrhenius, mas também no sentido Brønsted-Lowry. Além disso, pelas definições Brønsted-Lowry, H2O é uma base na formação de HCl aquoso. Assim, as definições Brønsted-Lowry de um ácido e uma base classificam a dissolução do HCl na água como uma reação entre um ácido e uma base—embora a definição de Arrhenius não teria rotulado H2O uma base nesta circunstância.todos os ácidos e bases de Arrhenius são ácidos e bases Brønsted-Lowry. Mas nem todos os ácidos e bases Brønsted-Lowry são ácidos e bases de Arrhenius.,
Exemplo 3
Anilina (C6H5NH2) é ligeiramente solúvel em água. Tem um átomo de nitrogênio que pode aceitar um íon de hidrogênio de uma molécula de água, assim como o átomo de nitrogênio em amônia. Escreva a equação química para esta reação e identifique o ácido Brønsted-Lowry e a base.
solução
c6h5nh2 e H2O são os reagentes. Quando C6H5NH2 aceita um próton de H2O, ele ganha um h extra e uma carga positiva e deixa um íon OH para trás., A reação é a seguinte:
C6H5NH2(aq) + H2O(ℓ) → C6H5NH3+(AQ) + OH−(aq)
porque c6h5nh2 aceita um próton, é a base Brønsted-Lowry. A molécula de H2O, porque doa um próton, é o ácido Brønsted-Lowry.
exercício de construção de habilidades
-
cafeína (C8H10N4O2) é um estimulante encontrado em cafés e chás. Quando dissolvido em água, pode aceitar um próton de uma molécula de água. Escreva a equação química para este processo e identifique o ácido e a base de Brønsted-Lowry.,as definições Brønsted-Lowry de um ácido e uma base podem ser aplicadas a reações químicas que ocorrem em solventes diferentes da água. O exemplo seguinte ilustra.
exemplo 4
amida de sódio (NaNH2) dissolve−se em metanol (CH3OH) e separa-se em iões de sódio e iões de amida (NH2 -). Os iões amida reagem com metanol para fazer amônia e o íon metoxide (CH3O−). Escreva uma equação química equilibrada para este processo e identifique o ácido Brønsted-Lowry e a base.,
Solução
A equação para a reação entre NH2− e CH3OH para fazer NH3 e CH3O− é o seguinte:
NH2−(resolver) + CH3OH(ℓ) → NH3(resolver) + CH3O−(resolver)
O rótulo (resolver) indica que as espécies são dissolvidos em um solvente, em contraste com (aq), que especifica um aquosa (H2O) solução. Nesta reação, vemos que o íon NH2 aceita um próton de uma molécula CH3OH para fazer uma molécula NH3. Assim, como o aceitador de prótons, NH2-é a base Brønsted-Lowry. Como o doador de prótons, CH3OH é o ácido Brønsted-Lowry.,
exercício de Capacitação
-
Cloreto de Piridínio (C5H5NHCl) dissolve-se em etanol (C2H5OH) e separa-se em íons piridinium (C5H5NH+) e íons cloreto. O íon piridínio pode transferir um íon hidrogênio para uma molécula de solvente. Escreva uma equação química equilibrada para este processo e identifique o ácido Brønsted-Lowry e a base.
Para a Sua Saúde: Brønsted-Lowry Ácido-Base Reacções de produtos Farmacêuticos
Existem muitas aplicações interessantes de Brønsted-Lowry ácido-base reações na indústria farmacêutica., Por exemplo, os medicamentos muitas vezes precisam ser solúveis em água para a máxima eficácia. No entanto, muitos compostos orgânicos complexos não são solúveis ou são apenas ligeiramente solúveis em água. Felizmente, as drogas que contêm átomos de nitrogênio que aceitam prótons (e há muitos deles) podem ser reagidas com ácido clorídrico diluído . Os átomos de nitrogênio-agindo como bases de Brønsted-Lowry—aceitam os íons de hidrogênio do ácido para fazer um íon, que é geralmente muito mais solúvel em água., As moléculas de drogas modificadas podem então ser isoladas como sais de cloreto:
RN(sl aq) + H+(aq) → RNH+(aq) →Cl−(aq) RNHCl(S)
Onde RN representa algum composto orgânico contendo nitrogênio. O rótulo (sl aq) significa “ligeiramente aquosa”, indicando que o composto RN é apenas ligeiramente solúvel. As drogas que são modificadas desta forma são chamadas sais de cloridrato. Exemplos incluem a poderosa codeína do analgésico, que é frequentemente administrada como cloridrato de codeína. Outros ácidos além do ácido clorídrico também são usados. Ácido hidrobrômico, por exemplo, dá sais de bromidrato., O dextrometorfano, um ingrediente em muitos medicamentos para a tosse, é administrado sob a forma de bromidrato de dextrometorfano. A figura que acompanha mostra outra medicação como um sal de cloridrato.
o nome deste medicamento deixa claro que existe como sal de cloridrato.
© Thinkstock
Concept Review Exercise
-
Give the definitions of a Brønsted-Lowry acid and a Brønsted-Lowry base.,
Resposta
-
um Brønsted-Lowry ácido é um doador de prótons, enquanto um Brønsted-Lowry base é um aceitador de protões.
key Takeaways
- a Brønsted-Lowry acid is a proton door, and a Brønsted-Lowry base is a proton acceptor. as reacções ácido-base Brønsted-Lowry são essencialmente reacções de transferência de prótons.
exercícios
-
rotular cada reativo como um ácido Brønsted-Lowry ou uma base Brønsted-Lowry.,
HCl(aq) + NH3 (AQ) → NH4 + (AQ) + Cl−(aq)
-
rotular cada reativo como um ácido Brønsted-Lowry ou uma base Brønsted-Lowry.
H2O(ℓ)+N2H4 (AQ) → N2H5 + (AQ) + OH−(AQ)
-
explique por que um ácido Brønsted-Lowry pode ser chamado de doador de prótons.
-
escrever a equação química da reacção do amoníaco na água e rotular o ácido e a base de Brønsted-Lowry.,
-
escrever a equação química da reação de metilamina (CH3NH2) em água e rotular o ácido e base de Brønsted-Lowry.
-
Identificar o Brønsted-Lowry ácido e base na seguinte equação química:
C3H7NH2(aq) + H3O+(aq) → C3H7NH3+(aq) + H2O(ℓ)
-
Escreva a equação química para a reação que ocorre quando o cloridrato de cocaína (C17H22ClNO4) dissolve-se na água e doa um próton de uma molécula de água. (Quando os hidrocloretos se dissolvem em água, separam-se em iões de cloreto e na cação adequada.)
-
If codeine hydromide has the formula C18H22BrNO3, what is the formula of the parent compound codeine?,
explique por que uma base Brønsted-Lowry pode ser chamada de aceitador de protões.
demonstra que a dissolução do HNO3 na água é na verdade uma reação ácido-base Brønsted-Lowry descrevendo-o com uma equação química e rotulando o ácido Brønsted-Lowry e base.,
-
-