categoria: química
publicado: 9 de dezembro de 2013
Sim, a água pode permanecer líquida abaixo de zero graus Celsius. Há algumas maneiras de isso acontecer.
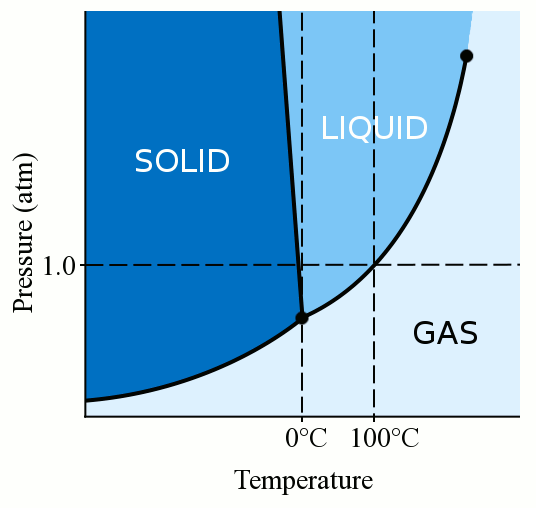
Em primeiro lugar, a fase de um material (quer seja gás, líquido ou sólido) depende fortemente da sua temperatura e pressão., Para a maioria dos líquidos, a aplicação de pressão aumenta a temperatura a que o líquido congela para sólido. Um sólido é formado quando as moléculas soltas e sinuosas de um líquido ficam lentas o suficiente e próximas o suficiente para formar ligações estáveis que as fixam no lugar. Quando aplicamos pressão a um líquido, forçamos as moléculas a aproximarem-se. Podem, portanto, formar ligações estáveis e tornar-se sólidas, mesmo que tenham uma temperatura mais elevada do que o ponto de congelação à pressão normal. A água é um pouco única, no entanto. As moléculas de água espalham-se quando se ligam a uma estrutura cristalina sólida., Esta ação de disseminação leva o gelo a ser menos denso do que a água líquida, fazendo com que o gelo flutue. Esta ação de dispersão das moléculas de água durante a congelação também significa que a aplicação de pressão à água reduz o ponto de congelação. Se você aplicar pressão suficiente (tornando difícil para as moléculas de água se espalharem para a estrutura sólida), você pode ter água líquida vários graus abaixo de zero graus Celsius.mesmo que não aplique pressão, pode ainda ter água líquida a temperaturas inferiores a zero utilizando aditivos., Aditivos como o sal podem interferir com a ligação química necessária para formar um sólido e, portanto, podem diminuir o ponto de congelação da água. O sal é composto por iões de sódio e cloro fortes. Quando dissolvidas em água, as moléculas de água tendem a se colar aos íons salinos em vez de um ao outro, e, portanto, não congelam tão prontamente. À medida que se adiciona mais sal à água, o seu ponto de congelação continua a cair até que a água atinja a saturação e não possa conter mais sal. Se você adicionar sal suficiente, o ponto de congelamento da água pode ser deixado cair tão baixo quanto -21 graus Celsius., Este facto significa que a água a -21 graus Celsius ainda pode permanecer líquida se for adicionado sal suficiente. Em vez de impedir que a água líquida congele, esta poderosa propriedade de sal também pode ser usada para transformar o gelo de volta em água. A aspersão de sal em calçadas geladas reduz o ponto de congelação do gelo abaixo da temperatura ambiente e o gelo derrete. Mas espalhar sal nas passarelas geladas não vai ajudar se a temperatura ambiente estiver abaixo de -21 graus Celsius. O efeito do sal no ponto de congelação da água também tem efeitos profundos nos oceanos da terra.,mesmo que você não aplique pressão e não adicione nada à água, você ainda pode ter água líquida a temperaturas abaixo de zero graus Celsius. Para que a água congele para o gelo, precisa de algo para congelar para iniciar o processo. Chamamos a estes pontos de partida “centros de nucleação”. Na maioria das situações, um pouco de poeira, impureza ou até mesmo pequenas vibrações na água fornecem centros de nucleação para a água congelar. Mas se a sua água é muito pura e muito quieta, não há nada para as moléculas de água cristalizarem., Como resultado, você pode resfriar água muito pura bem abaixo de zero graus Celsius sem congelação. A água nesta condição é chamada de “super arrefecido”. A pressão padrão, a água pura pode ser super-resfriada até cerca de -40 graus Celsius. A água super arrefecida é impedida de congelar apenas pela falta de centros de nucleação. Portanto, uma vez que os centros de nucleação são fornecidos (o que poderia ser tão simples como uma vibração), a água super arrefecida rapidamente congela. A chuva gelada é um exemplo natural de água líquida super-resfriada., Uma vez que a chuva gelada atinge um objeto na superfície da terra, esse objeto fornece centros de nucleação, e a chuva congela em gelo.tópicos: congelação, ponto de congelação, chuva gelada, Diagrama de fase, pressão, super arrefecido, temperatura, água