até agora, temos olhado para as formas em que pares de orbitais atômicos poderiam se combinar para formar orbitais moleculares — para formar ligações. Assim como pensamos que há uma progressão dos orbitais atômicos de menor energia para maior (1s, 2s, 2p, 3s…), nós podemos organizar estes orbitais moleculares por ordem de sua energia.
em grande medida, a ordem dos orbitais moleculares em energia pode ser considerada a seguir da ordem dos orbitais atômicos a partir dos quais são construídos., Há alguns desvios dessa regra, às vezes, mas esse é o lugar mais simples para começar. Então, numa molécula, os orbitais moleculares de menor energia seriam os formados a partir dos orbitais atômicos de menor energia, os orbitais 1s.
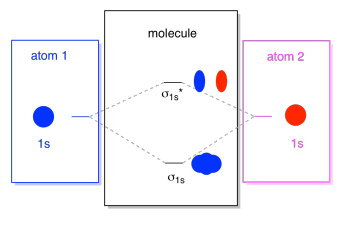
o que vemos aqui é um diagrama de interacção orbital molecular. O meio do diagrama é apenas o diagrama de energia orbital molecular. É análogo ao diagrama de energia orbital atômica (que vai 1s, 2s, 2p, 3s…). A ordem de energia até agora é σ1s, σ1s*., Os lados do diagrama apenas se referem de onde esses orbitais moleculares vieram, com linhas pontilhadas para guiá-lo de um lugar para outro. Ao todo, a imagem diz que o 1s orbital em um átomo e o 1s orbital no outro átomo podem se combinar de duas maneiras diferentes, produzindo a menor energia, ligando σ1s e a maior energia, antibonding σ1s*.
Note que nós não adicionamos nenhum elétrons a esse diagrama de energia orbital molecular ainda, mas quando o fizermos, nós vamos apenas preenchê-los a partir de baixo para cima, assim como nós faríamos um diagrama de energia orbital atômica.,
O próximo menor conjunto de orbitais atômicos é o nível 2s. Estes orbitais esféricos combinam-se muito como orbitais 1s, e nós obteríamos um diagrama semelhante, apenas a um nível de energia ligeiramente superior.
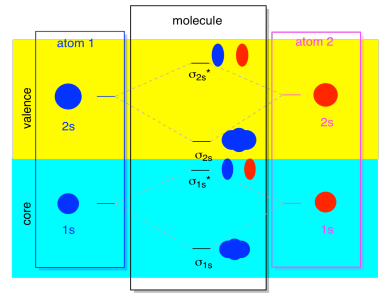
na maior parte do tempo, não vamos ver tanto os σ1s como os σ2s apresentados no diagrama. Isso é porque se houver algum elétrons 2s, então esses elétrons 1s são realmente elétrons do núcleo, não Valência. Eles estão enterrados um pouco mais fundo no átomo, e eles não desempenham um papel muito importante na ligação., Ignorar os elétrons do núcleo é muito comum; se você se lembrar, em configurações de elétrons atômicos poderíamos escrever 2s22p4 em vez de 1s22s22p4 para oxigênio; estávamos ignorando o núcleo. Quando desenhamos estruturas de Lewis, demos seis elétrons de oxigênio, em vez de oito, estávamos ignorando o núcleo.
no contexto de MO, suponha que temos elétrons 2s. Isso deve significar que cada átomo tem dois elétrons 1s próprios, para um total de quatro. Quando esses quatro elétrons são preenchidos no diagrama MO de baixo para cima, eles vão ocupar tanto a ligação σ1s e o antibonding σ1s*., O efeito de ambas as combinações que estão sendo ocupadas é cancelar a ligação; esses dois pares de elétrons permanecem não-ligação. Então podemos ignorá-los e não estamos a perder nada.
os orbitais 2s não são os únicos na segunda concha. Há também orbitais 2p. Lembre-se, há um par de maneiras muito diferentes em que os orbitais p podem se combinar uns com os outros, dependendo do eixo em que se encontram. Se eles não se encontram paralelos um ao outro — isto é, se eles são perpendiculares um ao outro, como um px e um py — então eles não podem interagir um com o outro., O pz em um átomo poderia interagir com o pz no outro átomo, no entanto, porque eles são paralelos uns aos outros.normalmente, definimos o eixo z como estando ao longo da linha entre os dois átomos que estamos a ver. Dois orbitais pz iria mentir ao longo do seu eixo, cada um com um lobo, estendendo-se para o espaço entre os átomos, e cada um com o outro lobo estendendo-se longe, em outra direção
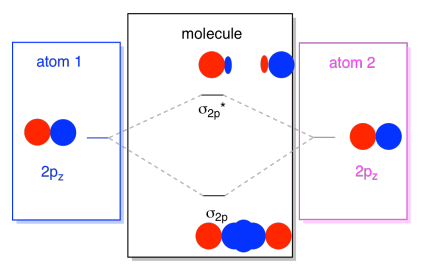
As combinações resultantes são chamados de σ, porque eles mentem ao longo do eixo entre os átomos (que é exatamente o que σ significa, em termos de ligação)., Há uma combinação σ, se os lóbulos sobrepostos estão em fase um com o outro, e σ* combinação, se esses lóbulos estão fora de fase um com o outro. Como esses novos orbitais surgem dos orbitais atômicos 2p, nós os chamamos de σ2p e σ2p*.
Existem também os orbitais p que não se encontram ao longo do eixo da ligação, ou o eixo entre os dois átomos. Os orbitais px são perpendiculares aos orbitais pz que acabamos de ver, e, portanto, perpendiculares ao eixo entre as ligações. No entanto, eles ainda são paralelos uns aos outros, e eles ainda podem formar combinações., Estes dois orbitais formariam uma combinação em fase e uma combinação fora de fase.
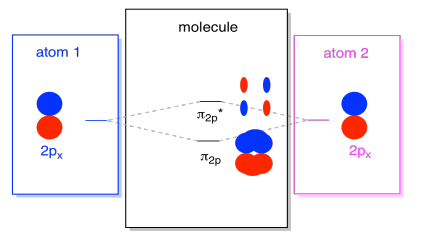
Note que a separação energética entre estas duas combinações é um pouco menor que a diferença entre os níveis σ2p e σ2p*. A diferença está relacionada ao grau de sobreposição entre os orbitais atômicos. Os orbitais no eixo projetam fortemente no mesmo espaço; eles se sobrepõem muito, e interagem fortemente. Os orbitais fora do eixo escovam-se uns contra os outros, interagindo menos fortemente, e resultando em mudanças energéticas menores., A diferença entre o orbital de N2 e o orbital de N2 é, portanto, muito menor do que a distância entre os orbitais σ2p e σ2p*.
Existem na verdade dois desses orbitais p fora do eixo. Além do conjunto px, teríamos um conjunto py. Se o conjunto px está no plano da Tela, O conjunto py tem um orbital saindo na frente e um escondido atrás. No entanto, as combinações entre os dois orbitais py são exatamente as mesmas que vimos entre os dois orbitais px. Eles são apenas rodados em um plano perpendicular em relação às combinações px.,
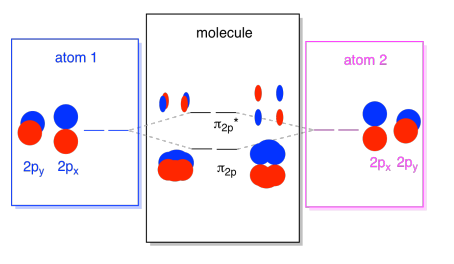
Podemos colocar todos esses orbitais baseados em 2p juntos em um diagrama. Está começando a ficar um pouco mais lotado, mas este diagrama é apenas uma combinação das peças que já vimos. Note que os orbitais atômicos px, py e pz começam todos com a mesma energia (nós os empilhamos aqui para que você ainda possa ver a correlação entre os orbitais atômicos e moleculares). O que significa que o n2p & n2p* orbitais vai ser “aninhadas” entre o σ2p & σ2p* orbitais.,
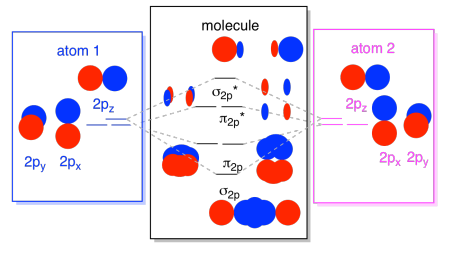
Finalmente, tendo em mente que os orbitais 2p são mais altos em energia que os orbitais 2s, podemos combinar essas fotos em um diagrama. Mais uma vez, já vimos essas peças individuais antes; estamos apenas montando-as agora.
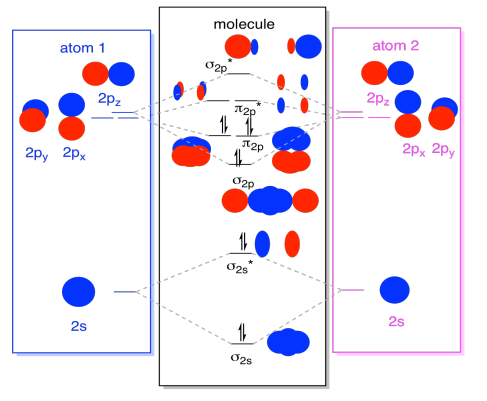
Como? É apenas o número total de elétrons de Valência. Por exemplo, usamos N2., Cada nitrogênio tem cinco elétrons de Valência, para um total de dez, então nós acabamos de preencher dez elétrons, começando no fundo do diagrama de nível de energia orbital molecular. Se esta fosse outra molécula, como F2 ou O2, nós construiríamos o diagrama geral de uma forma semelhante, mas apenas usaríamos um número diferente de elétrons.
A imagem orbital que descrevemos acima é realmente apenas uma imagem potencial da estrutura eletrônica do dinitrogênio (e de qualquer outro grupo principal ou diatômico do bloco p)., Não vamos ter uma imagem real da estrutura do dinitrogénio até popularmos estes níveis potenciais com electrões.
- somente os níveis de energia com elétrons têm um efeito na energia (e comportamento) da molécula.em outras palavras, a energia dos elétrons determina o comportamento da molécula. Os outros níveis de energia são apenas possibilidades que permanecem por cumprir.
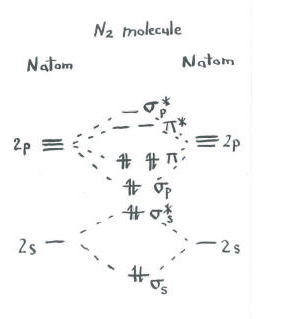
pense na imagem do dinitrogénio.cada nitrogênio tem cinco elétrons de Valência.
- Há um total de dez elétrons.,dois entram cada um nos níveis de ligação s E S* antibonding. Lembre-se, nós os mantivemos separados do p set como uma simplificação.
- dois cada um vão para a ligação s p e cada um dos níveis de ligação p.os orbitais restantes (p* antibonding e cada um dos níveis de P * antibonding) estão desocupados. Estes são níveis imaginários que não desempenham um papel na determinação da energia do dinitrogênio. Em um cálculo molecular orbital real, os elétrons nesses níveis contribuiriam para a energia global da molécula.,nós obtemos informações adicionais a partir desta imagem. Por exemplo, podemos ver a ordem de ligação em dinitrogénio.
- ordem de ligação é apenas o número de ligações entre um par de átomos.
- a ordem de ligação é um dos vários factores que influenciam a força da ligação covalente.quanto maior a ordem de ligação, mais elétrons são compartilhados entre os átomos, e mais forte a ligação.
em dinitrogen, os níveis de ligação S S S S* antibonding anulam-se mutuamente. Um par é menor em energia do que no átomo, mas o outro é maior., Não há redução líquida de energia. Estes elétrons não contribuem para uma ligação nitrogênio-nitrogênio. Estes são pares de elétrons não ligados.
os seis elétrons na ligação s p e os níveis de ligação p, no entanto, representam uma diminuição da energia dos níveis de energia nos átomos de nitrogênio livre. Estes três pares de elétrons de baixa energia indicam três ligações entre os átomos de nitrogênio.
lembre-se, nós fizemos alguns cortes curtos nesta imagem, e um cálculo orbital molecular real poderia dar resultados ligeiramente diferentes., No entanto, ele ainda revelaria uma ordem de ligação de três, bem como dois pares de elétrons não ligados.
in addition, sometimes molecular orbital pictures are shown in different ways. Um diagrama de interação orbital molecular mostra como orbitais atômicos ou moleculares se combinam para fazer novos orbitais. Às vezes, podemos estar interessados apenas nos níveis de energia orbital molecular, e não de onde eles vieram. Um diagrama de nível de energia orbital molecular apenas mostra os níveis de energia na molécula., Frequentemente, mas nem sempre, diagramas de nível de energia são mostrados sem nenhuma imagem dos orbitais, a fim de focar a atenção nos níveis de energia, que de uma forma fundamental são a parte mais importante da imagem. Além disso, porque apenas os níveis de energia ocupados realmente contribuem para a energia da molécula, às vezes a energia superior, orbitais desocupados são deixados fora do quadro.

muito frequentemente, os resultados dos cálculos orbitais moleculares reforçam o que seria previsto a partir das estruturas de Lewis., Se você desenhar uma estrutura de Lewis de dinitrogênio, você também vai prever uma ligação tripla nitrogênio-nitrogênio. A principal vantagem da teoria orbital molecular é que ela permite a previsão quantitativa de energia quando fazemos um cálculo real em um computador. Além disso, é importante perceber que não há nenhuma razão real para a Regra do octeto a menos que consideremos a mecânica quântica. Estruturas de Lewis são baseadas em uma observação empírica de que os elétrons formam pares e octetos, sem tentar explicar o porquê., A teoria orbital Molecular pega algumas relações fundamentais da física e aplica-as a moléculas muito complicadas com muito bom sucesso. Apenas conhecendo o número de elétrons na molécula, e sabendo aproximadamente onde os núcleos estão localizados na estrutura, cálculos moleculares orbitais dão informações muito úteis sobre energia. Além disso, em casos mais complicados do que o N2, estes cálculos podem até corrigir o nosso primeiro palpite sobre Geometria molecular e onde as ligações estão localizadas.,
exercício \(\PageIndex{2}\)
Um diagrama orbital Molecular para uma molécula diatómica (dois átomos) varia no número de electrões. Como é que se povoam os electrões?
Resposta
* conte os elétrons de Valência na molécula. Esse é o número de elétrons de Valência em cada átomo, ajustado para qualquer carga na molécula. (eg C22-tem 10 elétrons de Valência: 4 de cada Carbono — isso é 8 — e mais dois para a carga de 2).
• encha os elétrons para os orbitais de menor energia primeiro.
• pares de elétrons depois de todos os orbitais no mesmo nível de energia têm um elétron.,exercício \(\PageIndex{3}\)
construir um diagrama molecular orbital qualitativo para o cloro, Cl2. Compare a ordem de ligação com a vista na estrutura de Lewis (lembre-se que um elétron em um orbital antibonding cancela a estabilização devido à ligação de um elétron em um orbital de ligação).
resposta
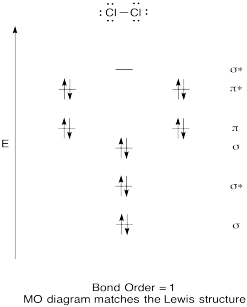
exercício \(\PageIndex{4}\)
- construir um diagrama orbital molecular qualitativo para o oxigénio, O2.
- Compare a ordem de ligação com a vista na estrutura de Lewis.,de que outra forma é que esta imagem MO do oxigénio se compara à estrutura de Lewis? O que as duas estruturas lhe dizem sobre emparelhamento de elétrons?compostos que têm todos os seus electrões emparelhados são referidos como diamagnéticos. Aqueles com elétrons não emparelhados são referidos como paramagnéticos. Materiais paramagnéticos são atraídos por um campo magnético, mas coisas diamagnéticas não são. Como espera que o oxigénio molecular se comporte?,
Resposta
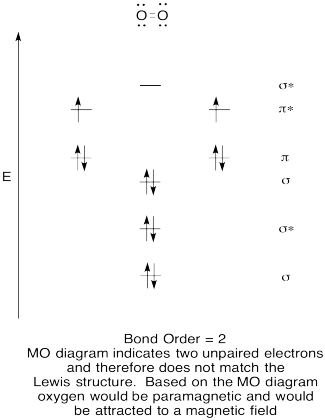
Exercício de \(\PageIndex{5}\)
- Construir uma qualitativa diagrama de orbitais moleculares para peróxido de ânions, O22-.
- Compare a ordem de ligação com a vista na estrutura de Lewis.de que outra forma é que esta imagem MO do oxigénio se compara à estrutura de Lewis? O que as duas estruturas lhe dizem sobre emparelhamento de elétrons?,com base em imagens moleculares orbitais, quão facilmente você acha que o dioxígeno pode ser reduzido a peróxido (através da adição de dois elétrons)?
Resposta
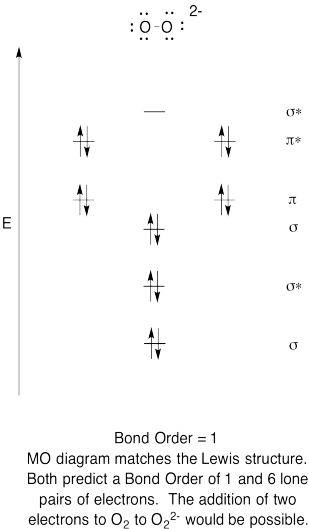
Exercício de \(\PageIndex{6}\)
Construir uma qualitativa diagrama de orbitais moleculares para diboron, B2. Achas que as ligações Boro-Boro podem formar-se facilmente, com base nesta imagem?,
Resposta
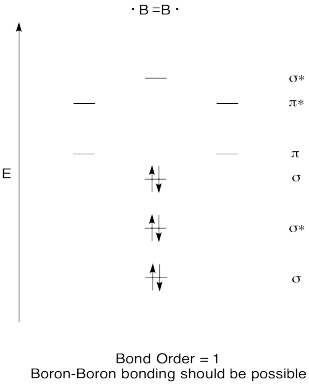
Exercício de \(\PageIndex{7}\)
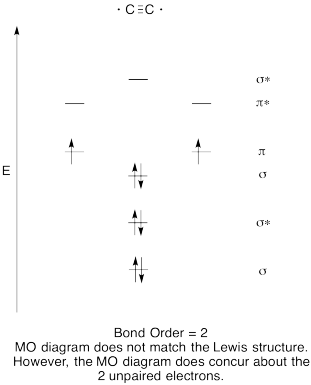
- Construir uma qualitativa diagrama de orbitais moleculares para dicarbon, C2.
- Compare a ordem de ligação com a vista na estrutura de Lewis.de que outra forma é que esta imagem MO do oxigénio se compara à estrutura de Lewis? O que as duas estruturas lhe dizem sobre emparelhamento de elétrons?,
Resposta
Exercício de \(\PageIndex{8}\)
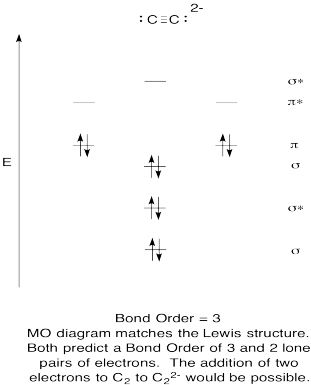
- Construir uma qualitativa diagrama de orbitais moleculares para acetylide ânions, C22-.
- Compare a ordem de ligação com a vista na estrutura de Lewis.de que outra forma é que esta imagem MO do oxigénio se compara à estrutura de Lewis? O que as duas estruturas lhe dizem sobre emparelhamento de elétrons?,com base em imagens orbitais moleculares, quão facilmente você acha que o dicarbono pode ser reduzido a acetileto (através da adição de dois elétrons)?
Resposta
Exercício de \(\PageIndex{9}\)
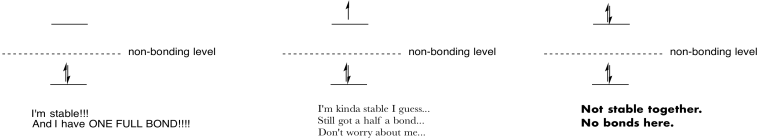
Fazer desenhos e anotações para resumir o efeito de preencher antibonding orbitais.
Resposta
Atribuição
Chris P Schaller, Ph. D.,, (Colégio de São Bento / Universidade de São João)