Richard Baxter og Jim Britton
Hvordan gjør stål korroderer i vann?
for Å forstå katodisk beskyttelse, må du først forstå hvordan korrosjon er forårsaket. For korrosjon oppstår, tre ting som må være til stede:
1. To ulike metaller
2. En elektrolytt (vann med alle typer salt eller oppløste salter i det)
3., Et metall (ledende) sti mellom ulike metaller
to ulike metaller kan være helt forskjellige legeringer, for eksempel stål og aluminium – men det er mer sannsynlig å være mikroskopisk eller makroskopiske metallurgiske forskjeller på overflaten av et enkelt stykke stål. I dette tilfellet vil vi vurdere fritt-etsing stål, som er ikke-uniform.
Hvis ovenstående betingelser er oppfylt, er følgende reaksjon finner sted på mer aktive nettsteder: (to jern ioner pluss fire frie elektroner).,
2Fe => 2Fe++ + 4e-
Den frie elektroner reise gjennom metall banen til mindre aktive områder, der følgende reaksjon foregår: (oksygen gass omdannes til oksygen ion – ved å kombinere med de fire frie elektroner – som kombinerer med vann og danner hydroksyl-ioner).
O2 + 4e- + 2H20 => 4 OH-
Recombinations av disse ionene i den aktive overflaten produsere følgende reaksjon, som gir jern-korrosjon produktet jernholdige hydroxide: (jern kombinere med oksygen og vann for å danne jernholdige hydroxide).,
2Fe + O2 + 2H2O => 2Fe (OH)2
Denne reaksjonen er vanligvis beskrevet som » strømmen gjennom vannet fra anoden (mer aktiv område) til katoden (mindre aktive nettstedet).’
Hvordan gjør katodisk beskyttelse stoppe korrosjon?
Katodisk beskyttelse hindrer korrosjon ved å konvertere alle anodic (aktiv) nettsteder på metallflate for å katodisk (passiv) nettsteder ved å levere elektrisk strøm (eller frie elektroner) fra en annen kilde.
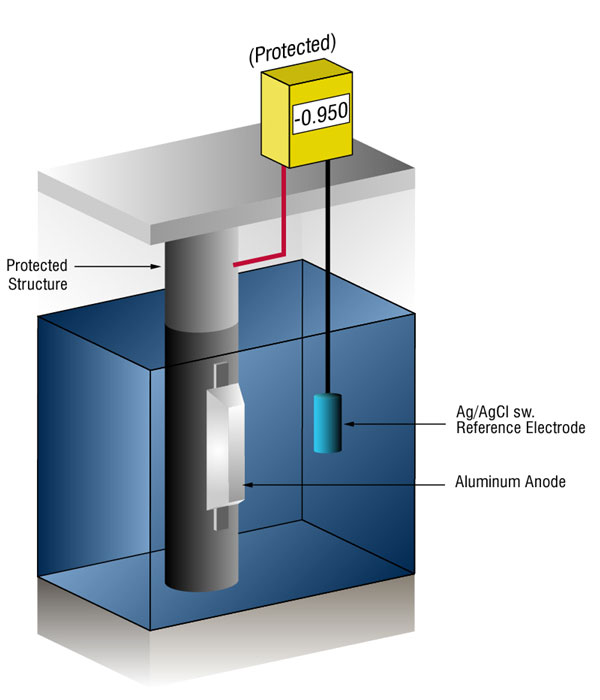
Vanligvis tar dette form av galvanic anoder, som er mer aktive enn stål., Denne praksis er også referert til som en oppofrende systemet, siden den galvaniske anoder ofre seg selv for å beskytte den strukturelle stål eller rørledning fra korrosjon.
I tilfelle av aluminium og anoder, reaksjonen på aluminium overflate er: (fire aluminium-ioner pluss tolv frie elektroner)
4Al => 4AL+++ + 12 e-
og på stål overflate: (oksygen gass omdannes til oksygen ioner som sammen med vann og danner hydroksyl-ioner).,
3O2 + 12e- + 6H20 => 12OH-
Så lenge som gjeldende (gratis elektroner) kommer til katoden (stål) raskere enn oksygen som kommer, ingen korrosjon vil oppstå.,
Grunnleggende hensyn ved utforming oppofrende anode-systemer
elektrisk strøm en anode utslipp er kontrollert av Ohms lov, som er:
jeg=E/R
I= strømmen i ampere
E= Forskjell i potensielle mellom anoden og katoden i volt
R= Sum krets motstand i ohm
Først, nåværende være høy fordi forskjellen i potensielle mellom anoden og katoden er høy, men som potensielle forskjellen reduseres på grunn av effekten av strømmen på katoden, gjeldende gradvis reduseres på grunn av polarisering av katoden., Kretsen motstand omfatter både vann-bane-og metall-banen, som inkluderer en kabel i kretsen. Den dominerende verdi her er motstanden fra anode til sjøvann.
For de fleste bruksområder, metall motstanden er så liten i forhold til vann-motstand at det kan bli ignorert (selv om dette er ikke sant for sleder eller lange rørledninger beskyttet fra begge ender). Generelt, lang, tynn anoder har lavere motstand enn korte, fett anoder. De vil utslipp mer aktuelle, men det vil ikke vare så lenge.,
Derfor, en katodisk beskyttelse designer må størrelsen anoder slik at de har den rette formen og overflaten til utslipp nok strøm til å beskytte strukturen og nok vekt til sist ønsket levetid når utlading dette gjeldende.
Som en generell tommelfingerregel:
lengden på anoden bestemmer hvor mye strøm anoden kan produsere, og dermed hvor mange kvadratmeter av stål kan være beskyttet. Tverrsnitt (vekt) avgjør hvor lenge anoden kan opprettholde dette nivået av beskyttelse.,
Imponert gjeldende katodisk beskyttelse systemer (ICCP anode-systemer)
på Grunn av den høye strømmer involvert i mange sjøvann systemer, er det ikke uvanlig å bruke imponert-nåværende systemer som bruker anoder av en type (ICCP anoder) det er ikke lett oppløselig i metalliske ioner. Dette fører til en alternativ reaksjon: den oksidering av oppløst klorid ioner.
2Cl- => Cl2 + 2e-
Strøm er levert av en ekstern DC power unit.,

Hvordan vet vi når vi har nok katodisk beskyttelse?
Vi kan bekrefte at det er nok strøm ved å måle potensialet i stål mot en standard referanse elektrode, vanligvis sølv sølv/klorid (Ag/AgCl sw.), men noen ganger sink (sw.).
strømmen på noe metall, vil skift-normal potensial i negativ retning. Historien har vist at hvis stål får nok strøm til å skifte potensial til å (-) 0.800 V v, silver / silver chloride (Ag / AgCl), the corrosion is essentially stopped.
 |
 |