studere kinetikk, kan forskerne å fastslå forholdet mellom endringer i rammebetingelser og fart av en bestemt kjemisk reaksjon. En av de viktigste faktorer som påvirker hastigheten av reaksjonen er reaktivitet av kjemikalier er involvert i den konkrete reaksjon, og Videre at det er flere variabler som kan også påvirke frekvensen av en reaksjon (konsentrasjon, temperatur, fart, osv.).
Ett av slike variabler er ansett for å være en kollisjon.,
Enhver kjemisk reaksjon krever kollisjoner mellom reaktant partikler som atomer og/eller molekyler). På den annen side, ikke alle kollisjoner fremme reaksjonen skal finne sted. I stedet, hvis den kolliderer partiklene ikke har nok kinetisk energi eller riktig retning i verdensrommet, reaksjonen ikke vil forekomme.
Men hva menes med «tilstrekkelig energi» eller «riktig retning»? For å få et bedre inntrykk av begrepene som er nevnt tidligere, artikkelen vil gi noen generelle definisjoner ledsaget av tilsvarende eksempler og prøve problemer.,
Vårt hovedmål er å definere begrepet aktivisering energi og forklare hvorfor noen av kollisjoner ikke resultere i en reaksjon.
Derfor, denne artikkelen vil først og fremst fokusere på begrepet reaktiv kollisjon. Sammen med det, vil vi kort oversikt over noen scenarioer som involverer nonreactive kollisjoner. Siden kollisjoner er forbundet med to viktige kjennetegn, energi, og romlig orientering, vil vi diskutere disse begrepene, så vel.,
Kollisjon Teori
Som vi allerede har nevnt ovenfor, kollisjoner mellom to eller flere molekyler som må skje for at en kjemisk reaksjon til å ta plass. Men kollisjon er ikke nok for reaktantene til å bli forvandlet til produkter. Molekylene må ha nok energi, og de må kollidere med riktig romlig orientering.
Som du kanskje allerede vet, det er forskjellige typer reaksjoner, inkludert syntese og nedbrytning, vekt, og forbrenning., Tatt i betraktning det faktum at kollisjon teori fokuserer på de reaksjoner som involverer kollisjoner mellom to arter, trenger du ikke å bekymre deg for mye om nedbrytning reaksjoner siden, i slike tilfeller kan en enkelt stoff er falt fra hverandre, og det er ikke nødvendig å vurdere kollisjoner eller orientering av partikler ut i rommet.
I tilfelle av reaksjoner som involverer to arter, kollisjoner mellom molekyler er avgjørende for reaksjonen til å gå videre, men bare kollisjoner mellom molekyler med tilstrekkelig kinetisk energi og relevant romlig orientering kan føre til en reaksjon., Dermed energi er nødvendig for å bryte bindinger i molekyler reagerer, mens retning av molekyler i verdensrommet spiller en viktig rolle i å stille opp riktig atomer med hverandre for å reformere brutt obligasjoner på riktig måte.
Når begge kriteriene er tilfredsstilt, kollisjon er vurdert som vellykket, effektiv, eller reaktiv kollisjon.
Vurderer betydningen av de to faktorene som er nevnt ovenfor (energi og retning), bør vi fortsette videre forklaring av begreper og konsepter for å bedre forstå prinsippene for kollisjon teori.,
Aktivering Energi
Som vi allerede har nevnt tidligere, må partiklene kolliderer med nok energi for en reaksjon oppstår. Dette minimum energien som kreves for reaksjonen til å gå videre er definert som inhibitorer.,
Som du kanskje vet, det finnes to typer reaksjoner om energi eller absorpsjon som er følgende:
- Endothermic reaksjon – energi som absorberes i en reaksjon (vanligvis i former av varme)
- Eksoterme reaksjonen – energi er utgitt i en reaksjon (vanligvis i former av varme)
Ved første øyekast, det kan virke som siden energi er utgitt i en eksoterme reaksjonen, det bør ikke være noen behov for å legge inn litt energi for reaksjonen til å skje. Tvert imot, både endothermic og eksoterme kjemiske reaksjoner krever energi for å komme i gang.,
Det virker litt merkelig, ikke sant? Hvorfor gjør en reaksjon trenger input av energi hvis energien er følgelig gitt ut?
La oss se på følgende eksempler på eksoterme reaksjoner forekommer i vår hverdag.

Eksempel #1 – Brenning av Stearinlys
brenning av stearinlys frigjør energi i form av varme, og det er derfor reaksjonen som oppstår under prosessen er eksoterme. Selvfølgelig, du trenger å tenne lys med en fyrstikk eller lighter., Hva dette betyr er at du trenger å legge inn litt energi for lys til å lyse opp. Etter at reaksjonen har nok energi til å gå videre til neste trinn, og lyset fortsetter å brenne energi.
Imidlertid et lys vil aldri brast i flammer på sin egen, ikke sant?
Eksempel #2 – Belysning en Kamp

En typisk kamp hodet er sammensatt av svovel blandet med ulike oksiderende agenter. Å tenne matchstick, bør du gni kampen hodet mot den spesielle siden av en fyrstikkeske., I løpet av denne prosessen, en reaksjon som foregår og frigjør energi i former for lys og varme. Dermed reaksjon er ansett for å være eksoterme. Selv om du fortsatt trenger å legge inn litt energi for matchstick til å begynne å brenne. Denne energi er definert via begrepet «aktivering energi.»På samme måte som i forrige eksempel, så lenge du sørger for tilstrekkelig energi for matchstick til å lyse opp, vil det fortsette å brenne og frigjør varme på sin egen.
Aktivering energi grafen viser energi endringene som skjer i løpet av en kjemisk reaksjon.,
for Å plotte aktivisering energi grafen, er det viktig å bruke to variabler:
- Antall kollisjoner mellom forskjellige molekyler
- Kinetisk energi av å kollidere molekyler
Den første variabelen er ganske lett å forstå siden det har direkte betydning – er det definerer antall kollisjoner mellom partikler av to arter per sekund.
Den andre variabelen er den kinetiske energien til å kollidere molekyler, som kan defineres som energi i bevegelse av molekyler.
- Endothermic Reaksjon – energi som absorberes., Energien av reaktantene er lavere enn den energien av produkter.
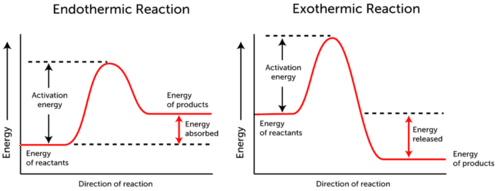
- Eksoterme Reaksjonen – energi frigjøres. Energien av reaktantene er mer enn energi i produkter.
Som du kan se i de to grafene ovenfor, aktivering energi for begge, endothermic og eksoterme reaksjoner er den samme.,
Siden endothermic reaksjon kan ikke produsere like mye energi som det er behov for å konsumere for reaksjonen til å skje, og energien blir absorbert, og derfor er energien i produktene som er høyere enn den energien av reaktantene.
tvert imot, eksoterme reaksjoner produsere mer energi enn de bruker som inhibitorer. Som et resultat, energien frigjøres, og produktene har lavere energi enn reaktantene.,
Som en konklusjon, kan det være uttalt at selv om reaktant molekyler raskt kolliderer med hverandre, er det avgjørende for molekyler for å ha nok energi for reaksjonen til å skje.
Romlig Orientering
Ifølge for å kollisjonen teori, ikke alle kollisjoner er vellykket, selv om reaktant molekyler har tilstrekkelig aktivisering energi. Molekylene må også kolliderer den rette veien rundt.
Så, det andre aspektet som påvirker reaktiv kollisjoner er ansett for å være romlig orientering (retning av molekyler i verdensrommet).,
Hva menes med «riktig» retning av molekyler i en reaksjon?
Når to molekylene kolliderer, begge molekylene må være plassert på den måten at det er lett for dem å reagere. Å fullt ut forstå konseptet, det er viktig å merke mekanismen av reaksjonen.
La oss se på reaksjonen mellom propylen (eller propen) og hydrogen bromide som et eksempel:

Som du kan se ovenfor, er reaksjonen foregår i 2 trinn.,
Trinn 1: dobbeltbindingen er brutt
Trinn 2: brom er festet
I denne reaksjonen, molekylær retningen av HBr og C3H6 spille en viktig rolle siden er en av dem var plassert i en annen måte, ville det ikke ha vært mulig for H-atom til å nærme propylen-molekylet.
Dette er sant for hver reaksjon. Hvert molekyl må ha riktig retning i verdensrommet for at reaksjonen skal finne sted. Riktig retning sikrer at molekylene ligger i den måten at det er relativt enkelt for dem å kollidere og reagere.,
Vi kan konkludere med at den gunstige retning av reaktant molekyler er like viktig som tilstrekkelig aktivisering energi.
Oppsummering
Termer og begreper som er definert gjennom hele artikkelen er oppsummert i tabellen nedenfor:
| Kollisjon Teori | Forklarer hvordan partikler bør samhandle eller med hverandre å føre til en reaksjon., I henhold til Kollisjon Teori, to kriterier må være oppfylt for en kjemisk reaksjon til å skje: Molekyler må kollidere med tilstrekkelig aktivisering energi til å bryte og re-form eksisterende obligasjoner, Molekyler må kollidere med god romlig orientering. |
| Vellykket Kollisjon (også referert til som effektive, eller reaktiv kollisjon) | En kollisjon av molekyler med tilstrekkelig aktivisering energi og riktig orientering i rommet som resulterer i en kjemisk reaksjon., |
| Aktivering Energi | Den minste energien som er nødvendig for at reaksjonene skal skje. Innspill til energi er nødvendig i tilfelle av endothermic samt eksoterme reaksjoner. |
| Endothermic Reaksjon | Energi (varme) er absorbert; energi av reaktantene er LAVERE enn den energien av produkter; Kan ikke produsere like mye energi som det forbruker i løpet av reaksjonen., |
| Eksoterme Reaksjonen | Energi (varme) er utgitt; energi av reaktantene er HØYERE enn den energien av produkter; Kan produsere mer energi enn det som forbrukes i løpet av reaksjonen. |
| Molekylær Orientering | Romlig orientering av molekyler., |
Three different scenarios are represented in the picture attached below:
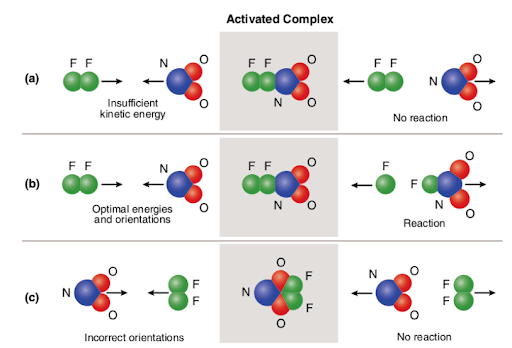
The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride.,
I tilfelle (a), reaktant molekyler har riktig romlig orientering, men som ikke har tilstrekkelig aktivisering energi, Derfor reaksjon oppstår ikke på grunn av det faktum at det er ikke nok energi til å bryte båndene. Så, kollisjon mellom to molekyler er ansett for å være nonreactive.
I tilfelle (b), den reaktant molekyler har både tilstrekkelig aktivisering energi og riktig orientering i rommet. På grunn av den optimale egenskaper til molekyler, reaksjonen fortsetter og nitrogen oxyfluoride er dannet., Så, kollisjon mellom to molekyler er ansett for å være reaktiv.
I tilfelle av (c), den reaktant molekyler har tilstrekkelig aktivisering energi, men er ikke riktig som ligger i verdensrommet, og det er Derfor reaksjonen ikke tar plass siden det ikke er mulig for molekyler til å nå en annen på måte som bryter obligasjoner. Så, på samme måte som den første tilfellet, kollisjon mellom to molekyler er ansett for å være nonreactive.