Mål
- for Å få en forståelse av kollisjon teori.
- for Å få en forståelse av de fire viktigste faktorene som påvirker reaksjonshastigheten.
Reaksjon kinetikk er studiet av hastigheten til kjemiske reaksjoner, og reaksjonen priser kan variere sterkt over et stort spekter av tidsskalaer. Noen reaksjoner kan gå videre i eksplosivt rask priser som detonasjon av fyrverkeri (Figur 17.,1 «Fyrverkeri om Natten Over Elva»), mens andre kan skje på en svak pris over mange år som rustdannelse av piggtråd eksponert for elementene (Figur 17.2 «Rustne piggtråd»).
Figur 17.1. Fyrverkeri om Natten Over Elven

Den kjemiske reaksjonen i fyrverkeri skjer på en eksplosiv pris.
Figur 17.2. Rustne piggtråd

rustdannelse av piggtråd skjer over mange år.,
Kollisjon Teori
for Å forstå kinetikk av kjemiske reaksjoner, og de faktorer som påvirker kinetikk, bør vi undersøke hva som skjer under en reaksjon på det molekylære nivå. I henhold til kollisjon teori av reaktivitet, reaksjoner oppstå når reaktant molekyler «effektivt kolliderer.»For en «effektiv kollisjon» til å skje, og det reaktant molekylene må være orientert på plass på riktig måte for å tilrettelegge for å bryte og forming av obligasjoner og omorganisering av atomer som resulterer i dannelsen av produktet molekyler (Figur 17.3 «Kollisjon Effekter»).
Figur 17.3., Kollisjon Effekter
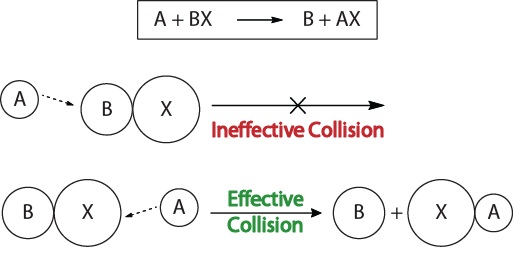
Dette visualisering viser en ineffektiv og effektiv kollisjon basert på molekylære orientering.
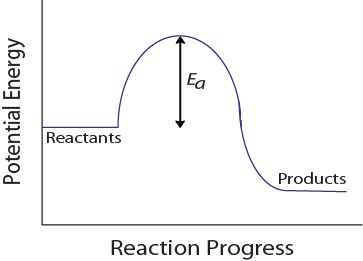
i Løpet av en molekylær kollisjon, molekyler må også ha et minimum av kinetisk energi for en effektiv kollisjon med å skje. Denne energien varierer for hver reaksjon, og er kjent som inhibitorer (Ea) (Figur 17.4 «Potensiell Energi og Aktivisering Energi»)., Frekvensen av reaksjonen avhenger derfor av aktivering energi; en høyere aktivering energi betyr at færre molekyler vil ha nok energi til å gjennomgå en effektiv kollisjon.
Figur 17.4. Potensiell Energi og Aktivisering Energi
Faktorer Som Påvirker Pris
Det er fire viktigste faktorene som kan påvirke reaksjonen hastigheten av en kjemisk reaksjon:
1. Reaktant konsentrasjon., Øke konsentrasjonen av ett eller flere reaktantene vil ofte øke hastigheten av reaksjonen. Dette skjer fordi en høyere konsentrasjon av en reaktant vil føre til flere kollisjoner som reaktant i en bestemt tidsperiode.
2. Fysisk tilstand av reaktantene og areal. Hvis reaktant molekyler finnes i forskjellige faser, som i en heterogen blanding, hastigheten av reaksjonen vil være begrenset av arealet av de ulike fasene som er i kontakt med., For eksempel, hvis en solid metall reaktant og gass reaktant er blandet, bare molekyler som finnes på overflaten av metall er i stand til å kollidere med gass molekyler. Derfor, for å øke overflaten av metall ved pounding det flatt eller skjære den i mange stykker vil øke sin reaksjon pris.
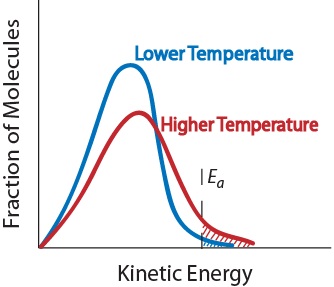
3. Temperatur. En økning i temperaturen vanligvis øker hastigheten av reaksjonen. En økning i temperatur vil øke den gjennomsnittlige kinetiske energien til den reaktant molekyler., Derfor, en større andel av molekyler vil ha minimalt med energi, som er nødvendig for en effektiv kollisjon (Figur. 17.5 «Temperatur og Reaksjon Pris»).
Figur. 17.5 Temperatur og Reaksjon Pris
4. Nærvær av en katalysator. En katalysator er et stoff som akselererer en reaksjon ved å delta i den uten å bli fortært. Katalysatorer gi en alternativ reaksjon vei til å få produkter., De er kritiske til mange biokjemiske reaksjoner. De vil bli undersøkt nærmere i avsnittet «Katalyse.»
– Tasten Takeaways
- Reaksjoner oppstå når to reaktant molekyler effektivt kolliderer, som hver har minimalt med energi, og riktig retning.
- Reaktant konsentrasjon, fysisk tilstand av reaktantene, og areal, temperatur, og nærvær av en katalysator er de fire viktigste faktorene som påvirker reaksjonshastigheten.