10.2 Brønsted-Lowry Definisjon av Syrer og Baser
Mål
- Gjenkjenne et stoff som en Brønsted-Lowry syre eller en Brønsted-Lowry base.
- Illustrere proton overføre prosessen som definerer en Brønsted-Lowry syre-base-reaksjon.
Ammoniakk (NH3) øker hydroxide ion-konsentrasjon i vandig løsning ved å reagere med vann i stedet for å slippe hydroksidioner direkte., Faktisk, Arrhenius definisjoner av en syre og en base fokus på hydrogen ioner og hydroksidioner. Er det mer grunnleggende definisjoner for syrer og baser?
I 1923, den danske vitenskapsmannen Johannes Brønsted og den engelske forskeren Thomas Lowry uavhengig foreslåtte nye definisjoner for syrer og baser. Snarere enn å vurdere både hydrogen og hydroksidioner, de fokusert på hydrogen ion. En Brønsted-Lowry acidA stoff som leverer et hydrogen-ion (H+) i en reaksjon, en proton donor. er et stoff som leverer et hydrogen ion i en reaksjon., En Brønsted-Lowry baseA stoff som aksepterer en hydrogen-ion (H+) i en reaksjon, en proton godkjenner. omvendt , er et stoff som aksepterer en hydrogen ion i en reaksjon. Dermed Brønsted-Lowry definisjoner av en syre og en base fokus på overføring av hydrogen ioner i en reaksjon, snarere enn på produksjon av hydrogen ioner og hydroksidioner i en vandig løsning.
La oss bruke den reaksjonen av ammoniakk i vann for å demonstrere Brønsted-Lowry definisjoner av en syre og en base., Ammoniakk og vann-molekylene er reaktantene, mens ammonium-ion og hydroxide ion er produkter:
NH3(aq) + H2O(står) → NH4+(aq) + OH−(aq)
Hva som har skjedd i denne reaksjonen er at den opprinnelige vann molekylet har donert en hydrogen-ion-til den opprinnelige ammoniakk molekyl, som i sin tur har akseptert hydrogen ion. Vi kan illustrere dette slik:
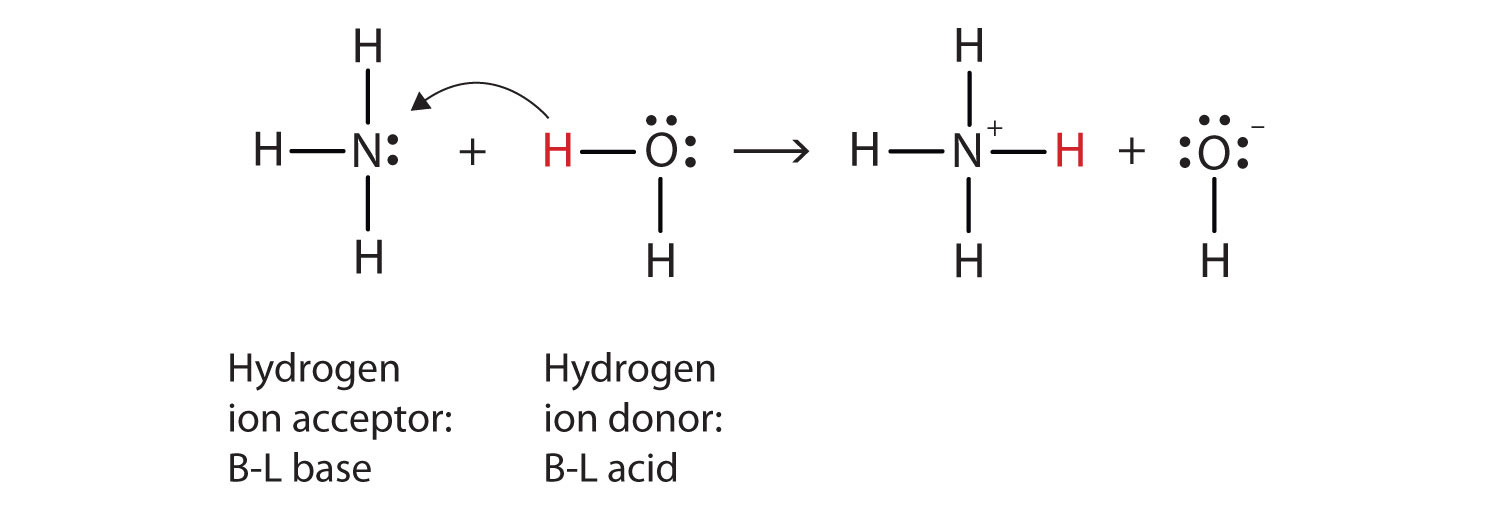
Fordi vann molekylet donerer en hydrogen-ion-til ammoniakk, det er Brønsted-Lowry syre, mens ammoniakk molekyl—som aksepterer hydrogen ion—er Brønsted-Lowry base., Dermed, ammoniakk fungerer som en base i både Arrhenius forstand og Brønsted-Lowry forstand.
Er en Arrhenius syre som saltsyre fortsatt en syre i Brønsted-Lowry forstand? Ja, men det krever oss til å forstå hva som egentlig skjer når HCl er oppløst i vann. Husker at hydrogen atom er et enkelt proton omgitt av et enkelt elektron. For å gjøre hydrogen ion, fjerner vi elektron, og etterlater en naken proton. Trenger vi egentlig har åtte protoner flyter rundt i vandig løsning? Nei, vi gjør ikke det., Det som virkelig skjer er at H+ – ion fester seg til H2O for å gjøre H3O+, som er kalt hydronium ion. For de fleste formål, H+ og H3O+ representere de samme artene, men å skrive H3O+ i stedet for H+ viser at vi forstår at det ikke er noen åtte protoner flyter rundt i løsningen. Snarere, disse protoner er faktisk festet til løsemiddel-molekyler.
Obs!
Et proton i vandig løsning kan være omgitt av mer enn ett molekyl vann, som fører til formler som H5O2+ eller H9O4+ snarere enn H3O+. Det er enklere, men for å bruke H3O+.,
Med dette i bakhodet, hvordan definerer vi HCl som en syre i Brønsted-Lowry forstand? Tenk hva som skjer når HCl er oppløst i H2O:
HCl + H2O(står) → H3O+(aq) + Cl−(aq)
Vi kan skildre denne prosessen ved hjelp av Lewis electron dot diagrammer:
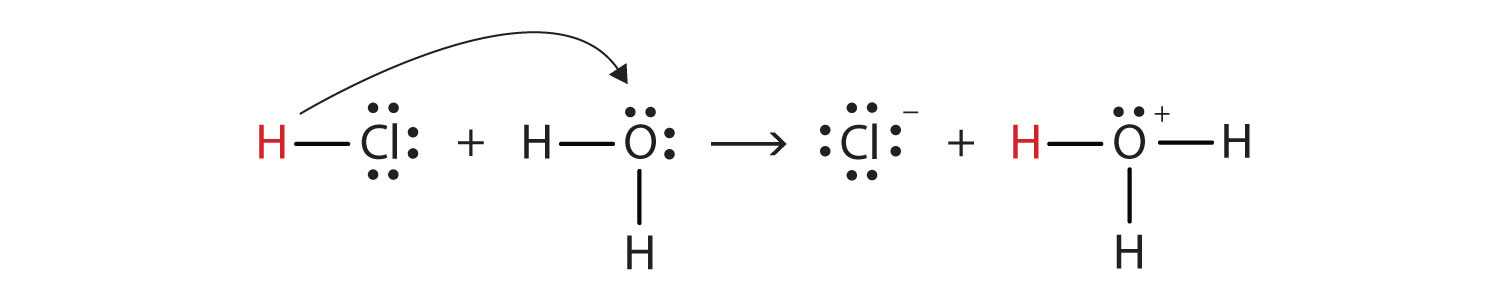
Nå ser vi at en hydrogen ion er overført fra HCl molekyl til H2O-molekylene å gjøre klorid ioner og hydronium ioner. Som hydrogen ion donor, HCl fungerer som en Brønsted-Lowry syre, som en hydrogen-ion-akseptor, H2O er en Brønsted-Lowry base., Så HCl er en syre, ikke bare i Arrhenius forstand, men også i Brønsted-Lowry forstand. Videre, ved Brønsted-Lowry definisjoner, H2O er en base i dannelsen av vandige HCl. Så Brønsted-Lowry definisjoner av en syre og en base klassifisere oppløsning av HCl i vann, som en reaksjon mellom en syre og en base—selv om den Arrhenius definisjon ikke ville ha merket H2O en base i denne anledning.
Obs!
Alle Arrhenius syrer og baser er Brønsted-Lowry syrer og baser som godt. Men ikke alle Brønsted-Lowry syrer og baser er Arrhenius syrer og baser.,
Eksempel 3
Anilinfarget (C6H5NH2) er litt løselig i vann. Det har et nitrogen atom som kan akseptere en hydrogen-ion-fra et vann-molekylet som nitrogen atom i ammoniakk gjør. Skriv den kjemiske likningen for denne reaksjonen og identifisere Brønsted-Lowry syre og base.
Løsningen
C6H5NH2 og H2O er reaktantene. Når C6H5NH2 aksepterer en proton fra H2O, det får en ekstra H og en positiv ladning, og etterlater en OH− ion bak., Reaksjonen er som følger:
C6H5NH2(aq) + H2O(står) → C6H5NH3+(aq) + OH−(aq)
Fordi C6H5NH2 aksepterer et proton, det er Brønsted-Lowry base. H2O-molekylene, fordi det sender et proton, er Brønsted-Lowry syre.
Ferdighet-Bygningen Øvelse
-
Koffein (C8H10N4O2) er et stimulerende middel som finnes i kaffe og te. Når det løses i vann, det kan akseptere et proton fra et molekyl vann. Skriv den kjemiske likningen for denne prosessen og identifisere Brønsted-Lowry syre og base.,
Brønsted-Lowry definisjoner av en syre og en base kan brukes til kjemiske reaksjoner som skjer i løsemidler annet enn vann. Følgende eksempel illustrerer.
Eksempel 4
Sodium amide (NaNH2) løses i metanol (CH3OH) og deler inn natrium ioner og amide ioner (NH2−). Den amide ioner reagerer med metanol å lage ammoniakk og methoxide ion (CH3O−). Skriv en balansert kjemisk likning for denne prosessen, og identifisere Brønsted-Lowry syre og base.,
Løsningen
likningen for reaksjonen mellom NH2− og CH3OH å gjøre NH3 og CH3O− er som følger:
NH2−(solv) + CH3OH(står) → NH3(solv) + CH3O−(solv)
etiketten (solv) angir at arten er oppløst i noen løsemiddel, i motsetning til (aq), som angir en vandig (H2O) løsning. I denne reaksjonen, ser vi at NH2− ion aksepterer en proton fra en CH3OH molekylet for å gjøre en NH3-molekylet. Således, som kalles proton akseptor, NH2− er Brønsted-Lowry base. Som proton donor, CH3OH er Brønsted-Lowry syre.,
Ferdighet-Bygningen Øvelse
-
Pyridinium klorid (C5H5NHCl) oppløses i etanol (C2H5OH) og deler inn i pyridinium ioner (C5H5NH+) og klorid-ioner. Den pyridinium ion kan overføre en hydrogen-ion-til et løsemiddel-molekylet. Skriv en balansert kjemisk likning for denne prosessen, og identifisere Brønsted-Lowry syre og base.
For Helsen Din: Brønsted-Lowry Syre-Base-Reaksjoner i Pharmaceuticals
Det er mange interessante anvendelser av Brønsted-Lowry syre-base-reaksjoner i den farmasøytiske industrien., For eksempel, narkotika ofte trenger å være vannløselig for maksimal effektivitet. Imidlertid, mange komplekse organiske forbindelser er ikke løselig eller er bare litt løselig i vann. Heldigvis, de legemidler som inneholder proton-aksepterer nitrogen atomer (og det er mange av dem) kan være reagerte med fortynnet saltsyre . Nitrogen atomer—de fungerer som Brønsted-Lowry baser—godta hydrogen ioner fra syre for å gjøre en ion, som er vanligvis mye mer løselig i vann., Den modifiserte bedøve molekyler kan da bli isolert som klorid salter:
RN(sl aq) + H+(aq) → RNH+(aq) →Cl−(aq) RNHCl(s)
hvor RN representerer noen organisk stoff som inneholder nitrogen. Etiketten (sl aq) betyr «litt vandig,» som indikerer at forbindelsen RN er bare litt løselig. Legemidler som er endret på denne måten, kalles hydrochloride salter. Eksempler inkluderer kraftige smertestillende kodein, som er vanligvis gis som kodein hydrochloride. Syrer annet enn hydrochloric acid er også brukt. Hydrobromic syre, for eksempel, gir hydrobromide salter., Dekstrometorfan, en ingrediens i mange hoste medisiner, er avviklet som dekstrometorfan hydrobromide. De etterfølgende figur viser en annen medisiner som en hydrochloride salt.
Det navn av denne medisinen gjør det klart at det ikke eksisterer som hydrochloride salt.
© Thinkstock
Konsept Øvelse
-
Gi definisjoner av en Brønsted-Lowry syre og en Brønsted-Lowry base.,
Svar
-
en Brønsted-Lowry syre er en proton donor, mens en Brønsted-Lowry base er et proton godkjenner.
– Tasten Takeaways
- en Brønsted-Lowry syre er en proton donor, og en Brønsted-Lowry base er et proton godkjenner.
- Brønsted-Lowry syre-base-reaksjoner er i hovedsak proton overføre reaksjoner.
Øvelser
-
merk hver reaktiv som en Brønsted-Lowry syre eller en Brønsted-Lowry base.,
HCl (aq) + NH3(AQ) → NH4 + (AQ) + Cl−(AQ)
-
merk hver reaktiv som en Brønsted-Lowry syre eller en Brønsted-Lowry base.
H2O(står)+N2H4(AQ) → N2H5 + (aq) + OH−(AQ)
-
Forklare hvorfor en Brønsted-Lowry syre kan kalles en proton donor.
-
Forklare hvorfor en Brønsted-Lowry base kan kalles en proton godkjenner.
-
Skriv den kjemiske likningen for reaksjonen av ammoniakk i vann og etikett Brønsted-Lowry syre og base.,
-
Skriv den kjemiske likningen for reaksjonen av methylamine (CH3NH2) i vann og etikett Brønsted-Lowry syre og base.
-
Demonstrere at oppløsningen av HNO3 i vann er faktisk en Brønsted-Lowry syre-base-reaksjon ved å beskrive det med en kjemisk ligning og merking Brønsted-Lowry syre og base.,
-
Identifisere Brønsted-Lowry syre og base i følgende kjemiske ligningen:
C3H7NH2(aq) + H3O+(aq) → C3H7NH3+(aq) + H2O(står)
-
Skriv den kjemiske likningen for reaksjonen som oppstår når kokainhydroklorid (C17H22ClNO4) oppløses i vann og donerer et proton til et molekyl vann. (Når hydrochlorides løses opp i vann, de skille i klorid-ioner og riktig kasjon.)
-
Hvis kodein hydrobromide har formelen C18H22BrNO3, hva er formelen for den overordnede sammensatte kodein?,