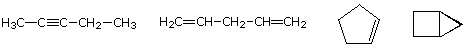Innledning
mellom hx og alkener og alkynes er hydrokarboner, som henholdsvis har karbon-karbon dobbeltbindingen og karbon-karbon trippel bond funksjonelle grupper. Den molekylære formler av disse umettede hydrokarboner gjenspeile flere bånd til den funksjonelle grupper:
mellom hx og alkener er navngitt som om de var alkaner, men «-ane» endelsen er endret til «-ene»., Hvis alken bare inneholder en dobbel binding, og at dobbeltbindingen er terminal (dobbeltbindingen er i den ene enden av molekylet eller en annen) så det er ikke nødvendig å plassere et tall foran navnet.,
butan: C4H10 (CH3CH2CH2CH3)
butene: C4H8 (CH2=CHCH2CH3)
Hvis dobbeltbindingen er ikke terminal (hvis det er på et karbon-et sted i midten av kjeden) deretter karbonatomer skal være nummerert på en slik måte som å gi den første av de to dobbel-bundne karbonatomer lavest mulig nummer, og dette nummeret skal gå forut for den «ene» suffiks med en strek, som vist nedenfor.,
korrekt: pent-2-ene (CH3CH=CHCH2CH3)
feil: pent-3-ene (CH3CH2CH=CHCH3)
Den andre er feil fordi flipping formelen horisontalt resulterer i et lavere antall for alken.
Hvis det er mer enn én dobbeltbindingen i et alken, alle obligasjonene skal være nummerert i navnet på molekyl – selv terminal doble obligasjoner. Tallene skal gå fra lavest til høyest, og være atskilt fra hverandre med et komma. Den IUPAC numeriske prefikser brukes til å indikere antall dobbeltbindinger.,
octa-2,4-dien: CH3CH=CHCH=CHCH2CH2CH3
deca-1,5-dien: CH2=CHCH2CH2CH=CHCH2CH2CH2CH3
Merk at nummereringen av «2-4» ovenfor gir et molekyl med to doble obligasjoner atskilt med bare en enkelt obligasjon. Dobbeltbindinger i en slik tilstand kalles «conjugated», og de representerer en forbedret stabilitet av konformasjon, slik at de er energisk favorisert som utgangsstoff i mange situasjoner og kombinasjoner.,
| Alkane | CnH2n+2 | Dette er den maksimale H/C-forhold for et gitt antall karbonatomer. |
|---|---|---|
| Alken | CnH2n | Hver dobbeltbindingen reduserer antall hydrogenatomer av 2. |
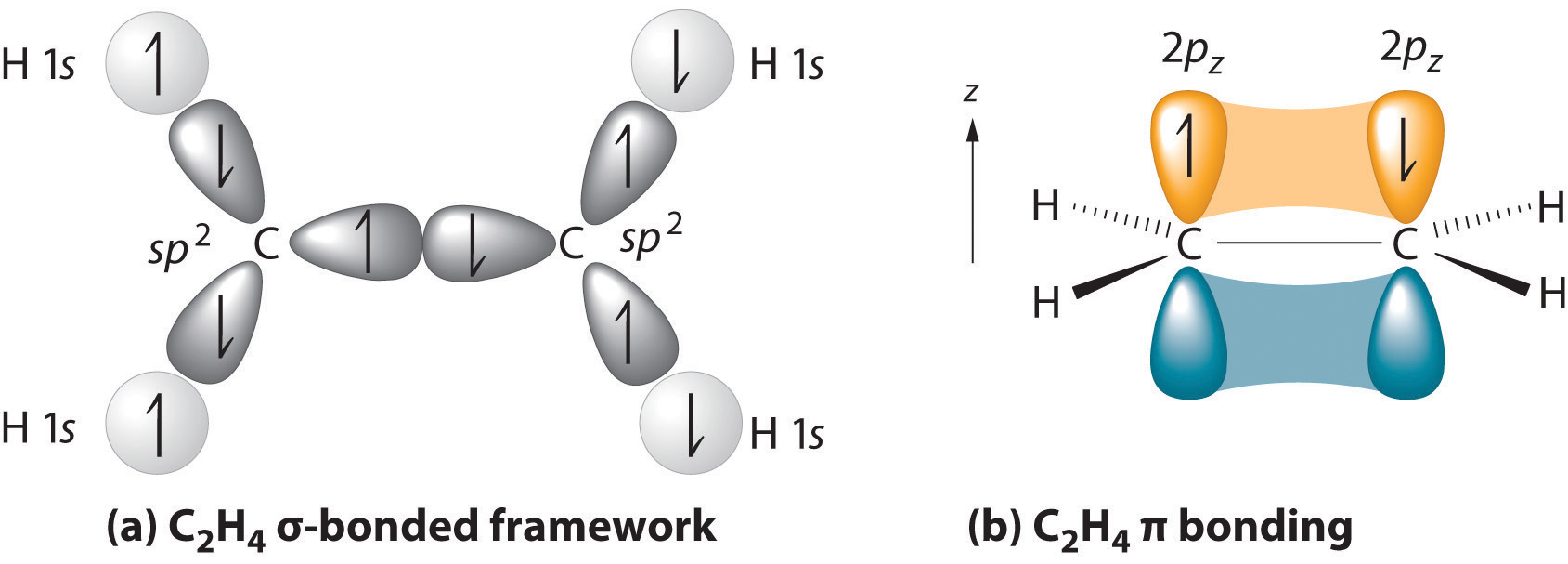
Den overordnede strukturen er den lengste kjeden som inneholder både karbon atomer av dobbeltbindingen., De to karbon-atomer av en dobbel binding og de fire atomer som er knyttet til dem ligge i et plan, med bond vinkler på ca 120° En dobbel binding består av en sigma bond dannet av overlapping av sp2 hybrid orbitals og en pi bond dannet av overlapping av parallell-2 p-orbitals
molekylær formel av en hydrokarbon-gir informasjon om mulige strukturelle typer kan det representerer. For eksempel, tenk forbindelse med formel C5H8., Formelen for fem-karbon alkane pentan er C5H12 så forskjellen i hydrogen innhold er 4. Denne forskjellen antyder at slike stoffer kan ha en trippel bond, to doble obligasjoner, en ring pluss en dobbel binding, eller to ringesignaler. Noen eksempler er vist her, og det er minst fjorten andre!