Så langt har vi sett på måter som par atomic orbitals kan kombineres for å danne molekylær orbitals — å danne obligasjoner. Akkurat som vi tror det er en progresjon av atom-orbitals fra lavest energi til å høyeste (1s, 2s, 2p, 3s…vi kan organisere disse molekylære orbitals ved bestilling av sin energi.
Til en stor grad, for molekylær orbitals i energi kan anses å følge av de bestilling av atom-orbitals som de er konstruert., Det er noen avvik fra denne regelen, noen ganger, men det er den enkleste stedet å starte. Så, i et molekyl, lavest energi molekylær orbitals ville være de som er dannet av den laveste strømforbruk atom-orbitals, 1s orbitals.
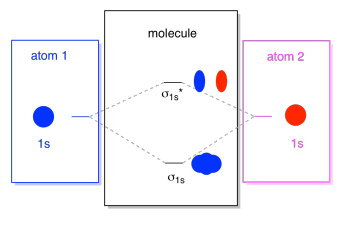
Det vi ser her er en molecular orbital interaction diagram. Midten av diagrammet er bare molecular orbital energi diagrammet. Det er analogt til atomic orbital energi diagram (som går 1s, 2s, 2p, 3s…). Rekkefølgen av energi så langt er σ1s, σ1s*., Sidene av diagrammet bare se tilbake til der de molekylære orbitals kom fra, med stiplede linjer til å veilede deg fra ett sted til et annet. Helt, bildet sier at 1s orbital på en atom-og 1s orbital på den annen atom kan kombinere to forskjellige måter å produsere med lavere energi, bonding σ1s og høyere energi, antibonding σ1s*.
Merk at vi ikke har lagt til noen elektroner til at molecular orbital energi diagram ennå, men når vi gjør det, vil vi bare fyll dem på fra bunnen og opp, akkurat som vi ville en atom-orbital energi diagrammet.,
Den nest laveste sett av atomic orbitals er det 2s nivå. Disse sfærisk orbitals ville kombinere veldig mye som 1s orbitals, og vi ville få en lignende diagram, bare på et litt høyere energi nivå.
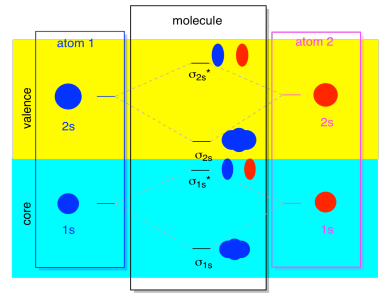
de Fleste av tiden, kommer vi ikke til å se både σ1s og σ2s som vises i diagrammet. Det er fordi hvis det er noen 2s elektroner, så de 1s elektroner er virkelig core elektroner, ikke valence. De er begravet litt dypere i et atom, og de trenger ikke spille en svært viktig rolle i binding., Ignorerer core elektroner er ganske vanlig, hvis du husker, i atomic electron konfigurasjoner vi kan skrive 2s22p4 i stedet for 1s22s22p4 for oksygen; vi var ignorerer kjernen. Når vi trakk Lewis strukturer, vi ga oksygen seks elektroner, snarere enn åtte; vi var ignorerer kjernen.
I forbindelse med MO, la oss anta at vi har 2 elektroner. Det må bety at hvert atom har to 1-ere elektroner av sine egne, for totalt fire. Når de fire elektroner er fylt til MO-diagrammet fra bunnen og opp, de vil oppta både bonding σ1s og antibonding σ1s*., Effekten av begge disse kombinasjonene blir okkupert er å utjevne bonding; de to par av elektroner forbli ikke-binding. Slik at vi kan ignorere dem, og vi er egentlig ikke mangler noe.
2s orbitals er ikke de eneste som i andre shell. Det er også 2p orbitals. Husk, det er et par av svært ulike måter i som p-orbitals kan kombinere med hverandre, avhengig av hvilken akse de ligger. Hvis de ikke ligger parallelt til hverandre — det vil si, hvis de er vinkelrett på hverandre, slik som en px og py-så de kan samhandle med hverandre i det hele tatt., Den pz på ett atom kunne samhandle med pz på den annen atom, imidlertid, fordi de er parallelle til hverandre.
Vanligvis, vi definerer z-aksen som lå langs linjen mellom to atomer vi ser på. To pz orbitals ville ligge langs den aksen, hver med en lapp som strekker seg inn i rommet mellom atomene, og hver med en annen lapp som strekker seg unna, i den andre retningen
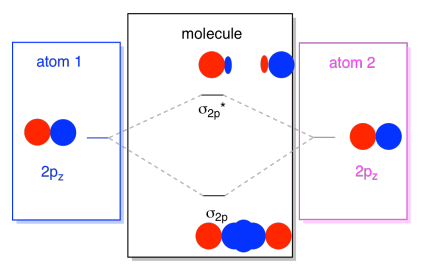
Den resulterende kombinasjoner kalles σ fordi de må ligge langs aksen mellom atomer (som er nøyaktig hva σ betyr, i form av binding)., Det er en σ kombinasjon, hvis overlappende lobes er i fase med hverandre, og σ* kombinasjon, hvis de kammene er ute av fase med hverandre. Fordi disse nye orbitals fremkomme fra atomic 2p orbitals, vi kaller dem σ2p og σ2p*.
Det er også de som p-orbitals som ikke ligger langs bond-aksen, eller i aksen mellom de to atomene. Px orbitals er vinkelrett på pz orbitals vi bare så på, og derfor vinkelrett på aksen mellom båndene. Men de er fortsatt parallelle til hverandre, og de kan fortsatt skjemaet vinnerkombinasjoner., Disse to orbitals ville danne en i-fase-kombinasjon og en ut-av-fase kombinasjon.
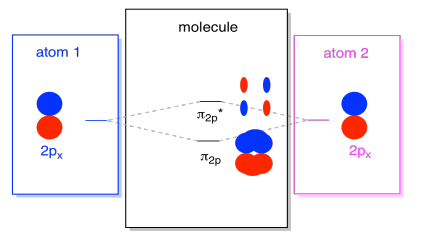
Merk at energisk skille mellom disse to kombinasjonene er litt mindre at gapet mellom σ2p og σ2p* nivåer. Forskjellen er relatert til graden av overlapp mellom atomic orbitals. På aksen orbitals prosjekt sterkt på samme plass, de overlapper hverandre mye, og de kommuniserer på det sterkeste. Off-axis orbitals pensel mot hverandre, i samspill mindre sterkt, og som resulterer i mindre energisk endringer., Gapet mellom n2p orbital og n2p* orbital er derfor mye mindre enn den mellom σ2p og σ2p* orbitals.
Det er faktisk to av de off-aksen p-orbitals. I tillegg til px sett, vi ville ha en py sett. Hvis px satt i flyet av skjermen, py sett har en orbital som stikker ut foran og en skjult bak. Likevel, kombinasjoner mellom de to py orbitals er nøyaktig det samme som det vi så mellom de to px orbitals. De er bare rotert i en vinkelrett plan med hensyn til px kombinasjoner.,
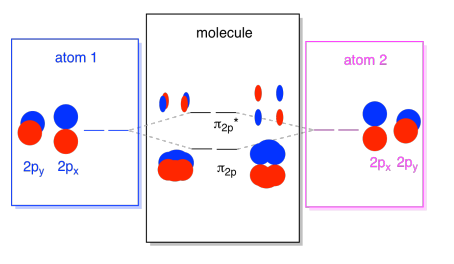
Vi kan sette alle av dem 2p-basert orbitals sammen i ett diagram. Det begynner å bli litt mer folksomt, men dette diagrammet er bare en kombinasjon av stykkene vi har allerede sett. Vær oppmerksom på at px, py, og pz atomic orbitals alle starter på samme energi (vi har stablet dem her slik at du kan fremdeles se sammenhengen mellom den atomære og molekylære orbitals). Det betyr at n2p & n2p* orbitals vil være «nestet» mellom σ2p & σ2p* orbitals.,
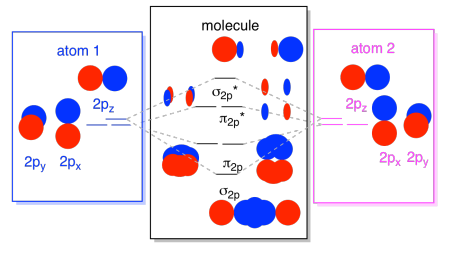
til Slutt, husk at 2p orbitals er høyere energi enn 2s orbitals, vi kan kombinere disse bildene inn i et diagram. Igjen, vi har sett disse individuelle stykker før; vi er bare montere dem nå.
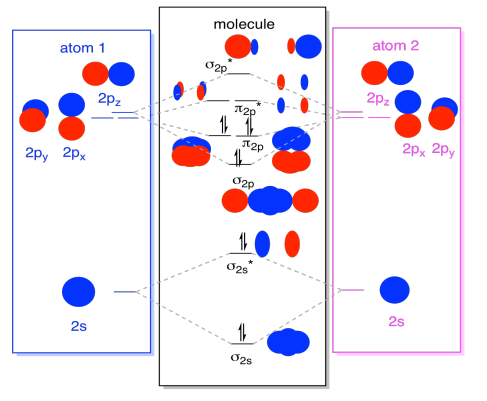
Mens vi er inne på det, kan vi kan legge til på elektroner. Hvordan? Det er bare det totale antall av valence elektroner. For et eksempel, vi har brukt N2., Hver nitrogen har fem valence elektroner, for en sum av ti, så vi har nettopp fylt i ti elektroner, som starter på bunnen av molecular orbital energi nivå diagrammet. Hvis dette var et annet molekyl, for eksempel F2 eller O2, vi ville konstruere den samlede diagram på en lignende måte, men bare bruke et annet antall elektroner.
orbital bildet vi har beskrevet over er egentlig bare en mulig bilde av den elektroniske struktur av dinitrogen (og alle andre store gruppen eller s-blokk diatomic)., Vi vil ikke få et reelt bilde av dinitrogen strukturen til vi fylle disse mulige nivåer med elektroner.
- Bare energi nivåer med elektroner har en effekt på energi (og atferd) av molekylet.
med andre ord, energien til elektronene bestemmer oppførselen til molekylet. Den andre energi-nivåer er bare muligheter som fortsatt være oppfylt.
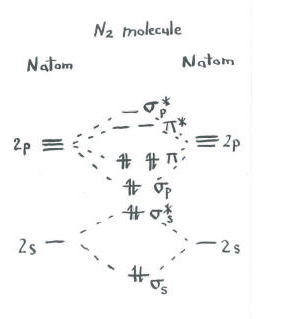
Tenk om bildet av dinitrogen.
- Hver nitrogen har fem valence elektroner.
- Det er totalt ti elektroner.,
- To hvert gå inn i s s bonding og s* antibonding nivåer. Husk, vi holdt disse atskilt fra p angitt som en forenkling.
- To hvert gå inn i s s bonding og hver av p bonding nivåer.
De resterende orbitals (s s* antibonding og hver av p * antibonding nivåer) er ledig. Disse er tenkt nivåer som ikke spiller en rolle i å bestemme energien dinitrogen. I en ekte molecular orbital beregning, elektroner i disse nivåene vil bidra til den samlede energi av molekylet.,
Vi få ytterligere informasjon fra bildet. Vi kan For eksempel se bond orden i dinitrogen.
- Bond ordre er bare antall obligasjoner mellom et par av atomer.
- bond order er en av flere faktorer som påvirker styrken av covalent bond.
- høyere bond order, jo flere elektroner deles mellom atomene, og sterkere bånd.
I dinitrogen, s s bonding s s* antibonding nivåer kansellerer hverandre ut. Ett par er lavere energi enn det var i atomet, men den andre er høyere., Det er ingen netto reduksjon av energi. Disse elektronene ikke bidrar til en nitrogen-nitrogen bond. Disse er ikke-bonding electron par.
seks elektroner i s s bonding og p-bonding nivåer, men representerer en nedgang i energi fra energi-nivåer i den frie nitrogen atomer. Disse tre, lav-energi par av elektroner angi tre bånd mellom nitrogen atomer.
Husk, vi har laget noen kort-kutt i dette bildet, og en ekte molecular orbital beregning kan gi litt ulike resultater., Likevel, det ville fortsatt avsløre en obligasjon for tre, samt to ikke-bonding electron par.
I tillegg, noen ganger molecular orbital bilder vises på forskjellige måter. En molecular orbital samhandling diagrammet viser hvordan atom eller molekyl orbitals kombinere sammen for å gjøre nye orbitals. Noen ganger, kan vi være interessert i bare molecular orbital energi nivåer seg selv, og ikke hvor de kom fra. En molecular orbital energi nivå diagrammet viser bare energi nivåer i molekylet., Ofte, men ikke alltid, energi nivå diagrammer er vist uten noen bilder av orbitals, for å sette fokus på energi nivåer, som på en grunnleggende måte er den viktigste delen av bildet. Videre, bare fordi de okkuperte energi nivåer faktisk bidra til energi av molekylet, noen ganger med høyere energi, ledig orbitals er igjen ute av bildet.

Veldig ofte resultatene av molecular orbital beregninger forsterke det vi ville forutsi fra Lewis strukturer., Hvis du tegner et Lewis struktur av dinitrogen, vil du også forutsi en trippel nitrogen-nitrogen bond. Daglig nytte av molecular orbital teori er at det gir kvantitativ prediksjon av energi når vi gjør en reell beregning på en datamaskin. I tillegg er det viktig å innse at det er ingen reell grunn for oktetten regel mindre vi vurdere kvantemekanikk. Lewis strukturer er grunnlagt på en empirisk observasjon at elektroner danne par og oktettene, uten å forsøke å forklare hvorfor., Molecular orbital teorien tar litt grunnleggende relasjoner fra fysikk og bruker dem til svært kompliserte molekyler med veldig god suksess. Bare ved å vite antall elektroner i molekylet, og ved å vite omtrent hvor kjernene er plassert i strukturen, molecular orbital beregninger gi svært nyttig informasjon om energi. I tillegg, i mer kompliserte tilfeller enn N2, disse beregningene kan selv korrigere våre første gjett om molekylære geometri og der obligasjonene er plassert.,
Trening \(\PageIndex{2}\)
En Molecular Orbital-Diagram for en diatomic molekyl (to atomer) varierer i antall elektroner. Hvordan kan du fylle ut elektroner?
Svar
• Telle valence elektroner på molekylet. Det er antallet av valence elektroner på hvert atom, justert for avgift på molekylet. (f.eks C22 – har 10 valence elektroner: 4 fra hver karbon-det er 8 — og to for 2 – avgift).
• Fyll elektroner i det lavest energi orbitals første.
• Par elektroner etter alle orbitals på samme energi nivået har ett elektron.,
Trening \(\PageIndex{3}\)
Konstruere en kvalitativ molecular orbital-diagram for klor, Cl2. Sammenlign bond for den som ses i Lewis-struktur (husk at et elektron i en antibonding orbital avbryter stabilisering på grunn av binding av et elektron i en bonding orbital).
Svar 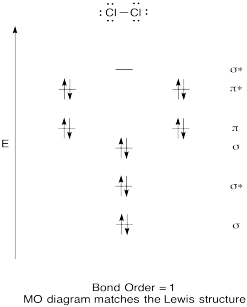
Trening \(\PageIndex{4}\)
- Konstruere en kvalitativ molecular orbital-diagram for oksygen, O2.
- Sammenligne bond for den som ses i Lewis struktur.,
- Hvordan andre gjør dette MO bilde av oksygen i forhold til Lewis-strukturen? Hva gjør de to strukturene fortelle deg om electron sammenkobling?
- Forbindelser som har alle sine elektroner sammenkoblede kalles diamagnetiske. De med kort uten par elektroner kalles paramagnetiske. Paramagnetiske materialer er tiltrukket av et magnetisk felt, men diamagnetiske er ikke ting. Hvordan ville du forvente molekylær oksygen til å oppføre seg?,
Svar
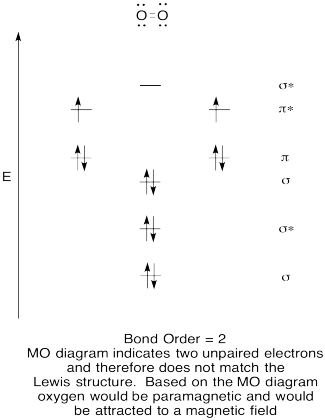
Trening \(\PageIndex{5}\)
- Konstruere en kvalitativ molecular orbital-diagram for peroxide anion, O22-.
- Sammenligne bond for den som ses i Lewis struktur.
- Hvordan andre gjør dette MO bilde av oksygen i forhold til Lewis-strukturen? Hva gjør de to strukturene fortelle deg om electron sammenkobling?,
- Basert på molecular orbital bilder, hvor lett tror du dioxygen kan bli redusert til peroxide (gjennom tillegg av to elektroner)?
Svar
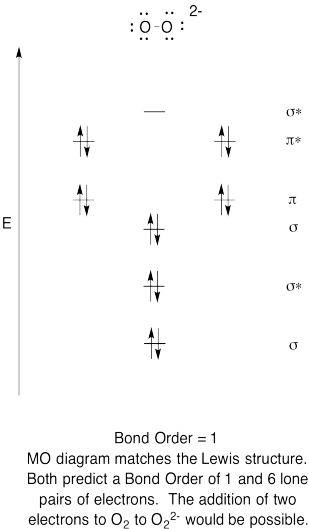
Trening \(\PageIndex{6}\)
Konstruere en kvalitativ molecular orbital-diagram for diboron, B2. Tror du boron-boron obligasjoner kunne danne enkelt, basert på dette bildet?,
Svar
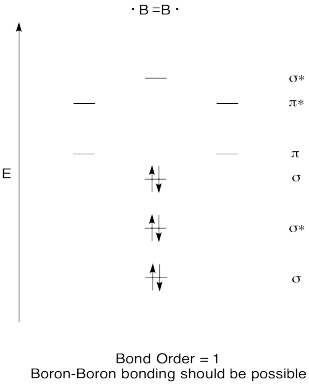
Trening \(\PageIndex{7}\)
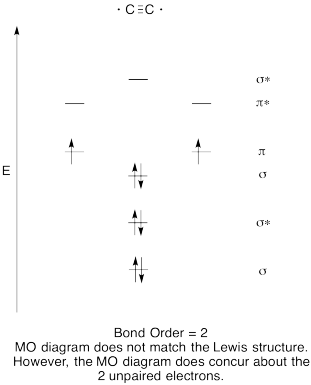
- Konstruere en kvalitativ molecular orbital-diagram for dicarbon, C2.
- Sammenligne bond for den som ses i Lewis struktur.
- Hvordan andre gjør dette MO bilde av oksygen i forhold til Lewis-strukturen? Hva gjør de to strukturene fortelle deg om electron sammenkobling?,
Svar
Trening \(\PageIndex{8}\)
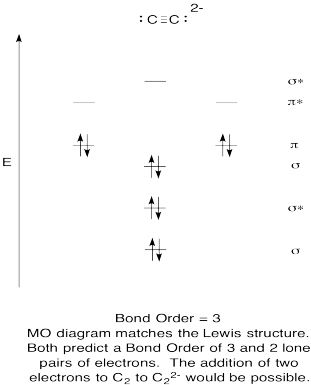
- Konstruere en kvalitativ molecular orbital-diagram for acetylide anion, C22-.
- Sammenligne bond for den som ses i Lewis struktur.
- Hvordan andre gjør dette MO bilde av oksygen i forhold til Lewis-strukturen? Hva gjør de to strukturene fortelle deg om electron sammenkobling?,
- Basert på molecular orbital bilder, hvor lett tror du dicarbon kan bli redusert til acetylide (gjennom tillegg av to elektroner)?
Svar
Trening \(\PageIndex{9}\)
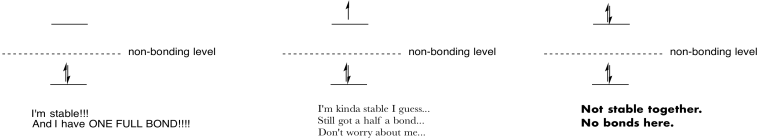
Lag tegninger og notater for å oppsummere effekten av å fylle antibonding orbitals.
Svar
Navngivelse
Chris P Schaller, Ph. D.,, (College of Saint Benedict / Saint John ‘ s University (universitet)