Das Studium der Kinetik ermöglicht es Wissenschaftlern, die Beziehung zwischen den Änderungen der Bedingungen und der Geschwindigkeit einer bestimmten chemischen Reaktion zu bestimmen. Einer der wichtigsten Faktoren, die die Reaktionsgeschwindigkeit beeinflussen, ist die Reaktivität von Chemikalien, die an dieser spezifischen Reaktion beteiligt sind; Darüber hinaus gibt es mehrere Variablen, die auch die Reaktionsgeschwindigkeit beeinflussen können (Konzentration, Temperatur, Katalysator usw.).).
Eine dieser Variablen wird als Kollision betrachtet.,
Jede chemische Reaktion erfordert Kollisionen zwischen den Reaktantenteilchen (Atomen und/oder Molekülen). Andererseits fördern nicht alle Kollisionen die Reaktion. Stattdessen, wenn die kollidierenden Teilchen nicht genügend kinetische Energie oder richtige Orientierung im Raum haben, wird die Reaktion nicht auftreten.
Aber was ist mit „ausreichend Energie“ oder „richtige Orientierung“ gemeint? Um eine bessere Vorstellung von den zuvor genannten Konzepten zu erhalten, enthält der Artikel einige allgemeine Definitionen, die von entsprechenden Beispielen und Beispielproblemen begleitet werden.,
Unser Hauptziel ist es, das Konzept der Aktivierungsenergie zu definieren und zu erklären, warum einige der Kollisionen nicht zu einer Reaktion führen.
Dementsprechend konzentriert sich dieser Artikel in erster Linie auf das Konzept der reaktiven Kollision. Gleichzeitig werden wir einige Szenarien mit nicht reaktiven Kollisionen kurz vorstellen. Da Kollisionen mit zwei Hauptmerkmalen verbunden sind, Energie und räumliche Orientierung, werden wir auch diese Begriffe diskutieren.,
Kollisionstheorie
Wie bereits oben erwähnt, müssen Kollisionen zwischen zwei oder mehr Molekülen auftreten, damit eine chemische Reaktion stattfinden kann. Es reicht jedoch nicht aus, die Reaktanten in Produkte umzuwandeln. Moleküle müssen genügend Energie haben und mit der richtigen räumlichen Ausrichtung kollidieren.
Wie Sie vielleicht bereits wissen, gibt es verschiedene Arten von Reaktionen, einschließlich Synthese, Zersetzung, Verschiebung und Verbrennung., In Anbetracht der Tatsache, dass sich die Kollisionstheorie auf die Reaktionen konzentriert, die Kollisionen zwischen zwei Arten beinhalten, müssen Sie sich nicht viel um Zersetzungsreaktionen kümmern, da in solchen Fällen eine einzelne Verbindung auseinandergefallen ist und keine Kollisionen oder Orientierung von Partikeln im Raum berücksichtigt werden müssen.
Bei Reaktionen, an denen zwei Spezies beteiligt sind, sind Kollisionen zwischen den Molekülen entscheidend für die Reaktion; aber nur Kollisionen von Molekülen mit ausreichender kinetischer Energie und relevanter räumlicher Orientierung können eine Reaktion auslösen., So wird Energie benötigt, um die Bindungen innerhalb der reagierenden Moleküle zu brechen, während die Orientierung von Molekülen im Raum eine wichtige Rolle spielt, um die richtigen Atome miteinander auszurichten, um die gebrochenen Bindungen in der richtigen Weise zu reformieren.
Wenn beide Kriterien erfüllt sind, wird die Kollision als erfolgreiche, effektive oder reaktive Kollision betrachtet.
In Anbetracht der Bedeutung der beiden oben genannten Faktoren (Energie und Orientierung) sollten wir die weitere Erklärung der Begriffe und Konzepte fortsetzen, um die Prinzipien der Kollisionstheorie besser zu verstehen.,
Aktivierungsenergie
Wie bereits erwähnt, müssen Teilchen mit genügend Energie kollidieren, damit eine Reaktion auftreten kann. Diese minimale Energie, die für die Reaktion benötigt wird, um fortzufahren, wird als Aktivierungsenergie definiert.,
Wie Sie vielleicht wissen, gibt es zwei Arten von Reaktionen in Bezug auf Energiefreisetzung oder – absorption, die die folgenden sind:
- Endotherme Reaktion – Energie wird in einer Reaktion absorbiert (normalerweise in Form von Wärme)
- Exotherme Reaktion-Energie wird in einer Reaktion freigesetzt (normalerweise in Form von Wärme)
Auf den ersten Blick scheint es, dass, da Energie in einer exothermen Reaktion freigesetzt wird, keine Notwendigkeit bestehen sollte, etwas Energie für die reaktion auf auftreten. Im Gegenteil, sowohl endotherme als auch exotherme chemische Reaktionen erfordern Energie, um loszulegen.,
Es scheint ein bisschen seltsam, richtig? Warum braucht eine Reaktion den Energieeintrag, wenn die Energie folglich freigesetzt wird?
Betrachten wir die folgenden Beispiele für exotherme Reaktionen in unserem Alltag.

Beispiel #1 – Verbrennen einer Kerze
Das Verbrennen einer Kerze setzt Energie in Form von Wärme frei; Daher ist die Reaktion, die während des Prozesses auftritt, exotherm. Natürlich müssen Sie die Kerze mit einem Streichholz oder Feuerzeug anzünden., Dies bedeutet, dass Sie etwas Energie eingeben müssen, damit die Kerze aufleuchtet. Danach hat die Reaktion genügend Energie, um mit den nächsten Schritten fortzufahren, und die Kerze verbrennt weiterhin Energie.
Eine Kerze wird jedoch niemals alleine in Flammen aufgehen, oder?
Beispiel #2-Beleuchtung einer Übereinstimmung

Ein typischer Übereinstimmungskopf besteht aus Schwefel, der mit verschiedenen Oxidationsmitteln gemischt ist. Um den Streichholzschachtel zu entzünden, sollten Sie den Streichholzschachtelkopf gegen die spezielle Seite einer Streichholzschachtel reiben., Während dieses Prozesses findet eine Reaktion statt und setzt Energie in Form von Licht und Wärme frei. Daher wird die Reaktion als exotherm angesehen. Sie müssen jedoch noch etwas Energie eingeben, damit der Streichholzstab anfängt zu brennen. Diese Energie wird über den Begriff „Aktivierungsenergie“ definiert.“Ähnlich wie im vorherigen Beispiel wird der Streichholzstab, solange Sie genügend Energie bereitstellen, damit er aufleuchtet, weiterhin von selbst brennen und Wärme abgeben.
Aktivierungsenergiegraph zeigt die Energieänderungen, die während einer chemischen Reaktion auftreten.,
Um den Aktivierungsenergiegraphen zu zeichnen, ist es wichtig, zwei Variablen zu berücksichtigen:
- Anzahl der Kollisionen zwischen verschiedenen Molekülen
- Kinetische Energie der kollidierenden Moleküle
Die erste Variable ist recht einfach zu verstehen, da sie eine direkte Bedeutung hat-sie definiert die Anzahl der Kollisionen zwischen den Partikeln zweier Arten pro Sekunde.
Die zweite Variable ist die kinetische Energie der kollidierenden Moleküle, die als die Energie der Bewegung der Moleküle definiert werden kann.
- Endotherme Reaktion-Energie wird absorbiert., Die Energie der Reaktanten ist niedriger als die Energie der Produkte.
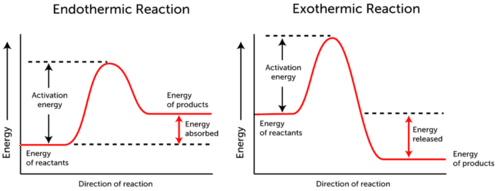
- Exotherme Reaktion Energie freigesetzt wird. Die Energie der Reaktanten ist mehr als die Energie der Produkte.
Wie Sie in den beiden obigen Diagrammen sehen können, ist die Aktivierungsenergie für beide endotherme und exotherme Reaktionen gleich.,
Da die endotherme Reaktion nicht so viel Energie produzieren kann, wie sie für die Reaktion verbrauchen muss, wird die Energie absorbiert; Daher ist die Energie der Produkte höher als die Energie der Reaktanten.
Im Gegenteil, exotherme Reaktionen produzieren mehr Energie, als sie als Aktivierungsenergie nutzen. Dadurch wird die Energie freigesetzt und die Produkte haben eine geringere Energie als die Reaktanten.,
Als Schlussfolgerung kann festgestellt werden, dass selbst wenn reaktante Moleküle schnell miteinander kollidieren, es für die Moleküle unerlässlich ist, genügend Energie für die Reaktion zu haben.
Räumliche Orientierung
Nach der Kollisionstheorie sind nicht alle Kollisionen erfolgreich, auch wenn die Reaktantenmoleküle über ausreichende Aktivierungsenergie verfügen. Die Moleküle müssen auch richtig herum kollidieren.
Der zweite Aspekt, der reaktive Kollisionen beeinflusst, wird als räumliche Orientierung (Orientierung von Molekülen im Raum) angesehen.,
Was ist mit der „richtigen“ Orientierung von Molekülen in einer Reaktion gemeint?
Wenn zwei Moleküle kollidieren, müssen beide Moleküle so angeordnet sein, dass sie leicht reagieren können. Um das Konzept vollständig zu verstehen, ist es wichtig, den Mechanismus der Reaktion hervorzuheben.
Betrachten wir die Reaktion zwischen Propylen (oder Propen) und Bromwasserstoff als Beispiel:

Wie Sie oben sehen können, verläuft die Reaktion in 2 Schritten.,
Schritt 1: Die Doppelbindung ist gebrochen
Schritt 2: Brom ist angehängt
Bei dieser Reaktion spielen die molekularen Orientierungen von HBr und C3H6 eine wichtige Rolle, da einer von ihnen auf andere Weise angeordnet ist, wäre es für das H-Atom nicht möglich gewesen, sich dem Propylenmolekül zu nähern.
Dies gilt für jede Reaktion. Jedes Molekül muss die richtige Orientierung im Raum haben, damit die Reaktion stattfinden kann. Die richtige Orientierung sorgt dafür, dass die Moleküle so angeordnet sind, dass sie relativ leicht kollidieren und reagieren können.,
Wir können daraus schließen, dass die günstige Orientierung reaktanter Moleküle ebenso essentiell ist wie ausreichende Aktivierungsenergie.
Zusammenfassung
Begriffe und Konzepte, die im gesamten Artikel definiert sind, sind in der folgenden Tabelle zusammengefasst:
| Kollisionstheorie | Erklärt, wie die Partikel interagieren oder miteinander eine Reaktion auslösen sollen., Nach der Kollisionstheorie müssen zwei Kriterien erfüllt sein, damit eine chemische Reaktion stattfinden kann: Moleküle müssen mit ausreichender Aktivierungsenergie kollidieren, um bestehende Bindungen zu brechen und neu zu bilden; Moleküle müssen mit einer günstigen räumlichen Orientierung kollidieren. |
| Erfolgreiche Kollision (auch als effektive oder reaktive Kollision bezeichnet) | Eine Kollision von Molekülen mit ausreichender Aktivierungsenergie und richtiger Orientierung im Raum, die zu einer chemischen Reaktion führt., |
| Aktivierungsenergie | Die minimale Energie, die für die Reaktion erforderlich ist. Die Energiezufuhr wird sowohl bei endothermen als auch exothermen Reaktionen benötigt. |
| Endotherme Reaktion | Energie (Wärme) wird absorbiert; Die Energie von Reaktanten ist NIEDRIGER als die Energie von Produkten; Kann nicht so viel Energie produzieren, wie es während der Reaktion verbraucht., |
| Exotherme Reaktion | Energie (Wärme) wird freigesetzt; Die Energie der Reaktanten ist HÖHER als die Energie der Produkte; Kann mehr Energie produzieren, als sie während der Reaktion verbraucht. |
| Molekulare Orientierung | Räumliche Orientierung von Molekülen., |
Three different scenarios are represented in the picture attached below:
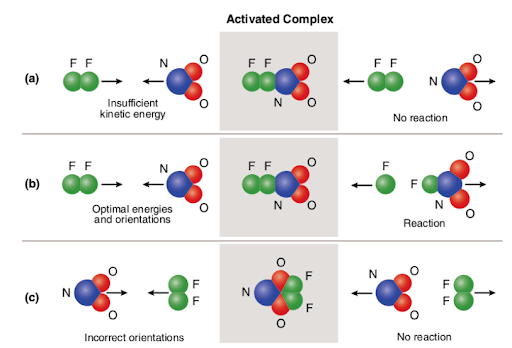
The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride.,
Im Falle von (a) haben die Reaktantenmoleküle eine angemessene räumliche Orientierung, haben aber keine ausreichende Aktivierungsenergie; Daher tritt die Reaktion nicht auf, weil nicht genügend Energie vorhanden ist, um Bindungen zu brechen. Daher wird die Kollision zwischen den beiden Molekülen als nicht reaktiv angesehen.
Im Falle von (b) haben die Reaktantenmoleküle sowohl ausreichende Aktivierungsenergie als auch die richtige Orientierung im Raum. Aufgrund der optimalen Eigenschaften der Moleküle verläuft die Reaktion und es bildet sich Stickstoffoxyfluorid., Die Kollision zwischen den beiden Molekülen wird also als reaktiv angesehen.
Im Falle von (c) haben die Reaktantenmoleküle genügend Aktivierungsenergie, sind aber nicht richtig im Raum angeordnet; Daher findet die Reaktion nicht statt, da es den Molekülen nicht möglich ist, sich auf die Weise zu erreichen, die Bindungen bricht. Ähnlich wie im ersten Fall wird die Kollision zwischen den beiden Molekülen als nicht reaktiv angesehen.