Cristallino e Cataratta
Joah F. Aliancy, MD e Nick Mamalis, MD
INTRODUZIONE
La lente dell’occhio è un biconvesse, relativamente acellulare, otticamente trasparente intraoculare struttura che con la cornea serve per trasmettere la luce verso la retina con una minima dispersione della luce (Fig. 1 bis). I primi anatomisti consideravano l’obiettivo come la posizione di una visualizzazione significativa., Ora sappiamo che questa è la funzione della retina, con la lente che serve come un condotto di trasmissione della luce e messa a fuoco alla retina. L’obiettivo può cambiare forma con l’aiuto dei muscoli ciliari, cambiando così la distanza focale dalla retina e portando l’immagine a fuoco sulla retina. Questa regolazione dell’obiettivo è nota come alloggio (simile alla messa a fuoco di una fotocamera fotografica tramite il movimento delle sue lenti). L’obiettivo è più piatto sul lato anteriore che sul lato posteriore. (Fico. 1 ter).
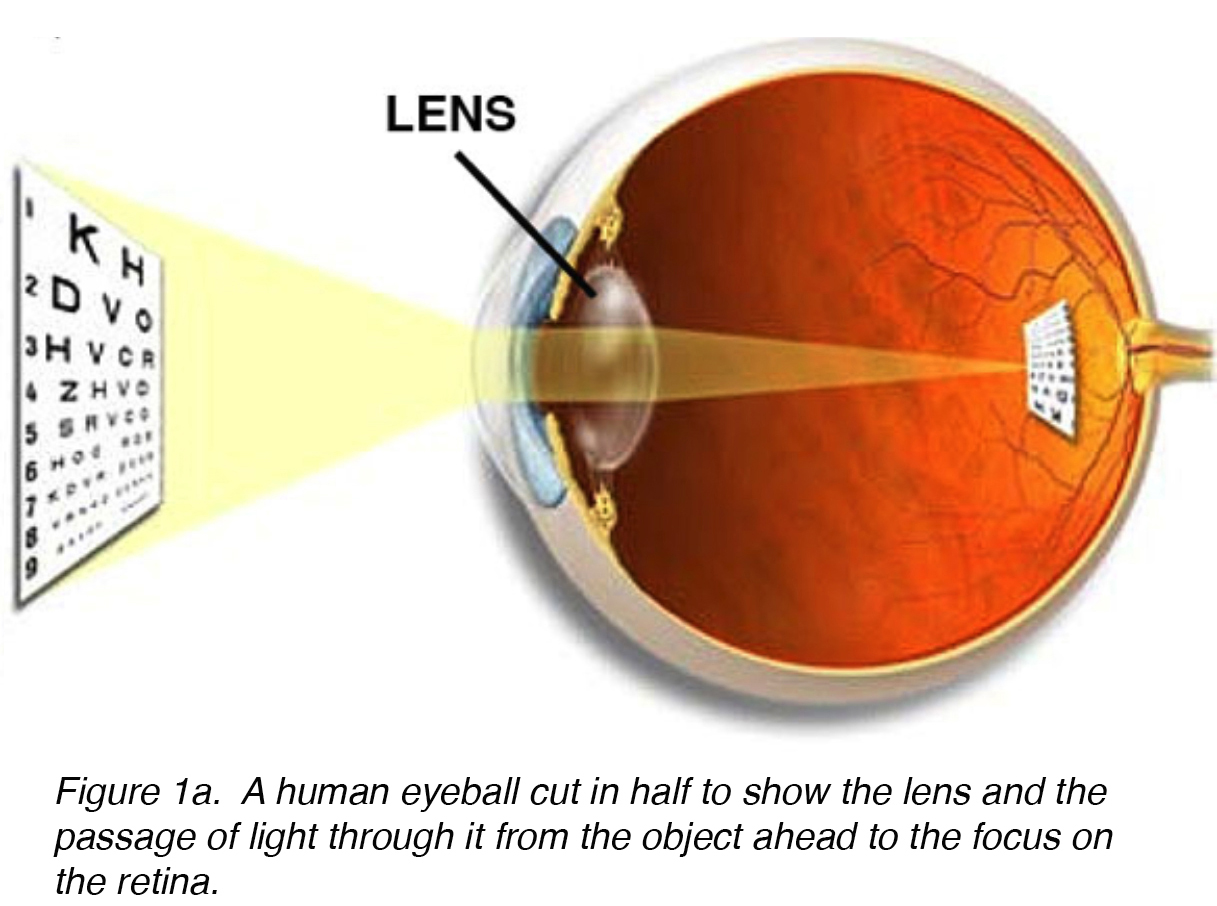
Figura 1a., Un bulbo oculare umano tagliato a metà per mostrare la lente e il passaggio della luce attraverso di essa dall’oggetto avanti alla messa a fuoco sulla retina.
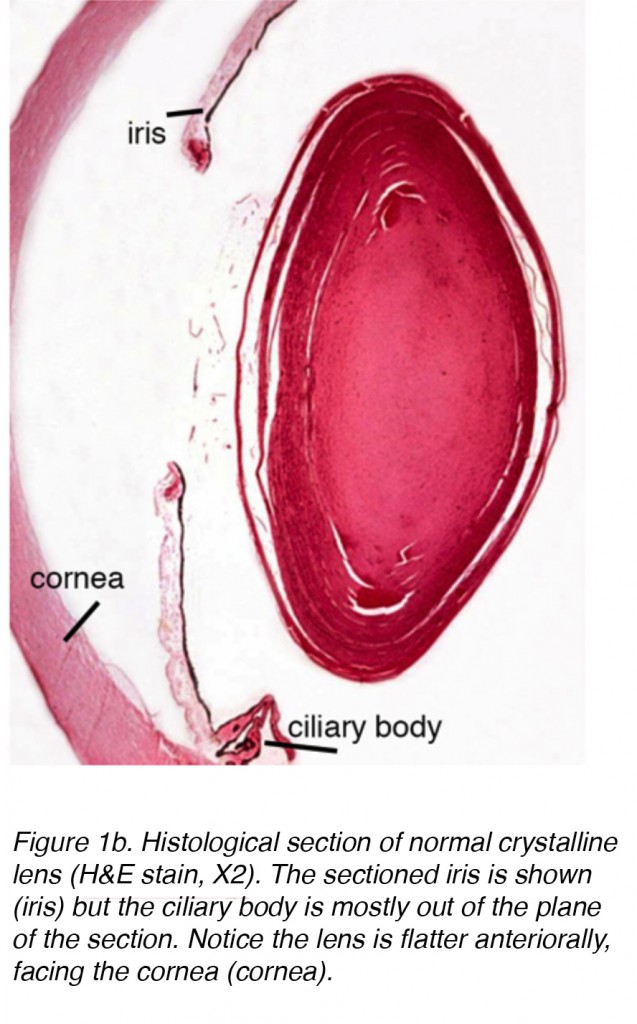
Figura 1b. Sezione istologica del cristallino normale (H&E macchia, X2). Viene mostrata l’iride sezionata (iris) ma il corpo ciliare è per lo più fuori dal piano della sezione. Si noti che la lente è più piatta anteriormente, rivolta verso la cornea (cornea).,
SVILUPPO DELLA LENTE
La lente matura ha origine dall’ectoderma superficiale e si sviluppa attraverso un processo altamente organizzato correlato con lo strato di cellule germinali del neuroectoderma. All’inizio dell’embriogenesi il diencefalo, tessuto derivato dal neuroectoderma, forma due outpouchings chiamati vescicole ottiche. Le vescicole ottiche inducono la formazione delle cellule lenticolari immature quando viene a contatto con ectoderma superficiale. Le cellule lenticolari immature si addensano per formare il placode della lente. Contemporaneamente, le vescicole ottiche invaginano causando una rientranza sul placode della lente chiamato fossa della lente (Fig., 2 bis).
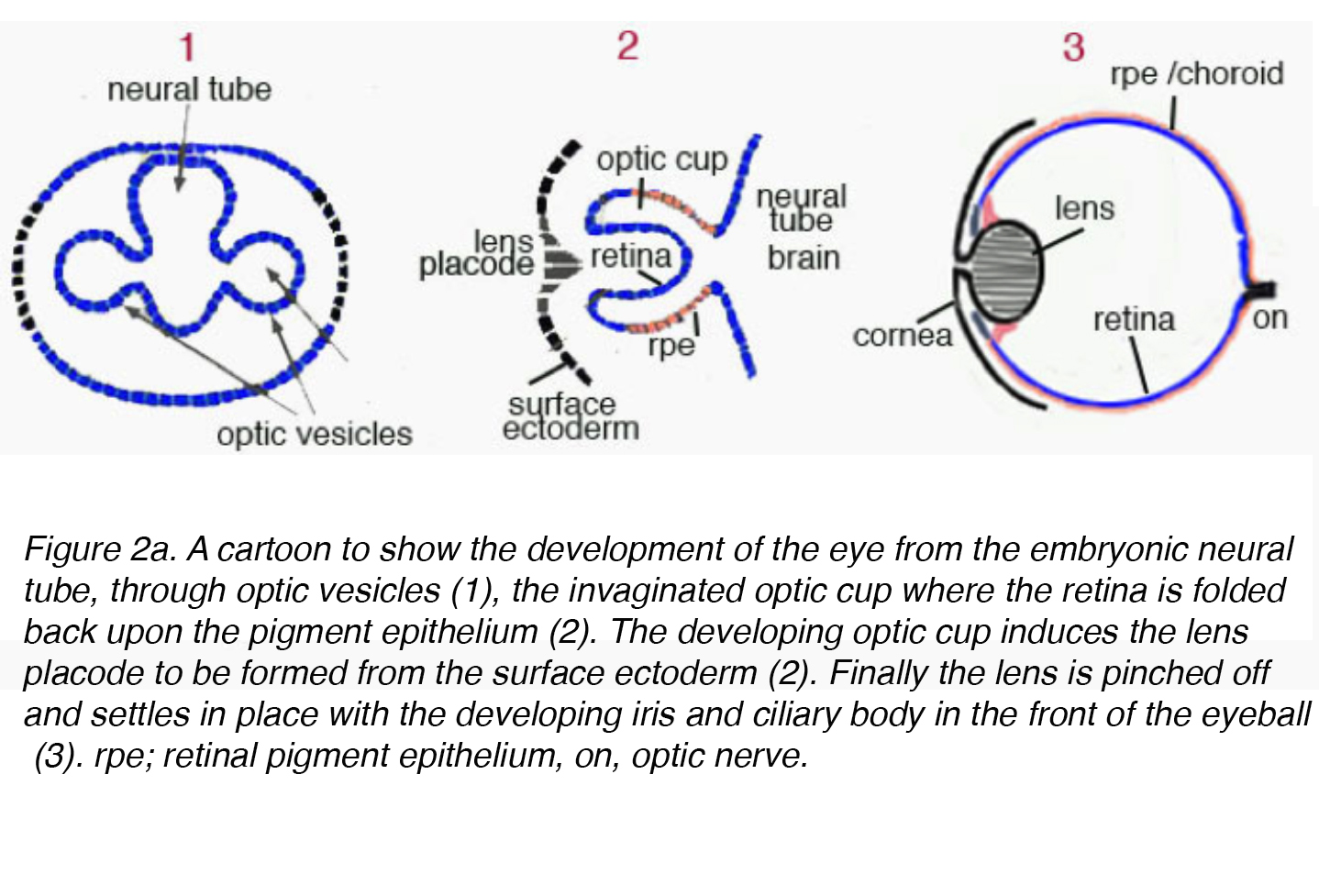
Figura 2a. Un cartone animato per mostrare lo sviluppo dell’occhio dal tubo neurale embrionale, attraverso le vescicole ottiche (1), la coppa ottica invaginata dove la retina è ripiegata sull’epitelio pigmentato (2). La coppa ottica in via di sviluppo induce il placode della lente a formarsi dall’ectoderma superficiale (2). Infine la lente viene pizzicata e si deposita in posizione con l’iride in via di sviluppo e il corpo ciliare nella parte anteriore del bulbo oculare (3). rpe; epitelio pigmentato retinico, on, nervo ottico.,
A questo punto, la vescicola della lente è costituita da un singolo strato di cellule avvolte all’interno di una membrana basale esterna. Questa membrana basale alla fine formerà la capsula della lente. Mentre racchiusi nella membrana basale, le cellule nel polo posteriore della vescicola lente si estendono anteriormente per formare le fibre della lente primaria (Fig. 2a)
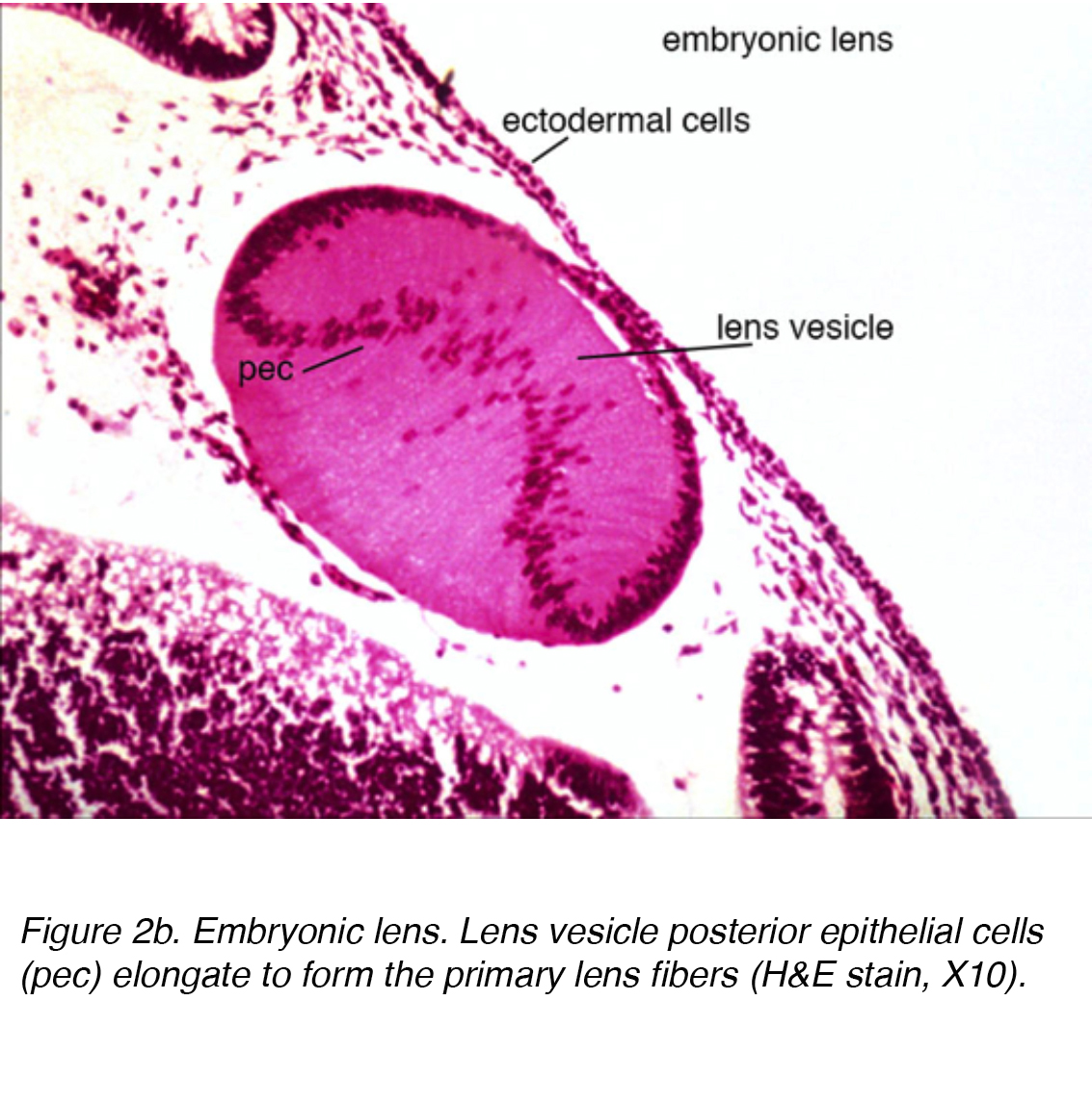 Figura 2b. Lente embrionale. Le cellule epiteliali posteriori della vescicola della lente (pec) si allungano per formare le fibre primarie della lente (H&E stain, X10).,
Figura 2b. Lente embrionale. Le cellule epiteliali posteriori della vescicola della lente (pec) si allungano per formare le fibre primarie della lente (H&E stain, X10).,
Le cellule anteriori diventano le cellule epiteliali della lente, mentre le fibre della lente primaria formano collettivamente il nucleo embrionale. Successivamente, le fibre lente secondarie iniziano ad allungarsi dalle cellule epiteliali della lente per formare il nucleo fetale durante il periodo di gestazione e continuano a crescere più strati. Mentre le fibre della lente secondaria si allungano dall’equatore, formano suture a forma di Y incontrandosi anteriormente e posteriormente durante la crescita fetale. Le fibre della lente secondaria alla fine crescono per formare il nucleo adulto con nuovi strati di fibre della lente che formano la corteccia lenticolare., Durante lo sviluppo lenticolare, l’arteria ialoide fornisce nutrizione e fattori di crescita attraverso la tunica vasculosa lentis, una struttura vascolare che avvolge il nucleo della lente. Tuttavia, questa struttura subisce involuzione prima della nascita per assomigliare alla lente avascolare vista nell’adulto. Una solida comprensione dell’embriologia e dello sviluppo della lente fornirà una grande comprensione della patologia associata alla formazione della cataratta.,
ISTOLOGIA DELLA LENTE
La figura 3 mostra una sezione macchiata della lente umana adulta con la parte anteriore della lente nella sezione superiore e la parte posteriore nella sezione inferiore.
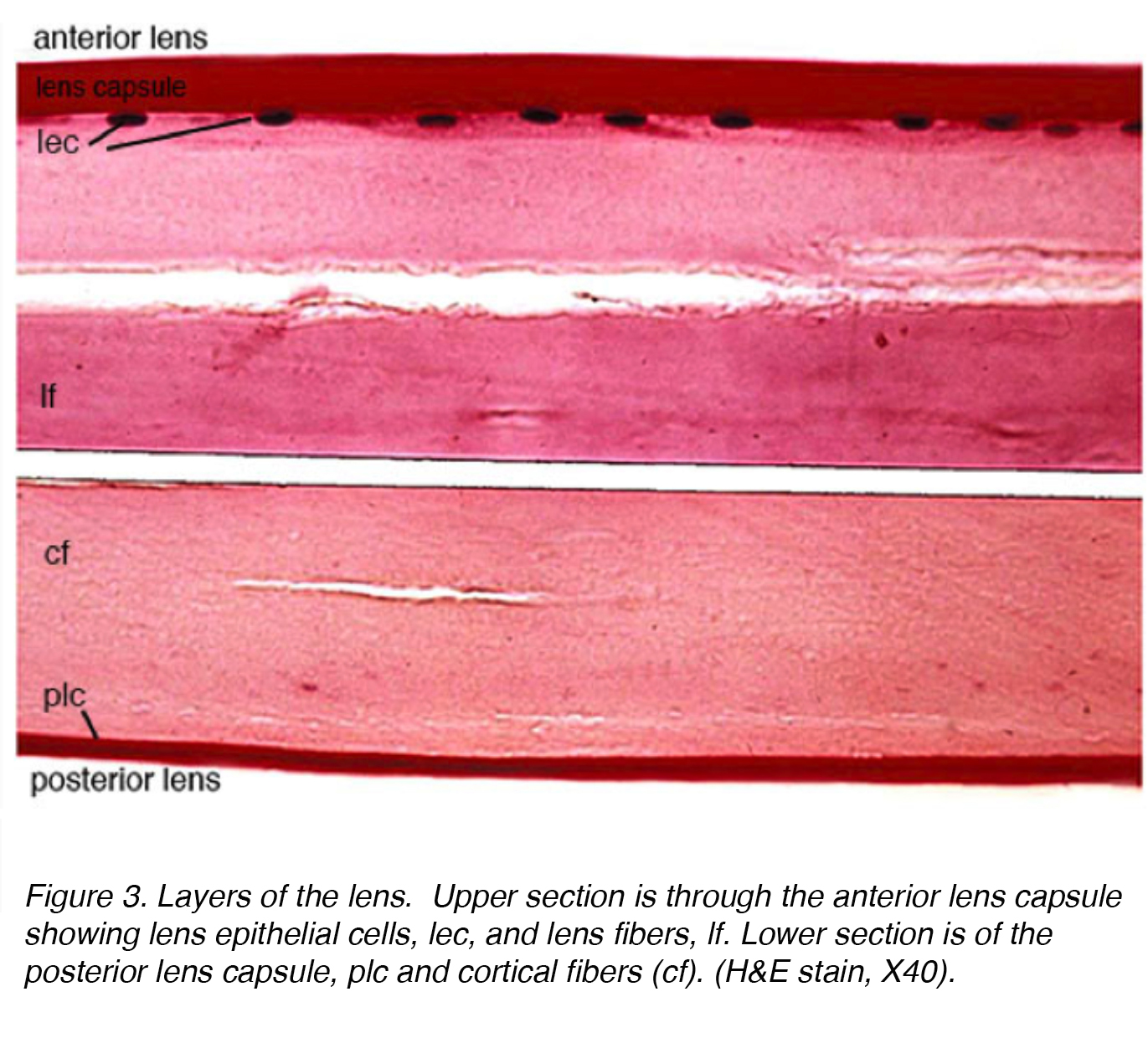
Figura 3. Strati della lente. La sezione superiore è attraverso la capsula anteriore della lente che mostra le cellule epiteliali della lente, lec e le fibre della lente, lf. La sezione inferiore è della capsula posteriore della lente, plc e fibre corticali (cf). (H&E macchia, X40).
La lente è composta da 4 strutture: capsula, epitelio, corteccia e nucleo (Fig. 3)., La capsula è la membrana basale con collagene di tipo VI elaborato dallo strato epiteliale e si colora positivamente con una macchia periodica di acido shiff (PAS). È otticamente chiaro e acellulare. La lente è tenuta in posizione da fibre zonulari, altrimenti note come zonule di Zinn (Fig. 4). Queste fibre elastiche provengono dallo strato epiteliale non pigmentato del corpo ciliare e si articolano con lo strato esterno della capsula, lo strato lamellare capsulare., C’è una riduzione della tensione zonulare con contrazione del muscolo ciliare che porta ad una forma più sferica che consente di concentrarsi su oggetti più prossimali. Questo processo è chiamato alloggio.
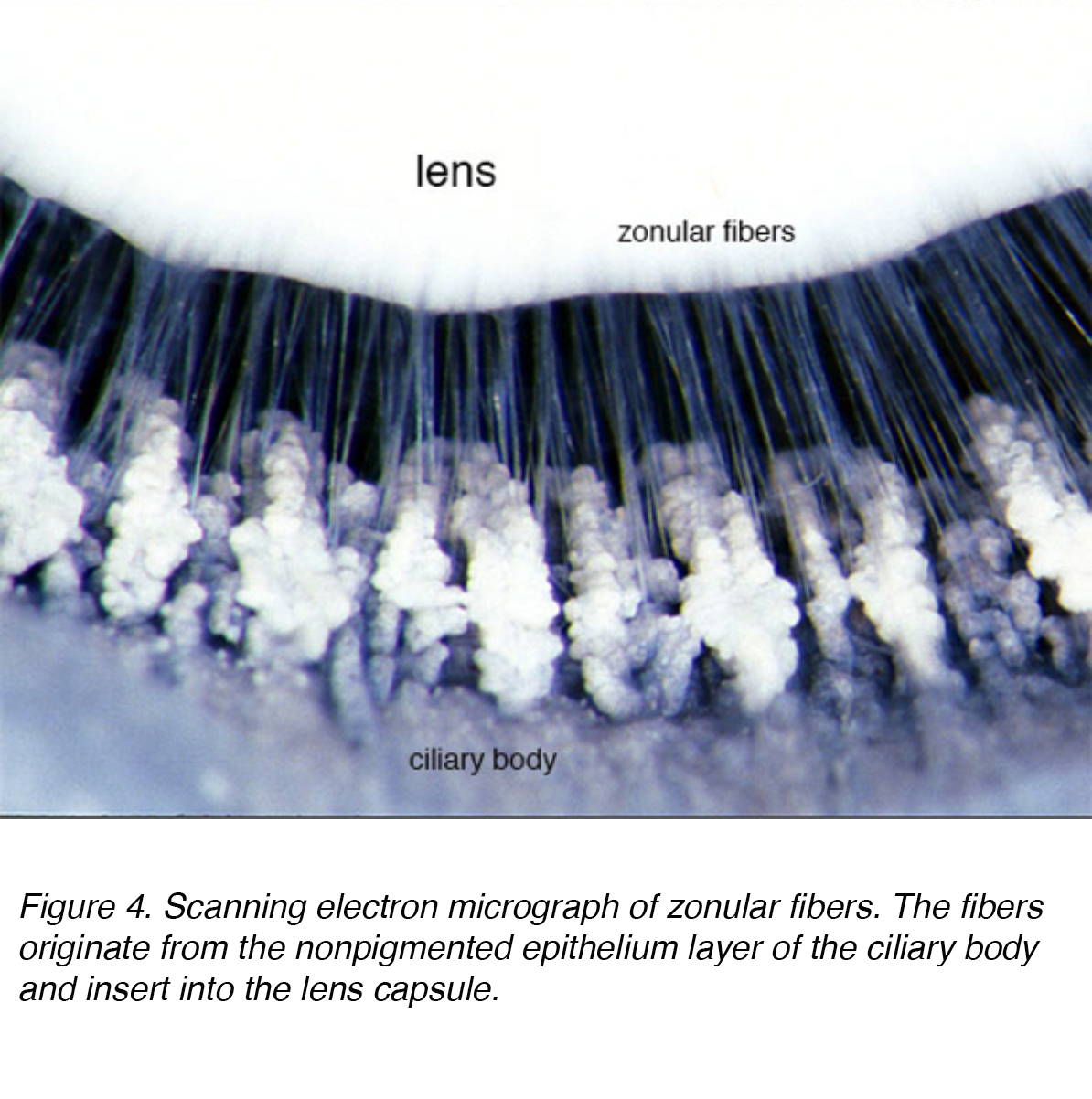
Figura 4. Micrografo elettronico a scansione di fibre zonulari. Le fibre provengono dallo strato epiteliale non pigmentato del corpo ciliare e si inseriscono nella capsula della lente.
L’epitelio della lente ha cellule mitoticamente attive che subiscono un’ulteriore differenziazione attraverso un processo di allungamento, aumento delle proteine intracellulari e perdita di organelli., Queste cellule sono disposte in uno strato attraverso l’aspetto posteriore della capsula anteriore. La regione dell’arco equatoriale della lente è dove le cellule epiteliali della lente si allungano per formare le cellule della fibra della lente (Fig.5). La differenziazione terminale dell’epitelio infine conduce agli strati della fibra sia della corteccia che del nucleo, con le più vecchie fibre che sono situate più centralmente.
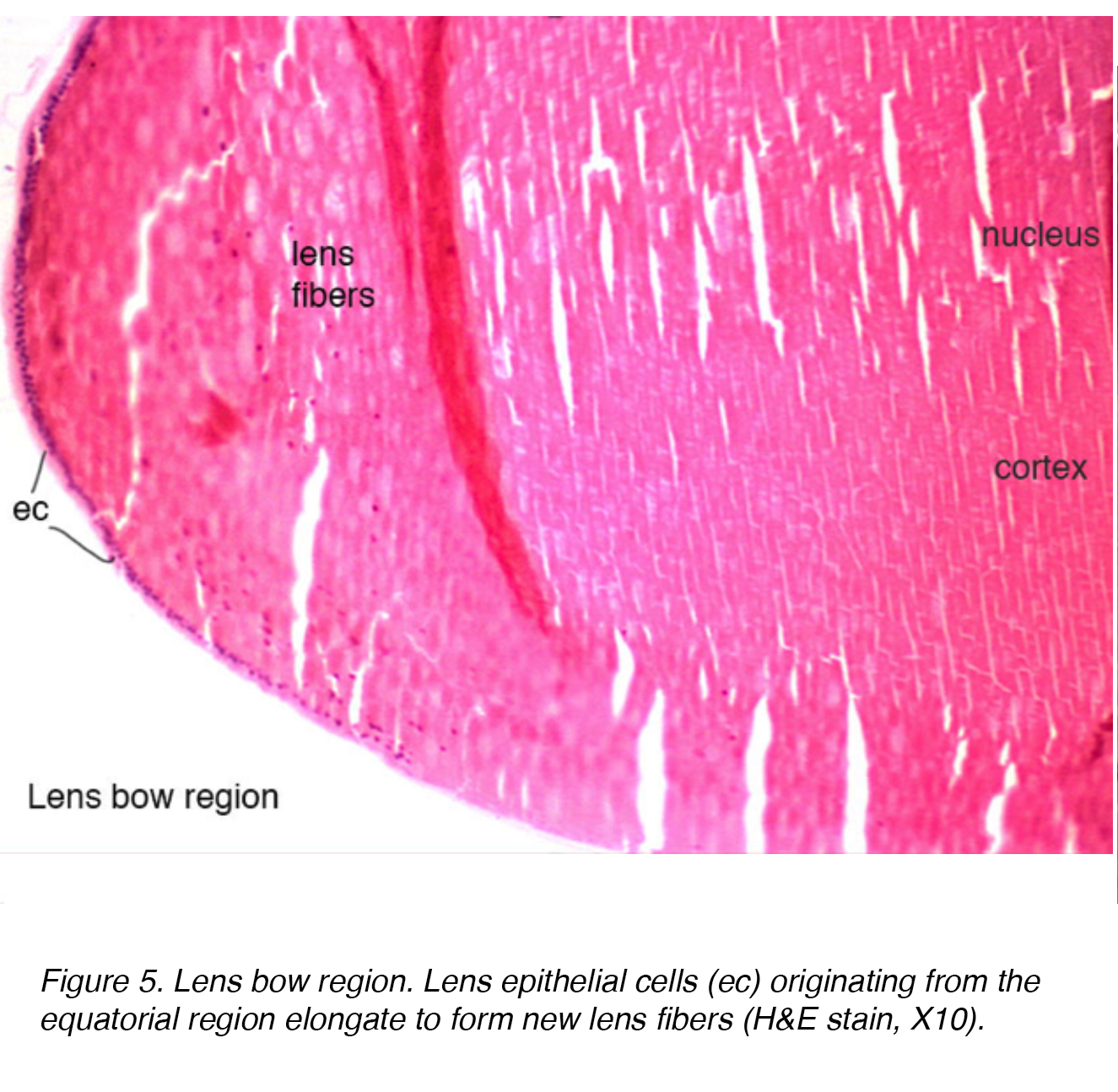
Figura 5. Lente arco regione. Le cellule epiteliali del cristallino (ec) originarie della regione equatoriale si allungano per formare nuove fibre del cristallino (H&E stain, X10).,
Mentre il nucleo è più denso, istologicamente, non c’è distinzione tra corteccia e nucleo (Fig. 5). L’unica differenza apprezzabile è l’età, con strati più anziani situati più centralmente. È interessante notare che, come gli strati di corteccia e nucleo crescono, la forza diottrica complessiva della lente aumenta a causa del diametro maggiore e la curvatura della lente. La mancanza di organelli all’interno del nucleo e della corteccia serve a fornire un supporto otticamente chiaro per la trasmissione della luce. La lente adulta è quasi tre volte la massa della sua corrispondente versione neonatale, da 90 mg a 250 mg.,
Nell’adulto, la lente manca di vascolarizzazione o innervazione, quindi le esigenze metaboliche della lente sono soddisfatte da un flusso costante di umore acqueo che funge da condotto sia per la rimozione dei rifiuti che per la consegna dei nutrienti.
FORMAZIONE DELLA CATARATTA E TIPI DI CATARATTA
1) CATARATTA CONGENITA
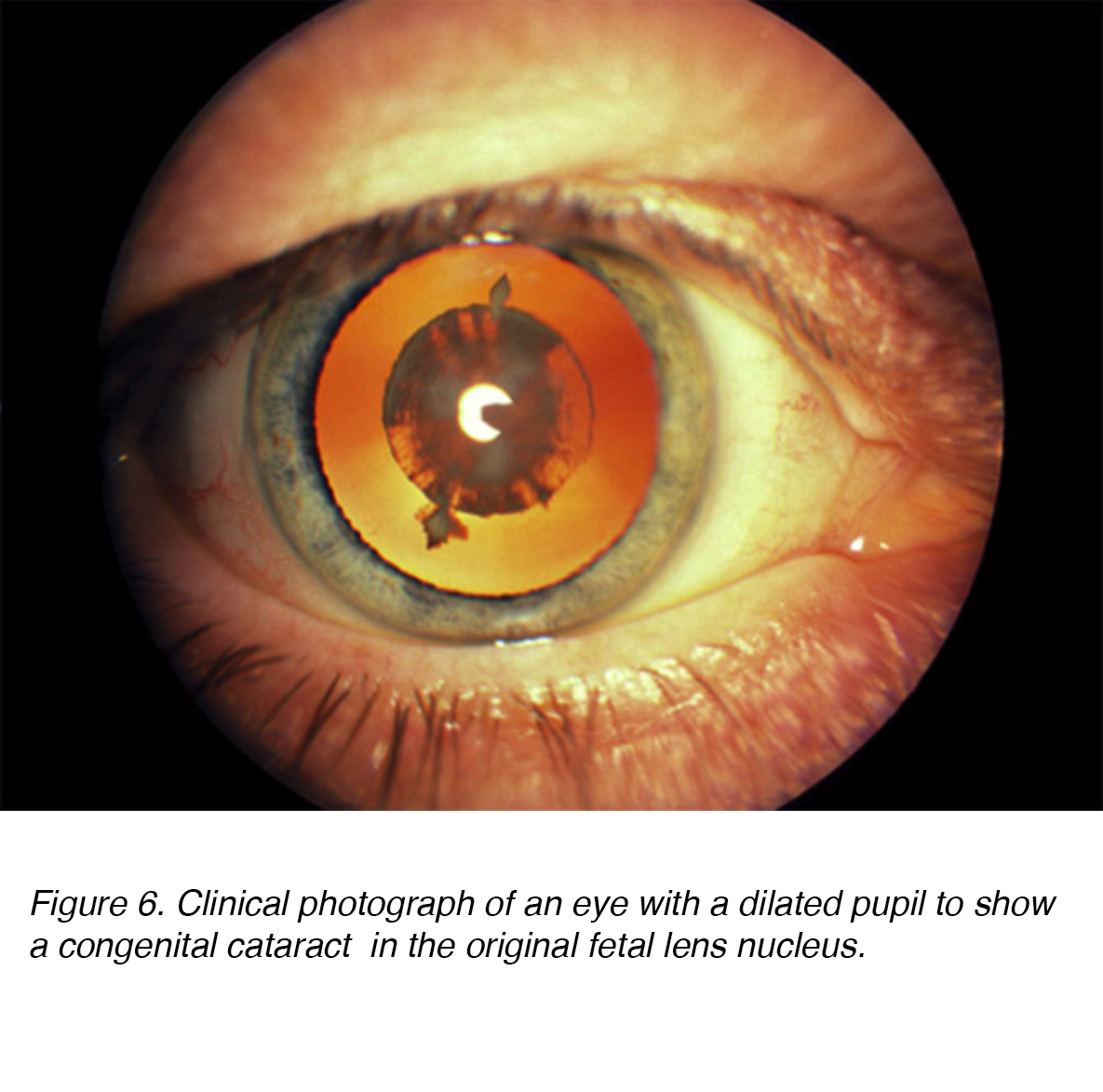
Figura 6. Fotografia clinica di un occhio con una pupilla dilatata per mostrare una cataratta congenita nel nucleo originale della lente fetale.,
Le cataratte congenite sono opacità lenticolari che causano una significativa dispersione della luce alla nascita o notate poco dopo (Fig. 6). Si stima che 200.000 bambini in tutto il mondo siano ciechi a causa della cataratta congenita, con un’incidenza di 40.000 nei paesi in via di sviluppo. Per quanto riguarda la lateralità, la prevalenza sembra essere la stessa per unilaterale vs. bilaterale. L’intervento chirurgico sia per la cataratta unilaterale che bilaterale è fondamentale per prevenire l’ambliopia di privazione a lungo termine o la perdita visiva., L’ambliopia è definita come una disfunzione nell’elaborazione visiva, caratterizzata da scarsa acuità visiva in uno o entrambi gli occhi e anormale percezione della profondità binoculare. Mentre entrambi sono fondamentali per rilevare, la gravità a lungo termine della privazione visiva bilaterale sembra essere inferiore alla sua controparte unilaterale. .
I principali tipi morfologici di cataratta congenita sono classificati come zonulare, polare, totale e membranosa. La cataratta zonulare congenita è descritta come un’opacità localizzata in una specifica regione lenticolare., Un sottotipo distinto può verificarsi a seconda del momento della lesione o dell’errore di sviluppo. Se l’insulto si verifica durante i primi 2 mesi di gestazione, può verificarsi una cataratta nucleare embrionale. La lesione che si verifica nel terzo mese di gestazione può formare una cataratta nucleare fetale, caratterizzata da opacità situate tra le suture Y anteriori e posteriori, ed è nota come cataratta suturale. Un’eziologia teratologica può spiegare l’arborizzazione di un’opacità suturale., Le cataratte polari sono opacità distinte che si trovano all’interno della corteccia subcapsulare nelle regioni polari, con sottotipi anteriori e posteriori. Un punto di Mittendorf risulta quando la nave ialoide non riesce a evolversi. È caratterizzato da una piccola macchia bianca densa sulla superficie posteriore della capsula dell’obiettivo. L’eziologia della cataratta durante l’infanzia è ampia tra cui infezione intrauterina, indotta da farmaci, disturbi metabolici, traumi, malattie oculari, sindrome ereditaria e idiopatica.,
2) CATARATTA NUCLEARE
Una causa comune di disabilità visiva negli adulti più anziani è la cataratta legata all’età, che è sottocategorizzata come nucleare, corticale o sottocapsulare. L’incidenza cumulativa di corticale nucleare, corticale e posteriore è rispettivamente del 29,7%, del 22,9% e dell ‘ 8,4%. La cataratta nucleare è il problema più comune legato all’età (Fig. 7 e 8).
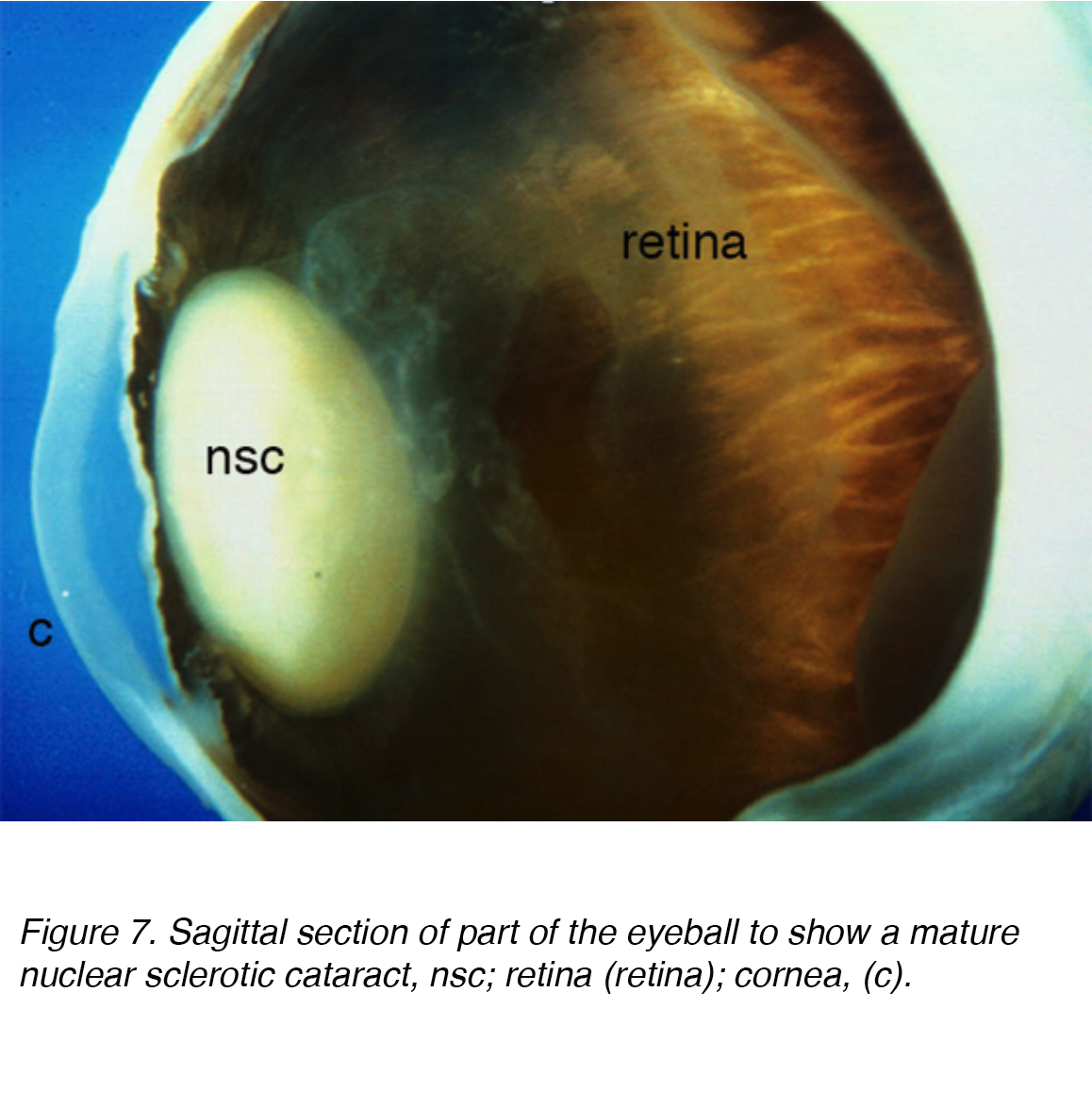
Figura 7. Sezione sagittale di parte del bulbo oculare per mostrare una cataratta sclerotica nucleare matura, nsc; retina (retina); cornea, (c).
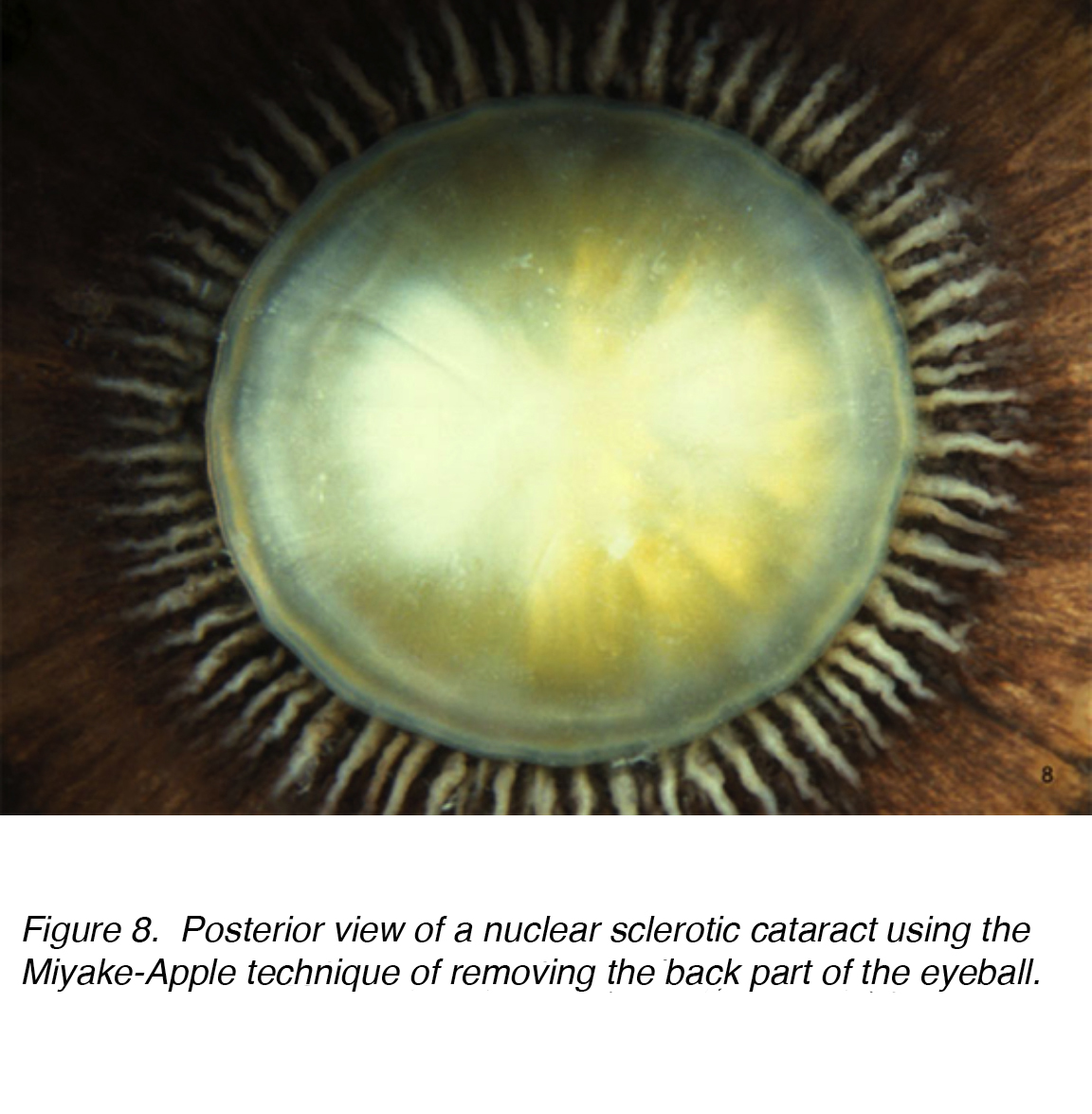
Figura 8., Vista posteriore di una cataratta sclerotica nucleare utilizzando la tecnica Miyake-Apple di rimuovere la parte posteriore del bulbo oculare.
Con l’età, le fibre nucleari diventano più compatte e causano un aumento della dispersione della luce. Di conseguenza, i nuclei sclerotici della lente diminuiscono in trasparenza e provocano aberrazioni visive e fastidiosi riflessi durante la notte. Clinicamente, la lente nucleare sclerotica cambia colore, da un materiale trasparente chiaro a giallo o arancione, eventualmente anche a marrone (brunescente) se lasciato maturare (Fig. 9)., Istologicamente, le lenti sclerotiche nucleari sono caratterizzate da un materiale omogeneo denso.

Figura 9. Cataratta brunescente isolata. La cataratta sclerotica nucleare ha un colore marrone scuro con l’età.
L’invecchiamento fa sì che il materiale lenticolare aumenti di dimensioni complessive e diventi più amorfo. Man mano che le fibre della lente continuano ad invecchiare, il nucleo diventa più compatto e meno flessibile diminuendo la capacità della lente di adattarsi efficacemente., L’aumento della colorazione è dovuto all’aggregazione proteica nella lente nucleare, diminuendo la sua trasparenza e portando a vari sintomi tra cui deficit visivo, diminuzione della sensibilità al contrasto, percezione del colore opaco e uno spostamento miopico
Mentre la cataratta continua a maturare, il materiale corticale inizia a liquefarsi e il nucleo aumenta di opacità. Una cataratta iper-matura è la fase finale del processo di invecchiamento. La corteccia liquefatta viene riassorbita e il nucleo denso affonda all’interno della sacca capsulare., Se non trattata, il materiale proteico può fuoriuscire attraverso il rivestimento capsulare e causare l’ostruzione delle maglie trabecolari (TM) che porta a una reazione glaucomatosa facolitica. Questa reazione infiammatoria è mediata dai macrofagi che rispondono alla perdita di proteine lenticolari e contribuiscono alla TM obtruction. I cambiamenti all’interno del nucleo della lente non si verificano indipendentemente dall’altra struttura lenticolare, invece, la cataratta sottocapsulare corticale può e tipicamente verificarsi simultaneamente. Tuttavia, la cataratta sclerotica nucleare è di gran lunga l’opacità lenticolare legata all’età più comune.,
La figura 10 mostra una fotografia dell’occhio di un paziente con cataratta matura densa che ha componenti sia nucleari che corticali (vedi sotto). Ovviamente il paziente era “cieco” in questo occhio, e questa cataratta doveva essere rimossa per ridare la vista agli occhi.
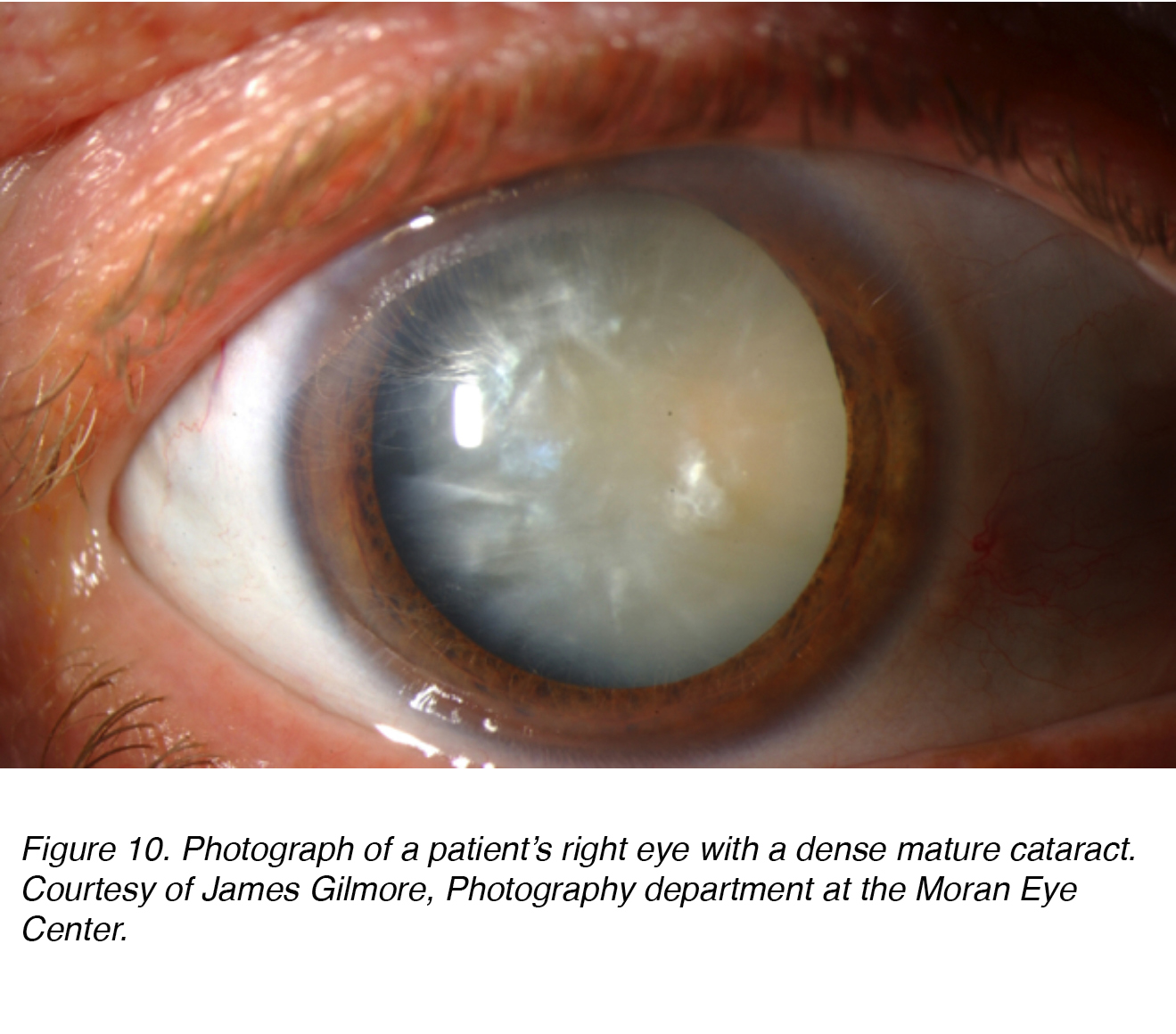
Figura 10. Fotografia dell’occhio destro di un paziente con una cataratta matura densa. Per gentile concessione di James Gilmore, dipartimento di fotografia presso il Moran Eye Center.
3) CATARATTA CORTICALE
Come nei cambiamenti nucleari della lente sclerotica, l’invecchiamento può causare cambiamenti degenerativi simili nella corteccia della lente., Le opacità formate all’interno della corteccia della lente sono piuttosto uniche. Nitide fessure liquido chiaro assomigliano raggi opachi all’interno della corteccia della lente, sono visti (Fig. 11,12).
Le figure 11 e 12 mostrano l’aspetto tipico del cateract corticale mostrato dalla parte anteriore (Fig. 11) e la parte posteriore (Fig. 12).
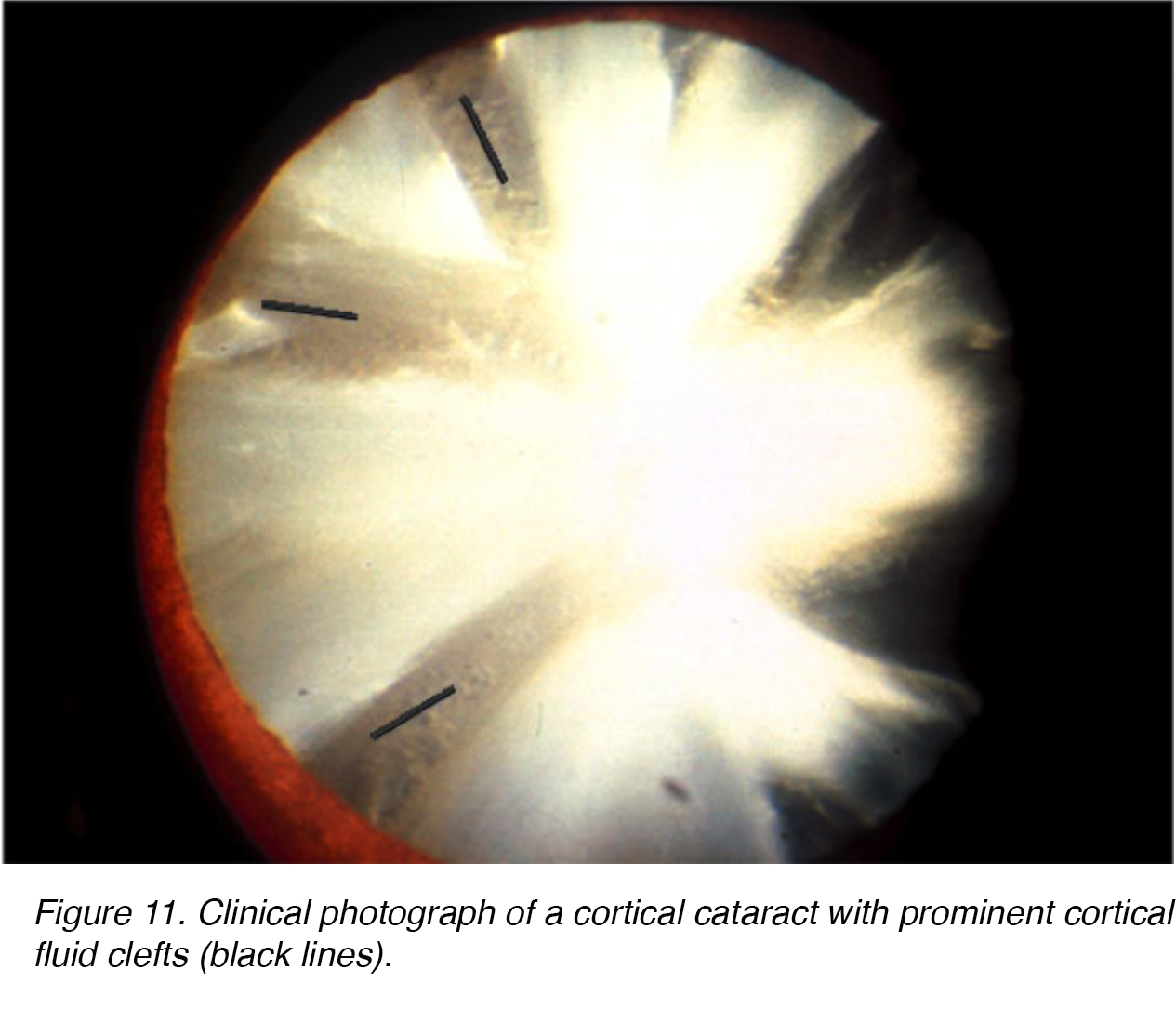
Figura 11. Fotografia clinica di una cataratta corticale con fessure di liquido corticale prominenti (linee nere).

Figura 12. Vista posteriore di una cataratta corticale utilizzando la tecnica Miyake-Apple per visualizzare l’obiettivo., Le fessure fluide sono evidenti (linee nere).
Istologicamente, la cataratta corticale è caratterizzata da un accumulo di liquido eosinofilo color rosa tra le fibre corticali (Fig. 13).
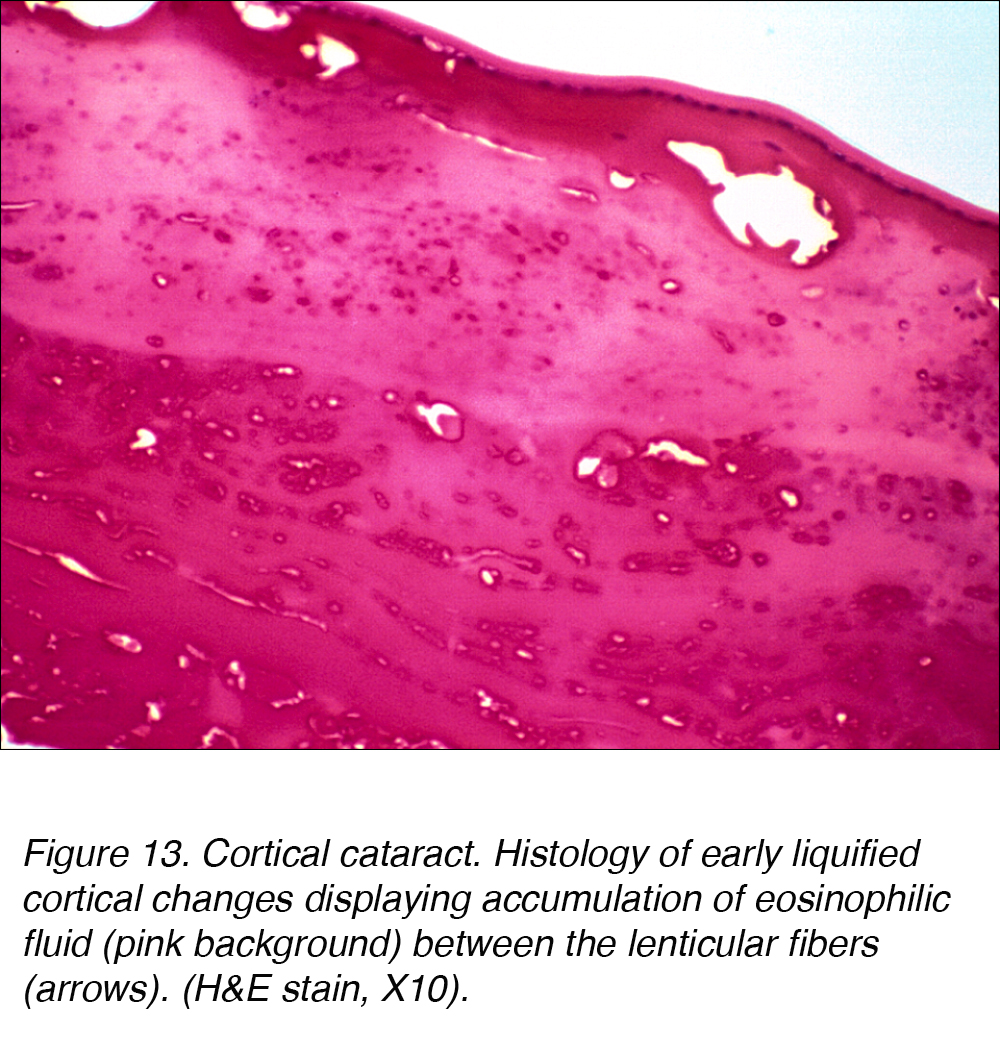
Figura 13. Cataratta corticale. Istologia dei primi cambiamenti corticali liquefatti che mostrano accumulo di liquido eosinofilo (sfondo rosa) tra le fibre lenticolari (frecce). (H&E macchia, X10).
Questo accumulo di fluido provoca spostamenti tra le cellule lenticolari che portano allo spostamento e alla degenerazione delle cellule confinanti., Lo spostamento rappresenta i raggi osservati clinicamente (Fig 11 e 12). Globuli di materiale proteico, chiamati globuli morgagniani, possono essere rilasciati dalla degenerazione delle cellule della lente corticale (Fig. 14). Mentre la cataratta corticale continua a maturare, l’intera regione corticale può essere sostituita da questi globuli e diventa così una cataratta morgagniana matura (Fig. 15).
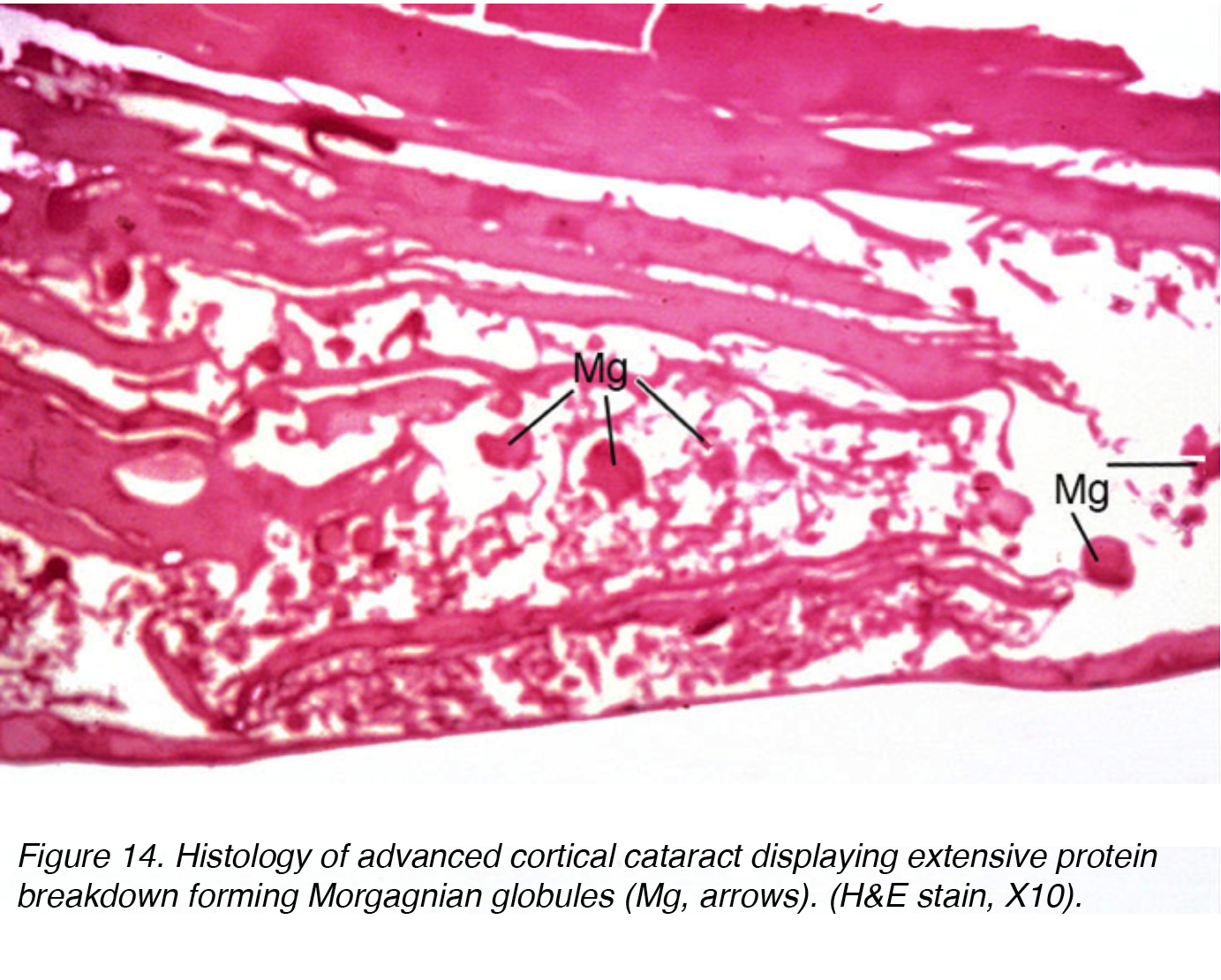
Figura 14. Istologia della cataratta corticale avanzata che mostra un’ampia scomposizione proteica formando globuli morgagniani (Mg, frecce). (H&E macchia, X10).,
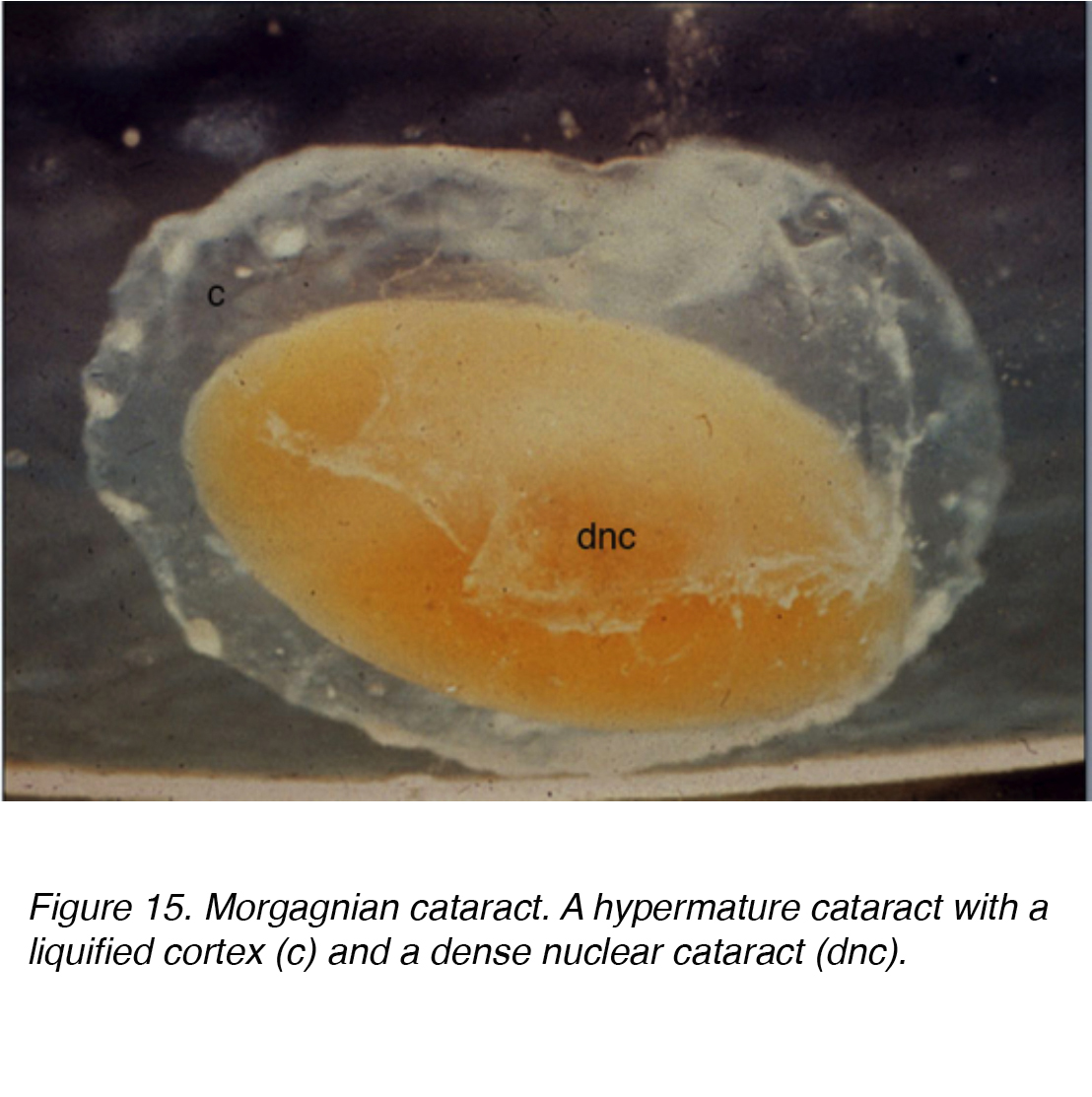
Figura 15. Cataratta morgagniana. Una cataratta ipermatura con una corteccia liquefatta (c) e una cataratta nucleare densa (dnc).
Un altro aspetto caratteristico della cataratta corticale è una cataratta dell’albero di Natale. Ciò si verifica quando i cristalli si formano all’interno della corteccia profonda. Questi cristalli sono tipicamente composti da colesterolo, lipidi, calcio o altri composti. È interessante notare che la cataratta dell’albero di Natale in genere non causa una significativa compromissione della vista.,
Mentre una cataratta corticale può verificarsi indipendentemente da una cataratta sclerotica nucleare, i cambiamenti biomeccanici all’interno del nucleo della lente possono effettivamente indurre cambiamenti catarattici nella corteccia della lente. La capacità di ospitare efficacemente diminuisce con l’età, in generale. La biomeccanica alterata tra il nucleo sclerotico e la corteccia crea uno stress puro residuo e si traduce in micro-creste parallele nell’area di separazione lamellare. Questo processo aiuta a spiegare i modelli istologici osservati nelle cataratte corticali.,
4) CATARATTA SUBCAPSULARE POSTERIORE
La cataratta subcapsulare posteriore (PSC) si sviluppa a causa della migrazione posteriore delle cellule epiteliali del cristallino in risposta allo stimolo esterno. Sebbene la maggior parte dei casi siano spontanei, il PSC può anche svilupparsi secondariamente a cause metaboliche, come diabete, infiammazione, uveite o uso a lungo termine di corticosteroidi topici o sistemici. PSC tendono a verificarsi in pazienti più giovani e progredire più rapidamente rispetto agli altri sottotipi di cataratta. L’opacità si trova al polo posteriore della lente sulla superficie anteriore della capsula posteriore (Figura 16 e 17).,
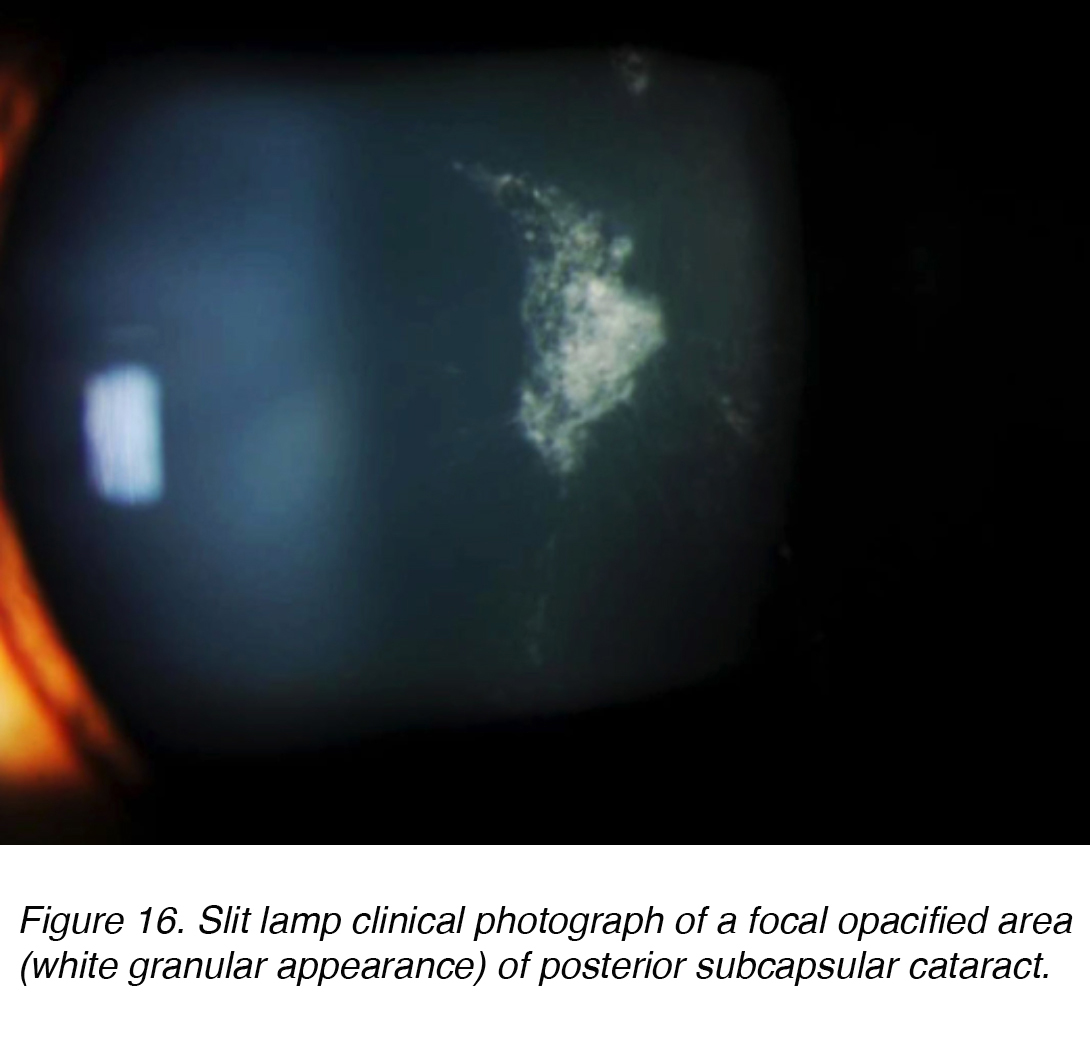
Figura 16. Lampada a fessura fotografia clinica di un’area opacizzata focale (aspetto granulare bianco) della cataratta subcapsulare posteriore.
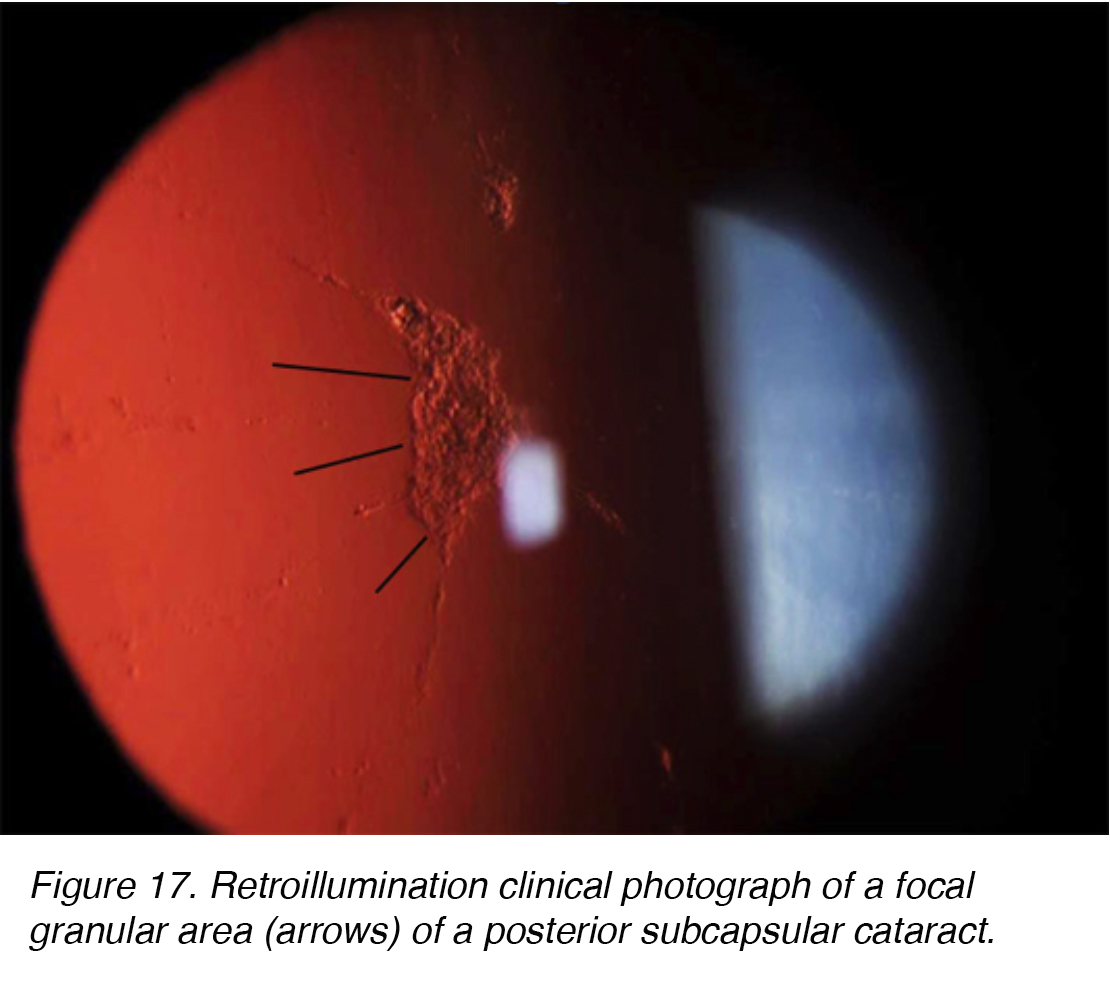
Figura 17. Fotografia clinica di retroilluminazione di un’area granulare focale (frecce) di una cataratta subcapsular posteriore.
Uno studio ultrastrutturale che ha coinvolto 13 occhi con PSC ha mostrato i cambiamenti che hanno avuto luogo quando le cellule epiteliali della lente migrano dall’equatore della lente alla regione PSC., Lo studio ha concluso che c’era un cambiamento mitotico mentre le cellule migravano verso il polo posteriore. Le cellule della regione equatoriale assomigliavano alle normali cellule epiteliali della lente, ma le cellule vicine al PSC mostravano un aumento dell’attività mitotica. Gli autori hanno suggerito che le cellule stavano rispondendo a qualche tipo di stimoli nocivi al polo posteriore. L’attività risultante ha causato le cellule a maturare in fibre lente o ingrandire in cellule vescicali chiamate cellule Wedl e la formazione di PSC (Fig. 18)., Le cellule migratrici probabilmente contribuiscono alla formazione della cataratta secernendo materiali extracellulari, citolisi, dissoluzione cellulare e possibilmente rilascio di enzimi lisosomiali.
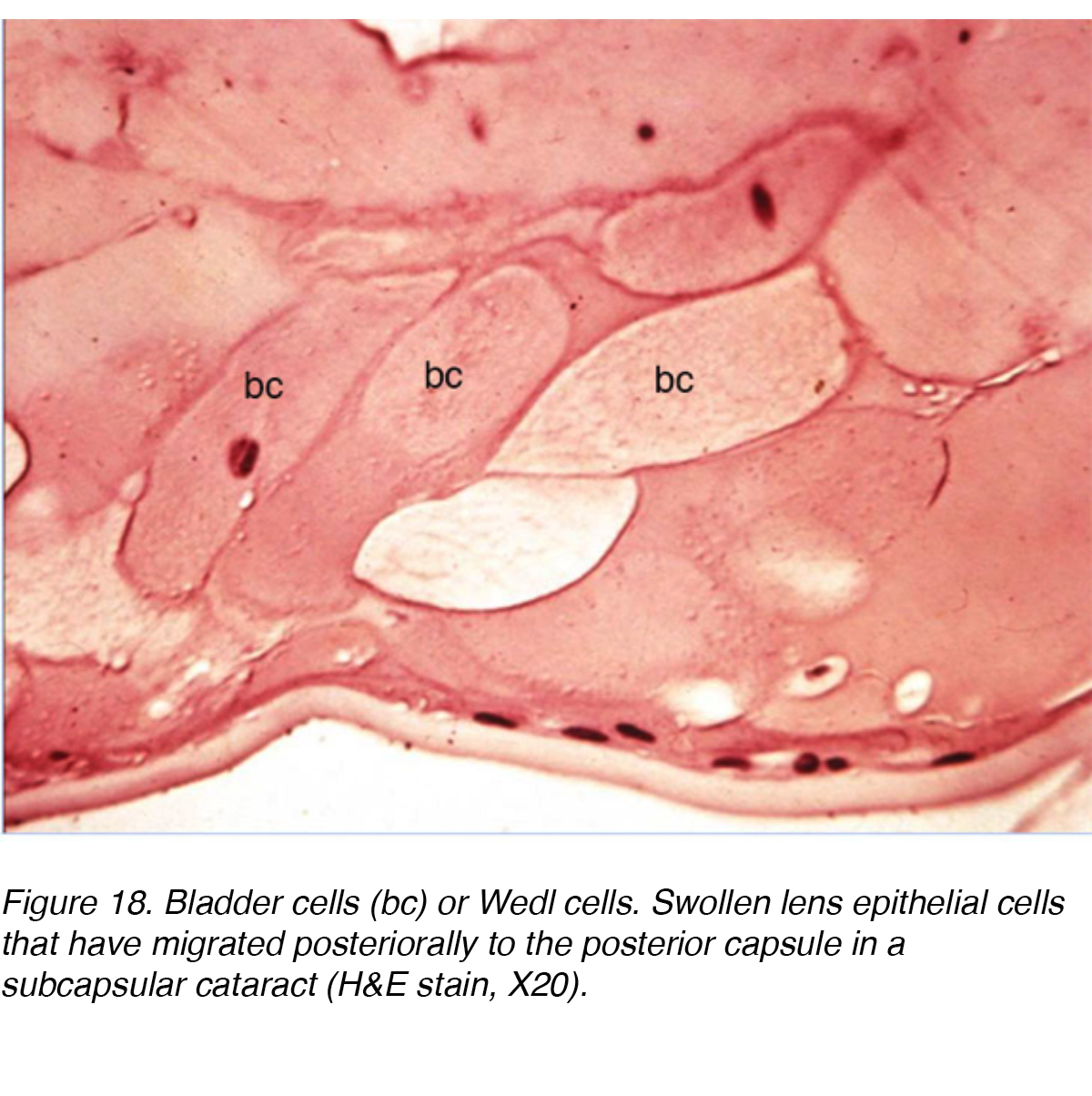
Figura 18. Cellule della vescica (bc) o cellule Wedl. Cellule epiteliali lente gonfie che hanno migrato posteriormente alla capsula posteriore in una cataratta subcapsulare (H&E macchia, X20).
5) CATARATTA SUBCAPSULARE ANTERIORE
La cataratta subcapsulare anteriore (ASC) si sviluppa a causa della degenerazione delle cellule epiteliali della lente anteriore., Possono svilupparsi secondari a traumi, cause iatrogene di trattamento medico o spontaneamente. L’area del danno provoca una migrazione delle cellule epiteliali del cristallino nell’area e la successiva trasformazione delle cellule in miofibroblasti in un processo noto come metaplasia fibrosa. Ciò si traduce in un’opacità sulla superficie anteriore della lente sotto la capsula anteriore.
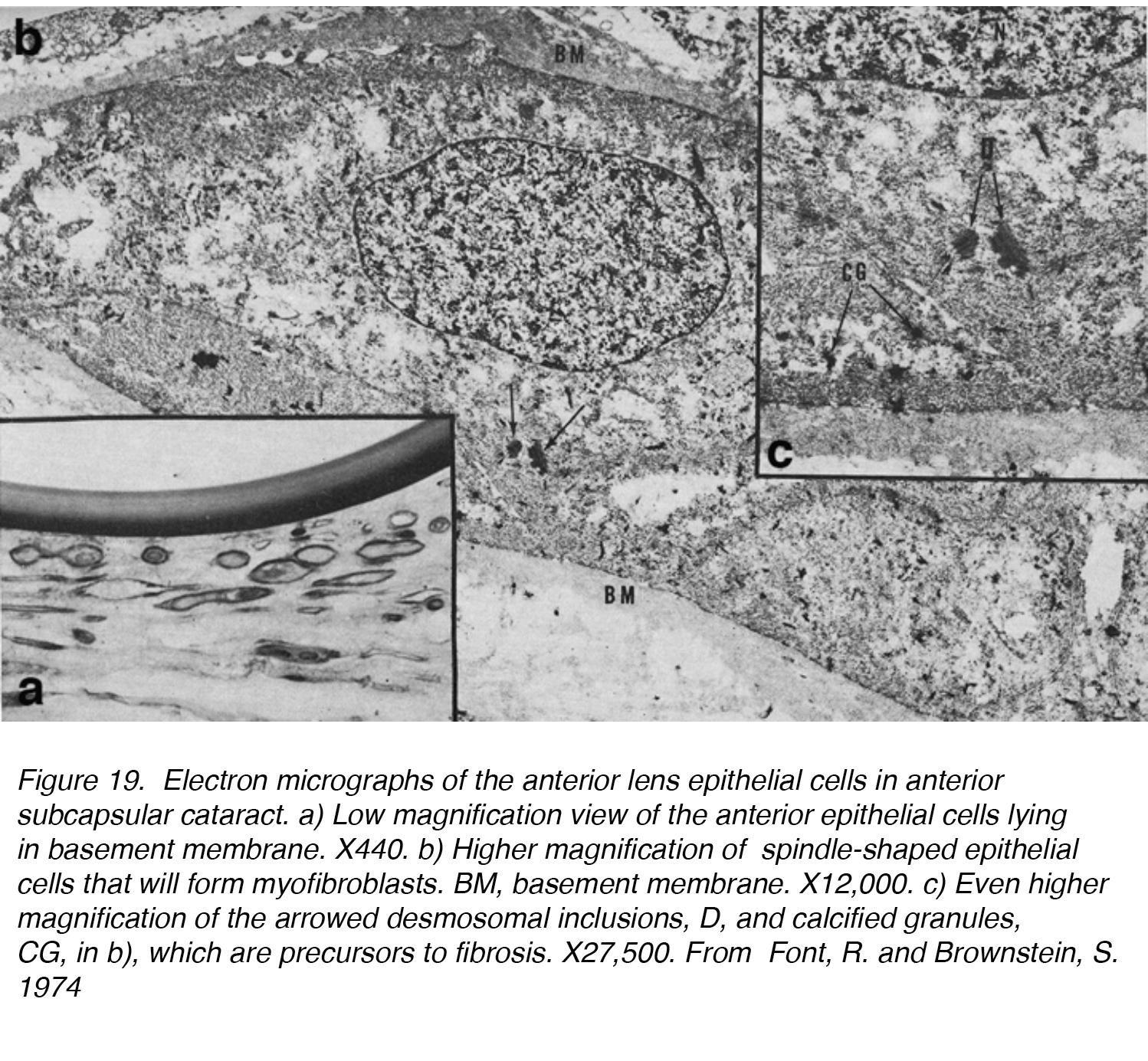
Figura 19. Micrografie elettroniche delle cellule epiteliali della lente anteriore nella cataratta subcapsulare anteriore. a) Visione a basso ingrandimento delle cellule epiteliali anteriori che si trovano nella membrana basale., X440. b) Maggiore ingrandimento delle cellule epiteliali a forma di fuso che formeranno miofibroblasti. BM, membrana basale. X 12.000. c) Ingrandimento ancora più elevato delle inclusioni desmosomiali arrowed, D e granuli calcificati, CG, in b), che sono precursori della fibrosi. X27,500. Da Font, R. e Brownstein, S. 1974.
In uno dei primi studi su ASC, 5 lenti con ASC sono state esaminate mediante microscopia leggera ed elettronica e hanno confermato la capacità dell’epitelio della lente di subire la trasformazione in una placca fibrosa., Le cellule epiteliali della lente hanno perso la loro normale forma cuboidale e si sono allungate in una cellula più a forma di fuso (Fig. 19 bis, lettere b, c). Queste cellule sono state trovate frequentemente per essere in contatto con l’un l’altro, con conseguente placca fibrosa conosciuta come ASC. Questo processo può essere suddiviso in due fasi: una fase proliferativa e una fase degenerativa. La fase proliferativa era più evidente vicino alla periferia della placca, mostrando numerose cellule a forma di fuso e cellule mitoticamente attive. È seguita da una fase degenerativa, che si traduce in una massa ialina quasi struttura-meno con meno cellule a forma di fuso.,
Sebbene la causa di ASC sia varia, è stata ipotizzata un’associazione tra ASC e la formazione di sinechie dopo trauma o infiammazione. Le sinechie si formerebbero fra l’iride posteriore e la capsula anteriore della lente, con conseguente ristagno di umore acqueo e di accumulazione dei metaboliti tossici che potrebbero produrre un effetto tossico sull’epitelio anteriore della lente.
6) CATARATTA TRAUMATICA
La lesione diretta alla testa o agli occhi può causare una significativa interruzione meccanica e portare alla formazione di cataratta., Un anello Vossius può verificarsi se l’insulto ha causato l’epitelio pigmentato dell’iride posteriore per imprimere sulla capsula della lente. La deposizione di pigmento può diminuire e risolvere completamente con il tempo. Una grave lesione smussata può causare opacità lenticolari stellate nella corteccia e nella capsula. Tale insulto può portare a disfunzione dell’epitelio della lente, con conseguente significativa risposta edematosa alla lente corticale superficiale. Le tasche del vacuolo possono quindi rimanere intrappolate permanentemente all’interno della zona lamellare, integrandosi all’interno delle fibre lenticolari mentre il nuovo strato viene elaborato sulla lesione., In alternativa, il trauma contundente può anche causare la formazione di cataratta all’interno di tutti gli strati lenticolari, portando a una metaplasia fibrosa diffusa (Fig. 20). Altre forme di trauma che possono portare alla formazione di cataratta includono l’esposizione a radiazioni, infrarossi, calore estremo e lesioni elettriche.
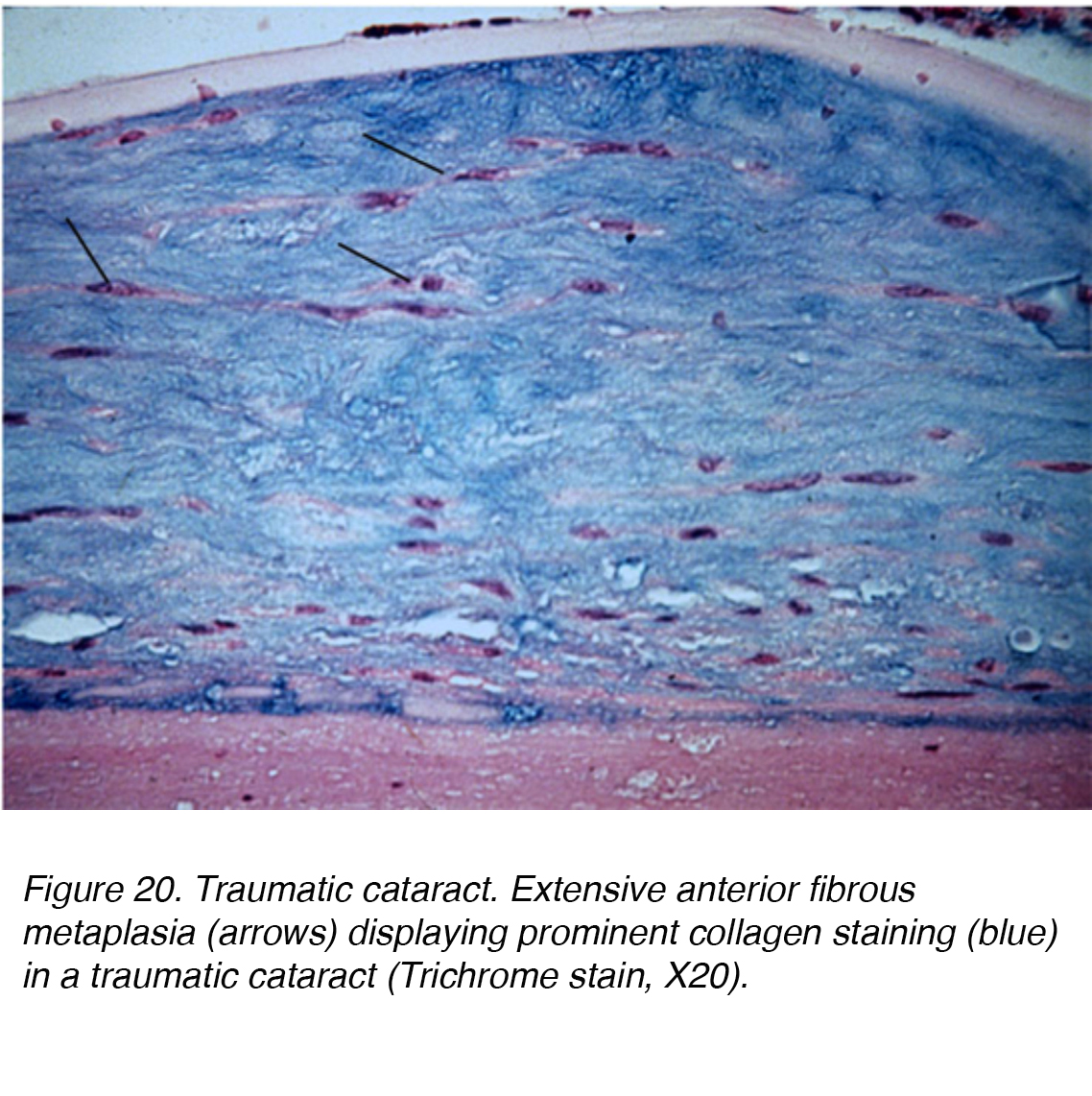
Figura 20. Cataratta traumatica. Estesa metaplasia fibrosa anteriore (frecce) che mostra una colorazione prominente del collagene (blu) in una cataratta traumatica (macchia tricromatica, X20).,
7) CATARATTA INDOTTA DA FARMACI
Diversi agenti farmacologici hanno dimostrato di causare la formazione di cataratta. La terapia a lungo termine del corticosteroide e l’uso dello steroide anabolizzante sono fra gli agenti più comuni connessi con la formazione della cataratta, cataratta subcapsulare particolarmente posteriore. L’incidenza e la gravità del PSC sono direttamente correlate alla dose e alla durata dell’uso. È interessante notare che la terapia steroidea è diventata un’opzione di trattamento frequente nella gestione delle patologie retiniche e, a sua volta, aumenta i tassi di formazione della cataratta., Non sembra esserci alcuna distinzione tra PSC indotta dall’uso di steroidi o un puro PSC correlato all’età. La fenotiazina è un altro agente terapeutico che può causare opacità lenticolari. Gli agenti psicotropi, in particolare la fenotiazina, inducono la deposizione di materiale pigmentato nell’epitelio della lente anteriore in una configurazione assiale molto distinta . Altri agenti farmaceutici noti per causare cataratta lenticolare includono miotici e amiodarone .,
8) ALTRE CAUSE DI CATARATTA
Mentre i cambiamenti legati all’età rimangono il fattore principale per la formazione della cataratta, in particolare la cataratta senile, altri fattori che contribuiscono includono il fumo, la malattia sistemica, l’eccessiva esposizione alla luce solare e gli agenti farmacologici sopra menzionati . Molte malattie sistemiche possono causare cataratta, come diabete mellito, ipocalcemia, distrofia miotonica e malattia di Wilson . Nei pazienti diabetici, corticali e PSC sembrano verificarsi in precedenza, in particolare tra i pazienti con scarso controllo glicemico., La cataratta indotta da ipocalcemia di solito inizia come piccole opacità a punti bianchi che possono fondersi in fiocchi più grandi.
Il fumo, l’esposizione al sole e la gestione delle malattie sistemiche sono fattori di rischio modificabili, quindi l’adozione di misure per modificare questi fattori può ritardare l’insorgenza e la progressione della formazione della cataratta. I fitonutrienti, come i carotenoidi della xantofilla, la luteina e la zeaxantina possono svolgere un ruolo potenziale nel limitare o neutralizzare i cambiamenti ossidativi indotti dalla luce all’interno della lente . Attualmente, ci sono diversi studi in corso che valutano altri possibili agenti protettivi., Anche se non esiste una misura definitiva per prevenire la formazione della cataratta, la chirurgia della cataratta rimane un intervento estremamente sicuro e di grande successo.
CHIRURGIA DELLA CATARATTA
Due video che mostrano le procedure chirurgiche della cataratta dalle viste anteriore e posteriore del segmento anteriore dell’occhio umano.
Dalla vista anteriore (file mp4).
Dalla vista posteriore (file mp4).
La chirurgia per la cataratta ha subito un’ampia evoluzione. La conoscenza antica considerava l’occhio cataratoso come uno squilibrio di umori che necessitava di uno spostamento per recuperare la vista., Usando un ago, il chirurgo procederebbe a spostare l’umore anormale fino a quando il cristallino si dislocò. La moderna chirurgia della cataratta ha subito cambiamenti significativi ed è ora caratterizzata da diverse fasi: incisione corneale, capsulorressia curvilinea continua (CCC), idrodissezione, facoemulsificazione, aspirazione corticale e impianto di lenti intraoculari (IOL).
Un intervento chirurgico precedente per rimuovere l’intera lente cataratta richiedeva un’incisione di 12 mm con successiva chiusura della sutura. Tuttavia, un piccolo 2.4 a 2.,L’incisione corneale chiara larga 8 mm è sufficiente per facilitare l’ingresso del manipolo faco pur rimanendo senza sutura per la chiusura. La tecnica CCC è stata sviluppata da Gimbel e Neuhann negli 1980 e ha veramente rivoluzionato la tecnica di facoemulsificazione . CCC comporta la creazione di una lacerazione nella capsula anteriore poi continuando la lacerazione in modo continuo circolare, riducendo al minimo le forze di taglio esercitate sulle fibre zonulari. Dopo la creazione del CCC, la facoemulsificazione viene utilizzata per frammentare ed emulsionare sia il materiale corticale che quello nucleare., Originariamente introdotta da Kelman nel 1967, la facoemulsificazione rimane una parte vitale della chirurgia della cataratta . L’apertura CCC è abbastanza grande da consentire l’impianto dell’intero ottico e aptico di una lente intraoculare (IOL) all’interno della sacca capsulare della lente residua. L’uso precedente di lenti in polimetilmetacrilato non pieghevoli richiedeva un’incisione corneale chiara relativamente grande per l’impianto. Tuttavia, lo sviluppo del silicone pieghevole e IOL acrilici ha permesso l’inserimento attraverso una piccola incisione per lo più inferiore a 4,0 mm di lunghezza., L’innovazione sta migliorando costantemente queste fasi della chirurgia della cataratta, dai nuovi IOL con un design unico per ridurre al minimo l’incisione corneale, all’uso del laser a femtosecondi per creare un’incisione corneale automatizzata, CCC e frammentare il nucleo prima dell’aspirazione.
I dettagli dei tipi di lenti intraoculari, che vengono attualmente utilizzati nella chirurgia della cataratta, sono presentati nel capitolo seguente in webvision da Jason Nguyen e Liliana Werner.
Sheeladevi et al. 2016. Prevalenza globale della cataratta infantile: una revisione sistematica. Occhio. 30, 9 (2016), 1160–1169.
Birch, E., et al. 2009. Il periodo critico per il trattamento chirurgico della cataratta bilaterale congenita densa. Journal of American Association for Pediatric Ophthalmology and Strabismus. 13, 1 (2009), 67–71.
Holmes, JM e Clarke, MP 2006. Ambliopia. Lancet (Londra, Inghilterra). 367, 9519 (Apr. 2006), 1343–1351.
Streeten, B. W. 1978. Cataratta subcapsulare posteriore umana. Archivi di Oftalmologia. 96, 9 (gen. 1978), 1653.
Urban, R. C. e Cotlier, E. 1986. Cataratta indotta da corticosteroidi. Indagine di oftalmologia. 31, 2 (1986), 102–110.
Kelman, CD 1979., Facoemulsificazione nella camera anteriore. Oculistico. 86, 11 (1979), 1980–1982.
Circa gli autori

Joah F. Aliancy, MD, originario di Haiti, ha ricevuto la sua laurea presso l’Università del Sud della Florida in Chimica con lode distinzione e la sua laurea in medicina presso la Florida State University. Attualmente è un ricercatore di patologia oculare presso il John A. Moran Eye Center. Tra un anno, il Dr. Aliancy parteciperà all’Harkness Eye Institute della Columbia University per la sua formazione di residenza in oftalmologia., I suoi interessi di ricerca includono la nuova tecnologia delle lenti intraoculari, i meccanismi per diminuire l’opacizzazione delle lenti capsulari, la sindrome del segmento anteriore tossico e l’ossido nitrico come modalità di trattamento nella malattia glaucomatosa. Egli è stato onorato con l’induzione in entrambe le società Alpha Omega Alpha e Oro Humanism Honor e destinatario del National Medical Association Rabb-Venable Award. Dr. Aliancy può essere contattato al [email protected]

Nick Mamalis è un professore di Oftalmologia presso il John A., Moran Eye Center dell’Università dello Utah a Salt Lake City, Utah. Ha conseguito la laurea in Biochimica presso l’Università di Harvard e il suo MD presso l’Università dello Utah, School of Medicine. Dopo una borsa di studio in Patologia oftalmica presso l’Università dello Utah ha completato la sua residenza in Oftalmologia presso Loyola University Medical Center. Attualmente è direttore di Patologia oftalmica e co-direttore del Centro di ricerca oculare Intermountain presso l’Università dello Utah., È l’editore del Journal of Cataract and Refractive Surgery, nonché membro del Comitato clinico della cataratta e del comitato esecutivo dell’American Society of Cataract and Refractive Surgery (ASCRS). Il Dr. Mamalis è un ex presidente della Utah Ophthalmology Society. Ha ricevuto l’American Academy of Ophthalmology Honor Award nel 1994, Senior Achievement Award nel 2005 e un Life Achievement Honor nel 2015. È stato il destinatario della Brinkhorst Medal of Honor nel 2013 dall’ASCRS., È conosciuto a livello nazionale e internazionale e ha pubblicato oltre 200 articoli di riviste peer review e ha scritto più libri di testo e capitoli di libri di testo. Dr. Mamalis può essere contattato al [email protected]