Einführung
Mehrere Tierstudien haben jedoch gezeigt, dass CBD umgekehrte U-förmige Dosis-Wirkungs-Kurven erzeugt. Diese Kurven wurden zuerst bei Ratten beschrieben, die im EPM-Modell (Elevated Plus Maze) der Angst getestet wurden (Guimarães et al., 1990). In dieser Studie erhöhte CBD die Erforschung offener Arme (eine anxiolytische Wirkung) in Dosen von 2, 5 bis 10 mg/kg, jedoch nicht bei 20 mg/kg (Guimarães et al., 1990)., Ähnliche glockenförmige Dosis-Wirkungs-Kurven wurden in anderen Studien beschrieben, in denen die Verhaltenseffekte von CBD untersucht wurden. Zum Beispiel verbrachten Zebrafische, die mit 0, 5 mg/kg CBD behandelt wurden, signifikant mehr Zeit in der oberen Zone des Aquariums (was als anxiolytische Wirkung interpretiert wird), während sich das Verhalten von Fischen, die mit den niedrigsten (0, 1 mg/kg) und den höchsten Dosen (5 und 10 mg/kg) behandelt wurden, nicht von Kontrollen unterschied (Nazario et al., 2015). Ein ähnliches Muster wurde auch bei spontan hypertensiven Ratten (SHRs) beobachtet, die einen Schizophrenie-ähnlichen Verhaltensphänotyp aufweisen., Die Präpulsehemmung in diesem Rattenstamm wurde um 30 mg/kg CBD umgekehrt, jedoch nicht um die Dosen von 15 und 60 mg/kg (Levin et al., 2014). Das gleiche wurde mit dem Modell der Reserpin-induzierten kognitiven Beeinträchtigung bei Ratten beobachtet, einem Tiermodell sowohl der Parkinson-Krankheit als auch der tardiven Dyskinesie. Während CBD in der Dosis von 0, 5 mg/kg das Reserpin-induzierte Gedächtnisdefizit bei der diskriminierenden Aufgabe dämpfte, erwies sich die Dosis von 5 mg/kg als unwirksam (Peres et al., 2016).,
Es besteht ein klarer Bedarf, neue Wege zur Behandlung von Angststörungen zu erkunden, da ihre Behandlung problematisch bleibt und in der Regel eine Kombination von Medikamenten, einschließlich Benzodiazepinen und Antidepressiva, umfasst. Diese Medikamente haben ihre Nachteile wie Abhängigkeits-und Entzugssyndrom, sexuelle Nebenwirkungen, kognitive und psychomotorische Beeinträchtigungen, verzögerter Wirkbeginn (Antidepressiva), geringe Akzeptanz und Erfordernis einer sorgfältigen Dosiskontrolle (Katzman et al., 2014; Bandelow et al., 2015; Sgnaolin et al., 2016)., CBD scheint beim Menschen keine signifikanten Nebenwirkungen zu induzieren (Bergamaschi et al., 2011b). Aus einer möglichen therapeutischen Perspektive ist es jedoch wichtig zu bestimmen, ob ein ähnliches umgekehrtes U-förmiges Dosis-Wirkungs-Muster auch beim Menschen vorhanden ist. Um diese Möglichkeit zu untersuchen, haben wir uns für eine der konsistentesten Wirkungen von CBD entschieden, die akute Abnahme der Angst. Dieser Effekt wurde in mehreren Tiermodellen und bei gesunden Freiwilligen und Patienten mit sozialer Angststörung (SAD) beschrieben (Guimarães et al., 1990; Zuardi et al., 1993; Bergamaschi et al., 2011a; Crippa et al.,, 2011); Es wurde jedoch nicht mit mehreren Dosen beim Menschen untersucht.
Eine weit verbreitete Methode zur Induktion experimenteller Angstzustände beim Menschen ist die simulierte öffentliche Sprechaufgabe (SPST-Graeff et al., 2003). Die SPST ist sehr konsistent bei der Erhöhung der selbstbewerteten Angst. Seine Auswirkungen auf physiologische Reaktionen (Herzfrequenz, Blutdruck und Cortisolsekretion) sind jedoch weniger konsistent (Palma et al., 1994; Hetem et al., 1996; de-Paris et al., 2003)., Eine Metaanalyse von 11 Studien, die die SPST verwendeten, bestätigte diese Beobachtung und zeigte einen signifikanten Anstieg der Gesamteffektgröße bei subjektiver Angst, jedoch nicht bei systolischem Blutdruck (SBP) und Herzfrequenz (Zuardi et al., 2013). Spärliche Beweise in der Literatur legen nahe, dass öffentliches Sprechen in einer realen Situation effizienter ist, um physiologische Reaktionen zu verstärken (Turner et al., 1990; Dickerson und Kemeny, 2004). In einer aktuellen Studie haben wir den Test des öffentlichen Sprechens in einer realen Situation (TPSRS) und den SPST verglichen., Die Ergebnisse zeigten, dass beide Methoden bei der Erhöhung der subjektiven Angst wirksam waren, aber nur die TPSRS erhöhten Herzfrequenz, SBP und diastolischen Blutdruck (DBP) (Zuardi et al., 2013).
Die vorliegende Studie wurde daher entwickelt, um die Hypothese zu testen, dass eine Erhöhung der CBD-Dosen bei gesunden Probanden, die dem TPSRS unterzogen wurden, anxiolytische Wirkungen in einem umgekehrten U-förmigen Dosis-Wirkungs-Muster hervorrufen würde.,
Materialien und Methoden
Probanden
Sechzig gesunde Männer und Frauen im Alter von 18 bis 35 Jahren ohne Vorgeschichte vergangener oder aktueller psychiatrischer Erkrankungen, Alkohol-oder anderer Drogenabhängigkeit wurden durch Werbung auf dem Campus der Universität São Paulo in Ribeirão Preto rekrutiert. Teilnehmer mit schwerwiegenden Erkrankungen oder die Medikamente einnahmen, die die Ergebnisse der Studie beeinträchtigen könnten, wurden nicht einbezogen., Die Freiwilligen wurden interviewt, um die Eignung zu beurteilen und ihre Neigung zur Angst durch die Merkmalsversion des Spielberger State-Trait Anxiety Inventory zu messen (STAI – Spielberger et al., 1970). Berechtigte Teilnehmer, die der Teilnahme zustimmten, wurden angewiesen, in der Woche vor den Tests auf Drogen und in den 24 Stunden vor dem Test auf Alkohol und Koffein zu verzichten., Alle Freiwilligen gaben ihre schriftliche Einwilligung zur Teilnahme, nachdem sie vollständig über die Forschungsverfahren informiert worden waren, die den aktuellen Bedingungen der Deklaration von Helsinki entsprachen und von der Ethikkommission des Universitätsklinikums der medizinischen Fakultät Ribeirão Preto (HCRP-Nr.
Die Probanden wurden nach dem Zufallsprinzip fünf Gruppen mit jeweils 12 Probanden zugewiesen, um unterschiedliche Dosen von CBD (100, 300 und 900 mg), Clonazepam (1 mg) oder Placebo in einem doppelblinden, randomisierten Design zu erhalten., Die Gruppen wurden angepasst nach Geschlecht, Alter, body-mass-index (BMI) und STAI-trait-score. Ein Freiwilliger aus der CBD-300-Gruppe konnte aufgrund persönlicher Probleme nicht an der experimentellen Sitzung teilnehmen und wurde aus der Studie zurückgezogen.
Drogen
Cannabidiolpulver mit 99,6% Reinheit (keine anderen Cannabinoide vorhanden), gelöst in Maisöl in Dosen von 100 und 200 mg / ml, wurde freundlicherweise von der Biosynthesis Pharma Group (BSPG-Pharm, UK, UK) bereitgestellt. Die CBD-Lösung, Clonazepam-Tabletten (Rivotril®, Roche Lab) und Placebo (Maisöl) wurden in identischen Gelatinekapseln verpackt., Alle Freiwilligen erhielten fünf Kapseln zu je einem Milliliter in den folgenden Kombinationen: fünf Kapseln Maisöl (Placebogruppe); eine Kapsel CBD 100 mg/ml und vier Kapseln Maisöl (CBD-100-Gruppe); drei Kapseln CBD 100 mg/ml und zwei Kapseln Maisöl (CBD-300 – Gruppe); vier Kapseln CBD 200 mg/ml und eine Kapsel CBD 100 mg/ml (CBD-900-Gruppe); und eine Kapsel mit Clonazepam und vier Kapseln Maisöl (Clonazepam-Gruppe-CLONAZEPAM-Gruppe).)., Jede Behandlung erhielt eine Zufallszahl und sowohl der für die Abgabe der Kapseln zuständige Ermittler als auch der Freiwillige waren sich ihres Inhalts nicht bewusst (doppelblind). Schließlich basierte die Wahl des Intervalls zwischen der Verabreichung des Arzneimittels und dem TPSR auf früheren pharmakologischen Studien, die zeigten, dass die Spitzenplasmakonzentrationen von CBD und CLON, die oral eingenommen wurden, normalerweise zwischen 2 und 3 h nach der Einnahme auftreten (Agurell et al., 1981; Crevoisier et al., 2003; Borgwardt et al., 2008; Fusar-Poli et al., 2009; Martin-Santos et al., 2012)., CBD erfährt einen signifikanten First-Pass-Effekt, der zur Bildung einer Reihe von Metaboliten führt, und seine Halbwertszeit beim Menschen liegt zwischen 2 und 5 Tagen nach oraler Verabreichung. Die Bioverfügbarkeit von oralem CBD beim Menschen liegt bei etwa 6% und stützt somit die Ansicht, dass es einen erheblichen First-Pass-Effekt hat (Zhornitsky und Potvin, 2012). Der mittlere Plasmaspiegel von CBD bei 1, 2 und 3 h nach der akuten Verabreichung von 600 mg betrug 0,36, 1,62 bzw., 2012)., Die Wahl der in dieser Studie verwendeten Dosen basierte auf früheren Nachweisen, die zeigten, dass die akute orale Verabreichung von 300 mg CBD anxiolytische Wirkungen in der SPST hatte (Zuardi et al., 1993).
Psychologische Messungen
Zwei Faktoren der Visual Analog Mood Scale (VAMS), die von Zuardi und Karniol (1981) ins Portugiesische übersetzt und validiert wurden, wurden verwendet, um Angstzustände und beruhigende Wirkungen während des Tests zu bewerten. Das VAMS ist ein selbstverwaltetes Instrument, das aus 16 Elementen besteht. Vor dem TPSRS unterzog sich jeder Freiwillige einer Schulung, um die Skala abzuschließen., Die Probanden wurden gebeten, markieren Sie die Stelle, die seine/Ihre momentanen subjektiven Zustand, der auf einer 100-mm gerade Linie zwischen zwei Wörtern beschreiben, die Stimmung gegenüber Staaten (z.B., entspannt-angespannt). Eine faktorielle Analyse der portugiesischen Version der Skala identifizierte vier Faktoren (Zuardi et al.,, 1993): (1) „Angst“, bestehend aus den Artikeln calm–excited, relaxed–tense und tranquil–troubled; (2) „Sedierung“, einschließlich der Artikel Alert–schläfrig und aufmerksam–verträumt; (3) „kognitive Beeinträchtigung“, einschließlich schlagfertig-geistig langsam, kompetent–inkompetent, energisch–lethargisch, klarköpfig–muzzy, gesellig-zurückgezogen, gut koordiniert–ungeschickt und stark–schwach; und (4) „Unbehagen“, einschließlich der Artikel interessiert-gelangweilt, glücklich–traurig, zufrieden–unzufrieden und gütlich–antagonistisch (Parente et al., 2005). Seit früheren Studien mit beiden anxiogenen (Crippa et al., 2004; Parente et al.,, 2005) und Anxiolytika einschließlich CBD (Crippa et al., 2004, 2011; Bergamaschi et al., 2011a) haben gezeigt, dass sich nur die Angst-und Sedierungsfaktoren während öffentlicher Sprechaufgaben ändern, wir haben nur die Elemente dieser Faktoren der VAMS verwendet, um die Verwaltungszeit zu verkürzen und die Ausführung des Protokolls zu ermöglichen. Dieses Verfahren wurde zuvor in der Validierungsstudie des PSRST (Zuardi et al., 2013).
Physiologische Messungen
Systolischer Blutdruck, DBP und Herzfrequenz (HR) wurden mit einem digitalen Blutdruckmessgerät (Omron, Brasilien) gemessen.,
Test des öffentlichen Sprechens in einer realen Situation (TPSRS)
Bei diesem Verfahren muss jedes Subjekt vor einer Gruppe sprechen und in derselben experimentellen Sitzung am Publikum teilnehmen, wenn die anderen Mitglieder der Gruppe sprechen. Das Publikum wird angewiesen, während der Reden still und neutral zu bleiben.
Es wurden fünf experimentelle Sitzungen mit jeweils 12 Probanden durchgeführt (mit Ausnahme von 1, an denen 11 Probanden teilnahmen). Zu Beginn der Sitzung wurden die Freiwilligen über die Anzahl der Behandlungen informiert, die sie erhalten würden (wie oben beschrieben)., Die Freiwilligen wurden dann angewiesen, mit ihren jeweiligen Behandlungsnummern gekennzeichnete Plätze einzunehmen. Die Sitze waren so nummeriert, dass am Ende der fünf Sitzungen die Probanden jeder Behandlungsgruppe alle möglichen Positionen besetzt hatten. Die Abfolge der Prozeduren folgte immer der gleichen Reihenfolge vom ersten bis zum zwölften Stuhl, um einen möglichen Ordnungseffekt in der Abfolge der Sprecher zu minimieren., Zum Beispiel besetzten Themen in der CBD-300-Gruppe die folgenden Positionen: erste Sitzung-3, 8; zweite Sitzung-4, 9; dritte Sitzung-5, 10; vierte Sitzung-1, 6, 11; fünfte Sitzung – 2, 7, 12.
Verfahren
Freiwillige begannen die experimentelle Sitzung nach mindestens 6 Stunden Schlaf und 2 Stunden nach dem Verzehr eines Standardfrühstücks (200 ml Schokoladenmilch und 100 g Brot mit Margarine).,
Die 12 Freiwilligen saßen auf halbkreisförmig angeordneten Stühlen, die einer vorgegebenen Reihenfolge durch die jedem von ihnen zugewiesene Behandlungsnummer folgten, und führten die Basismessungen durch, gefolgt von der Einnahme der fünf Kapseln innerhalb eines 5-Minuten-Intervalls für jeden Freiwilligen. Diese Phase wurde über einen Zeitraum von 1 h abgeschlossen. Die Freiwilligen sahen sich dann einen Film über Vögel des Amazonaswaldes an, der etwa 20 min dauerte. Danach wurden die Messungen mit einem Intervall von 5 min für jedes Subjekt wiederholt (Pretest-Maßnahme)., 2 h und 20 min nachdem der erste Freiwillige die Behandlung erhalten hatte, sahen sie sich alle ein etwa 10 min dauerndes Video mit aufgezeichneten Anweisungen für den Sprachtest an. 2 h und 30 min nachdem der erste Freiwillige die Behandlung erhalten hatte, begannen sie mit der Durchführung des Sprachtests, der 5 min dauerte. Anschließend wurden die anderen Freiwilligen in der gleichen Reihenfolge, in der sie die Behandlungen erhalten hatten, dem Sprachtest unterzogen., Der Sprachtest bestand darin, stillschweigend eine 1-minütige Rede zu einem Thema vorzubereiten, das sich auf „die Bedingungen eines öffentlichen Dienstes Ihrer Stadt“ bezieht, zufällig aus 12 Optionen ausgewählt und unmittelbar vor der Sprachvorbereitung enthüllt wurde. Die vorbereitete Rede wurde dann für 2 Minuten präsentiert, wobei die anderen Teilnehmer und die Ermittler als Publikum dienten. Die Rede wurde auf halbem Weg für die Messungen unterbrochen., Die Abfolge der Verfahren in dieser Phase war wie folgt: (a) Sitzen auf einem vor anderen angeordneten Stuhl; (b) Auswählen des Sprachthemas; (c) Nachdenken über das Thema für 1 Minute; (d) Starten der Rede, die nach 1 Minute unterbrochen wurde; (e) Ausfüllen der Selbstbewertungsskala (VAMS Angst-und Sedierungsfaktoren) und physiologische Messungen; (f) Fortsetzung der Rede für eine weitere Minute. Diese Sequenz dauerte höchstens 5 Minuten, so dass nach 1 Stunde alle Freiwilligen das Verfahren durchlaufen hatten. Die letzte Phase der Studie begann 216 min, nachdem der erste Freiwillige das Medikament eingenommen hatte., Alle Messungen wurden wiederholt, wobei das 5-Minuten-Intervall für jeden Freiwilligen beibehalten wurde. Tabelle 1 gibt einen Überblick über das Versuchsverfahren.

TABELLE 1. Zeitplan der experimentellen Sitzung.
Statistische Analyse
Klinische und demografische Merkmale wurden mit nichtparametrischen Tests (Geschlecht) und einer Ein-Faktor-Varianzanalyse (ANOVA; Alter, BMI und STAI-Merkmal) analysiert.,
Die Werte in den beiden Faktoren der VAMS, arterieller systolischer und diastolischer Druck und Herzfrequenz, wurden mit einer Varianzanalyse mit wiederholten Messungen (ANOVA mit wiederholten Messungen) einschließlich der Faktoren „Phase“, „Gruppen“ und „Phase-Gruppen-Interaktion“ analysiert. In Fällen, in denen Sphärizitätsbedingungen nicht erreicht wurden, wurden die Freiheitsgrade des Wiederholungsfaktors mit dem Huynh-Feldt-Epsilon korrigiert. Vergleiche zwischen den Gruppen wurden in jeder Phase mit einer Ein-Faktor-ANOVA durchgeführt, gefolgt von mehreren Vergleichen mit dem Student-Newman-Keuls-Test.,
Daten-Analyse wurde mit dem Statistical Package for the Social Sciences (SPSS), version 17, und das Signifikanzniveau angenommen wurde p < 0.05.
Ergebnisse
Die demografischen und klinischen Merkmale der Probanden sind in Tabelle 2 dargestellt. Die Gruppen unterschieden sich nicht signifikant in Bezug auf Geschlecht, Alter, BMI und STAI-trait erzielt.

TABELLE 2. Demografische und klinische Merkmale der Gruppen.,
Die wiederholte Messung ANOVA der Werte im Angstfaktor der VAMS zeigte einen signifikanten Effekt der Phase (F3,162 = 60.24; p < 0.001), Gruppe (F4,54 = 3.25; p = 0.018) und Phase-Gruppen-Interaktion (F12, 162 = 3.79; p < 0,001,Abbildung 1A). Post-hoc-Vergleiche zwischen den Gruppen in jeder Phase zeigten signifikante Unterschiede (p < 0.05) zwischen PLAC und CLON in der Sprach-und Post-Stress-Phase., Die Scores der CBD-300-Gruppe unterschieden sich signifikant von denen der CBD-900-Gruppe in der Sprachphase und von denen der PLAC-und CBD-100-Gruppen während der Post-Stress-Phase (p < 0.05). Zur Veranschaulichung zeigt Abbildung 1B die umgekehrte U-förmige Dosis-Wirkungs-Kurve, die durch CBD in der Post-Stress-Phase induziert wird. In Bezug auf den Sedierungsfaktor der VAMS zeigten die ANOVA mit wiederholten Messungen signifikante Effekte der Phase (F2.16,116.7 = 3.11; p = 0.028) und der Gruppe (F4, 54 = 3.48; p = 0.013,Abbildung 2A)., Ein allgemeiner Post-hoc-Vergleich unter den Gruppen zeigte, dass Clonazepam im Vergleich zu den anderen Gruppen eine höhere sedierende Wirkung induzierte (Hauptwirkung der Behandlung). Ein ähnlicher Effekt wurde in der Post-Stress-Phase beobachtet (p < 0.05).
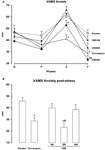
ABBILDUNG 1. Veränderungen in den Scores des Angstfaktors der Visual Analog Mood Scale (VAMS) (mm), die durch öffentliches Sprechen bei gesunden Freiwilligen (A) während der at Baseline (B) und während der Pre-Stress (P), Speech (S) und Post-Stress (F) Phasen (A) induziert werden., Zur Verdeutlichung werden die Ergebnisse der letzten Phase (F) auch als Balkendiagramm (B) dargestellt. Punkte stellen die Mittel ± SEM von 11-12 Probanden dar. Sternchen ( ∗ ) weisen auf statistisch signifikante Unterschiede zur Placebo-Gruppe hin, ( + ) auf einen signifikanten Unterschied zur CBD-900-Gruppe und (&) auf einen signifikanten Unterschied zur CBD-100-Gruppe.
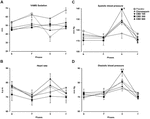
ABBILDUNG 2., Veränderungen des Sedierungsfaktors der VAMS (mm, A), der Herzfrequenz , des systolischen (C) und des diastolischen (D) Blutdrucks (mm Hg), die durch öffentliches Sprechen bei gesunden Freiwilligen induziert werden. Punkte stellen die Mittel ± SEM von 11-12 Probanden dar. Sternchen ( ∗ ) zeigen statistisch signifikante Unterschiede im Vergleich zu den anderen Gruppen an (&) zeigt einen signifikanten Unterschied im Vergleich zu Clonazepam an und ( $ ) zeigt einen signifikanten Unterschied im Vergleich zur CBD-100-Gruppe an.,
Wir haben die TPSR experimentell verwendet, um Angstzustände zu induzieren, und untersucht, ob die anxiolytische Wirkung von CBD beim Menschen eine umgekehrte U-förmige Dosis-Wirkungs-Kurve erzeugt. In Zeile bisherigen Beweise (Zuardi et al., 2013), erhöhte dieses Protokoll die subjektive Angst, den Blutdruck und die Herzfrequenz signifikant, wie der signifikante Effekt der Phase in einer ANOVA mit wiederholten Messungen zeigt., Darüber hinaus war das TPSRS empfindlich beim Nachweis der anxiolytischen Wirkung von Clonazepam, einem bekannten Anxiolytikum, was darauf hindeutet, dass es zur Identifizierung potenziell anxiolytischer Arzneimittel verwendet werden kann.
In der Dosis von 300 mg verringerte CBD die subjektive Angst im Vergleich zur PLAC-Gruppe während der Post-Speech-Phase des Protokolls signifikant. Das gleiche galt jedoch nicht für eine niedrigere (100 mg) oder höhere (900 mg) Dosis des Arzneimittels., Darüber hinaus unterschieden sich die subjektiven Angstwerte der CBD-300-Gruppe signifikant von denen der CBD-900-Gruppe während der Sprachphase und der CBD-100-Gruppe während der Post-Speech-Phase. Diese Ergebnisse legen nahe, dass die akute anxiolytische Wirkung von CBD einer umgekehrten U-förmigen Dosis-Wirkungs-Kurve folgte, die mit Ergebnissen aus Tierversuchen übereinstimmt (Guimarães et al., 1990; Levin et al., 2014; Nazario et al., 2015; Peres et al., 2016). Interessanterweise reduzierte die gleiche CBD-Dosis, die anxiolytische Wirkungen hervorrief (300 mg), systolisch und DBP nicht wie Clonazepam., Diese Dissoziation zwischen anxiolytischen und sympathoinhibitorischen Wirkungen nach akuter Verabreichung von CBD stimmt mit unseren Beobachtungen unter Verwendung der SPST bei gesunden Freiwilligen überein (Zuardi et al., 1993) und bei Patienten mit sozialer Phobie (Bergamaschi et al., 2011a).
Der Mechanismus, der diesem Muster der Dosis-Wirkungs-Wirkung von CBD zugrunde liegt, kann noch nicht vollständig erklärt werden. Beim Menschen scheinen limbische und paralimbische Hirnareale an der anxiolytischen Wirkung von CBD beteiligt zu sein., Zum Beispiel zeigten Studien mit Einzelphotonenemissions-Computertomographie (SPECT) bei gesunden Freiwilligen und drogenabhängigen Patienten mit SAD die Beteiligung derselben Bereiche, die an der anxiolytischen Wirkung von CBD 400 mg beteiligt waren, nämlich des linken Parahippocampus-Gyrus und des linken Amygdala-Hippocampus-Komplexes (Crippa et al., 2004, 2011). Unter Verwendung der funktionellen Magnetresonanztomographie (fMRI) bei gesunden Freiwilligen fanden die Forscher heraus, dass CBD 600 mg die Aktivierung in der Amygdala und im vorderen cingulären Kortex während der Erkennung ängstlicher Gesichtsausdrücke abschwächte (Fusar-Poli et al., 2009)., Die Autoren erklärten weiter, dass diese Wirkung von CBD durch Veränderungen der subkortikalen präfrontalen Konnektivität über Amygdala und anterioren cingulären Kortex vermittelt wurde (Fusar-Poli et al., 2010).
Trotz der Identifizierung von Hirnarealen, die an der anxiolytischen Wirkung von CBD beteiligt sein können, bleibt der spezifische pharmakologische Mechanismus, der für diesen Effekt verantwortlich ist, zu klären., CBD ist ein Medikament mit mehreren pharmakologischen Zielen, einschließlich der Wechselwirkung mit mehreren Rezeptoren (CB1, CB2, GPR55, TRPV1 und 5-HT1A), Störungen der Aufnahme und des Metabolismus von Endocannabinoiden und Erhöhung der Hippocampusneurogenese im erwachsenen Gehirn (Zuardi et al., 2017). Mehrere Studien haben die Beteiligung von 5-HT1A-Rezeptoren an der akuten anxiolytischen Wirkung von CBD unterstützt., Zum Beispiel wird die anxiolytische Wirkung, die durch systemische oder intra-dorsale periaqueduktale Gray (DPAG)-Injektionen von CBD bei Ratten induziert wird, durch einen 5-HT1A-Rezeptorantagonisten verhindert (Campos und Guimarães, 2008; Soares et al., 2010). Eine ähnliche Wechselwirkung zwischen CBD – und 5-HT1A-Rezeptoren in anderen Gehirnstrukturen im Zusammenhang mit der Kontrolle angstähnlicher Verhaltensweisen, wie dem Bettkern der Stria terminallis oder dem prelimbischen frontalen Kortex, ist ebenfalls an der Abschwächung von Angstreaktionen beteiligt (Gomes et al., 2011, 2012; Fogaça et al., 2014)., In kultivierten Zellen wurde berichtet, dass CBD als 5-HT1A-Rezeptoragonist wirkt (Russo et al., 2005), obwohl neuere Studien darauf hindeuten, dass dies unter klinischen oder In-vivo-Bedingungen nicht der Fall ist. Die Erleichterung der 5-HT1A-vermittelten Neurotransmission durch CBD scheint keine Blockade der 5-HT-Wiederaufnahme oder Veränderungen der 5-HT1A-mRNA-Expression im DPAG nach chronischer CBD-Verabreichung zu beinhalten (Campos et al., 2013). Diese Beobachtungen legen nahe, dass die Modulation von 5-HT1A-Rezeptoren durch CBD komplex ist und allosterische Wechselwirkungen beinhalten könnte (Rock et al., 2011).,
Wie bereits erwähnt, sind die Mechanismen, die für die umgekehrte U-förmige Dosis-Wirkungs-Kurve von CBD verantwortlich sind, wenig verstanden. Sie könnten Wechselwirkungen mit dem Vanilloidrezeptor 1 oder TRPV1 beinhalten. Bei hohen Konzentrationen kann CBD diese Rezeptoren aktivieren und Glutamatfreisetzung und Abwehrreaktionen erleichtern (Guimarães et al., 1991; Campos und Guimarães, 2009). Dieser Mechanismus könnte die durch 5-HT1A-Rezeptoren vermittelte anxiolytische Wirkung von CBD maskieren., Das Testen dieser Möglichkeit unter Verwendung von Intra-DPAG-Injektionen bei Ratten, Campos und Guimarães (2009) zeigte, dass die Vorbehandlung mit einem TRPV1-Antagonisten (Capsazepin) eine höhere und ineffektive CBD-Dosis in eine anxiolytische Dosis verwandelte. Es bleibt zu prüfen, ob ein ähnlicher Mechanismus auch an der in unserer Studie beobachteten U-förmigen Dosis-Wirkungs-Kurve beteiligt ist. Im Einklang mit früheren Beweisen, die darauf hindeuten, dass CBD im Vergleich zu Benzodiazepinen schwächere sedative Eigenschaften aufweist (Zuardi et al., 1993) induzierte die anxiolytische Dosis von CBD (300 mg) ein signifikant niedrigeres Sedierungsniveau als Clonazepam., Es ist ein Vorteil, der hervorgehoben werden muss, da Sedierung und motorische Koordinationsstörungen neben potenziellen Abhängigkeiten, kognitiven Defiziten und Entzugserscheinungen insbesondere im Alter zu den häufigsten Nebenwirkungen von Benzodiazepinen gehören (Sgnaolin et al., 2016). Diese Nebenwirkungen wurden bei der Anwendung von CBD nicht beobachtet (Bergamaschi et al., 2011b).
Die Ergebnisse müssen mit Vorsicht interpretiert werden, angesichts der Einschränkungen unserer Studie., Erstens wäre es wünschenswert gewesen, die Plasmaspiegel von CBD und Clonazepam zu messen und diese Messungen mit dem Ausmaß der Angstzustände in Beziehung zu setzen; Ohne eine Dosis-Wirkungs-Kurve bleiben Zweifel, ob die Wirkungen von CBD tatsächlich einer umgekehrten U-förmigen Kurve folgen. Es ist jedoch anzumerken, dass frühere Untersuchungen keinen direkten Zusammenhang zwischen den CBD-Plasmaspiegeln und ihren klinischen Wirkungen herstellen konnten (Agurell et al., 1986). Darüber hinaus begrenzt die geringe Stichprobengröße die statistische Leistung der Studie., Das Studiendesign erlaubt es uns auch nicht, die Möglichkeit auszuschließen, dass eine andere moderate Dosis (z. B. 400 oder 600 mg) noch größere anxiolytische Wirkungen gehabt haben könnte. Zum Beispiel haben frühere Studien akute anxiolytische Wirkungen von 400 mg CBD in SPECT-Studien an gesunden Freiwilligen gezeigt (Crippa et al., 2004) und bei Patienten mit sozialer Phobie (Crippa et al. 2011) und von CBD 600 mg in einem fMRT-experiment mit gesunden Männern (Bhattacharyya et al., 2010)., Obwohl für diese Proof-of-Concept-Studie nicht erforderlich, könnten diese Einschränkungen in zukünftigen Studien überwunden werden, in denen weitere 2-3 Dosen zwischen 300 und 900 mg untersucht werden, um einen echten therapeutischen Index zu ermitteln.
Schlussfolgerung
Unsere Ergebnisse stimmen mit den Beweisen aus präklinischen Studien überein und stützen die Ansicht, dass CBD beim Menschen akute anxiolytische Wirkungen mit einer umgekehrten U-förmigen Dosis-Wirkungs-Kurve induziert. Diese Ergebnisse betonen die Bedeutung der sorgfältigen Auswahl der Dosisbereiche bei der Untersuchung der potenziellen therapeutischen Wirkungen von CBD., Weitere Studien zur Beurteilung der Dosis-Wirkungs-Kurve von CBD bei anderen Erkrankungen wie Schizophrenie, Schmerzen, Epilepsie und Parkinson sowie zur chronischen Verabreichung von CBD sind erforderlich, um präklinische Beweise in die klinische Praxis umzusetzen und das genaue therapeutische Fenster von CBD für jede Erkrankung zu bestimmen.
Autor Beiträge
AZ, JH, und JC die Studie konzipiert. NR, AS und SB führten die Experimente durch. AZ und FG führten die statistische Auswertung durch. Die AZ hat den ersten Entwurf des Manuskripts verfasst., Alle Autoren trugen zum endgültigen Manuskript bei und hatten es genehmigt.
Interessenkonflikterklärung
AZ, JH, FG und JC sind Miterfinder (Mechoulam R, JC, Guimaraes FS, AZ, JH, Breuer A) des Patents „Fluorierte CBD-Verbindungen, Zusammensetzungen und Verwendungen davon. Pub. Nein.: WO / 2014 / 108899. Internationale Anwendung Nr.: PCT/IL2014/050023″Def. UNS nicht. Reg. 62193296; 29/07/2015; INPI am 19/08/2015 (BR1120150164927). Die Universität São Paulo hat das Patent an Phytecs Pharm lizenziert (USP Resolution No. 15.1.130002.1.1)., Die Universität São Paulo hat eine Vereinbarung mit Prati-Donaduzzi (Toledo, Brasilien) getroffen, um „ein pharmazeutisches Produkt zu entwickeln, das synthetisches Cannabidiol enthält und seine Sicherheit und therapeutische Wirksamkeit bei der Behandlung von Epilepsie, Schizophrenie, Parkinson und Angststörungen nachweist.“JH und JC haben Reiseunterstützung von BSPG-Pharm erhalten.
Die anderen Autoren erklären, dass die Forschung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.,
Die Reviewer RWG, KA und Handling Editor erklärten ihre gemeinsame Zugehörigkeit, und der Handling Editor stellt fest, dass der Prozess dennoch den Standards einer fairen und objektiven Überprüfung entsprach.
Anerkennungen
AZ, JH, FG und JC sind Stipendiaten des Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, Brasilien). Die vorliegende Studie wurde durch ein CNPq – Stipendium (CNPq/MS/SCTIE/DECIT N∘ 26/2014-Pesquisas sobre Distúrbios Neuropsiquiátricos; 466805/2014-4) unterstützt und BSPG-Pharm (Sandwich, UK) hat CBD freundlicherweise kostenlos zur Verfügung gestellt.,
Campos, A. C., und Guimarães, F. S. (2008). Beteiligung von 5HT1A-Rezeptoren an den anxiolytisch-ähnlichen Wirkungen von Cannabidiol, das in das dorsolaterale periaqueduktale Grau von Ratten injiziert wird. Psychopharmakologie (Berl) 199, 223-230. doi: 10.1007/s00213-008-1168-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Campos, A. C., und Guimarães, F. S. (2009). Evidenz für eine mögliche Rolle von TRPV1-Rezeptoren in der dorsolateralen periaqueduktalen Phase bei der Abschwächung der anxiolytischen Wirkungen von Cannabinoiden. Progrock., Neuropsychopharmacol. Biol. Psychiatry 33, 1517–1521. doi: 10.1016/j.pnpbp.2009.08.017
PubMed Abstract | CrossRef Full Text | Google Scholar