cristallin et cataracte
Joah F. Aliancy, MD et Nick Mamalis, MD
INTRODUCTION
le cristallin de l’œil est une structure intraoculaire biconvexe, relativement acellulaire, optiquement transparente qui, avec la cornée, sert à transmettre la lumière à la rétine avec diffusion (fig. 1a). Les premiers anatomistes considéraient la lentille comme l’emplacement d’une visualisation significative., Nous savons maintenant que c’est la fonction de la rétine, la lentille servant de conduit de transmission de la lumière et de mise au point vers la rétine. La lentille peut changer de forme à l’aide des muscles ciliaires, modifiant ainsi la distance focale par rapport à la rétine et mettant l’image au point sur la rétine. Ce réglage de l’objectif est appelé accommodation (similaire à la mise au point d’un appareil photographique via le mouvement de ses objectifs). Le cristallin est plus plat sur sa face antérieure que sur sa face postérieure. (Figue. 1b).
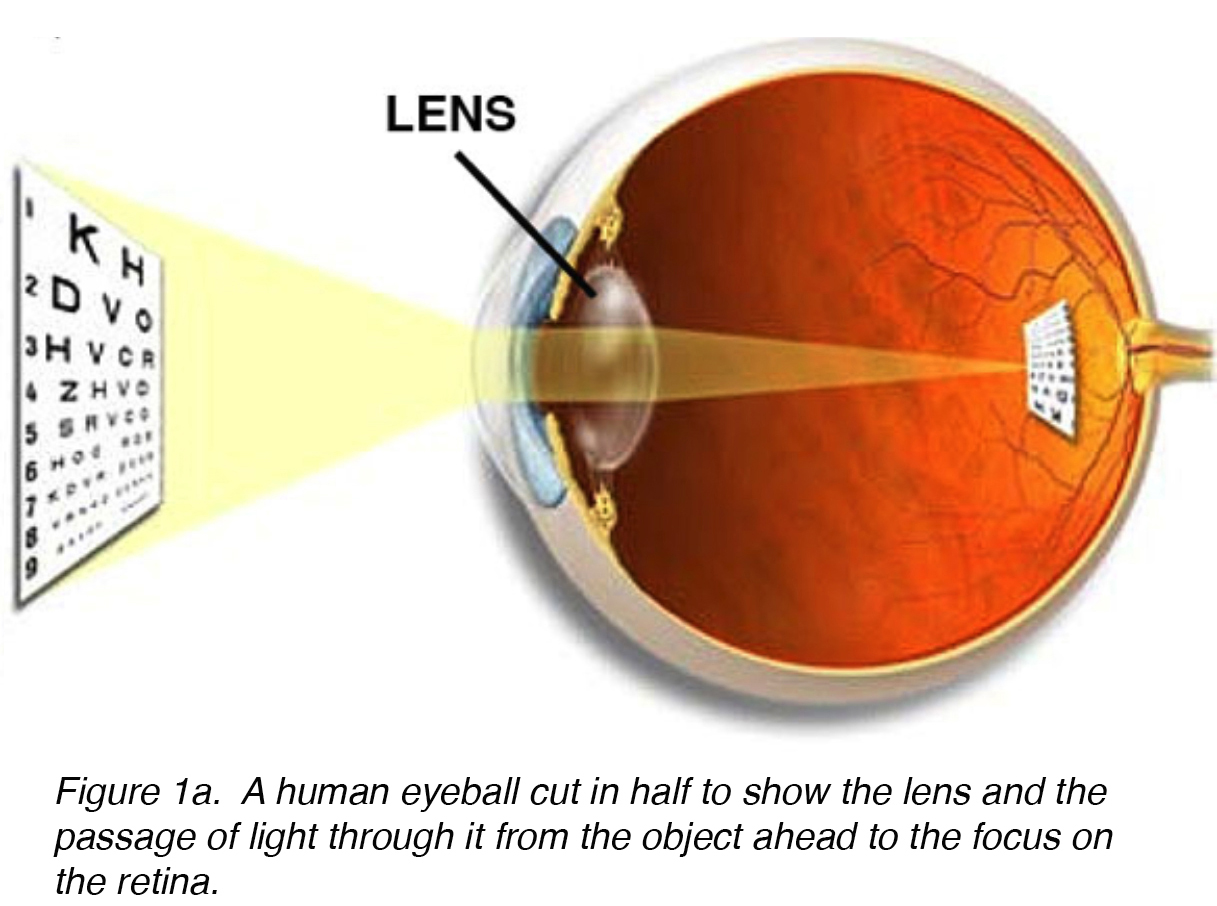
la Figure 1a., Un globe oculaire humain coupé en deux pour montrer la lentille et le passage de la lumière à travers elle de l’objet en avant à la mise au point sur la rétine.
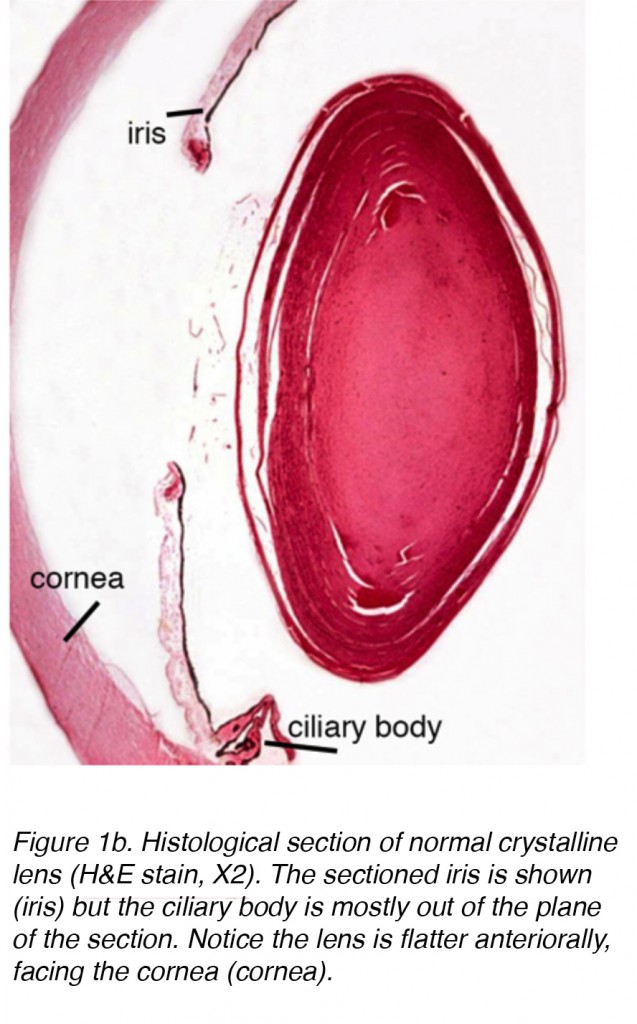
la Figure 1b. Coupe histologique de la normale cristallin (H&E tache, X2). L’iris sectionné est représenté (iris) mais le corps ciliaire est la plupart du temps hors du plan de la section. Remarquez que la lentille est plus plate en avant, face à la cornée (cornée).,
développement de la lentille
la lentille mature provient de l’ectoderme de surface et se développe par un processus hautement organisé corrélé à la couche de cellules germinales du neuroectoderme. Au début de l’embryogenèse, le diencéphale, tissu dérivé du neuroectoderme, forme deux éruptions appelées vésicules optiques. Les vésicules optiques induisent la formation des cellules lenticulaires immatures lorsqu’elles entrent en contact avec l’ectoderme de surface. Les cellules lenticulaires immatures s’épaississent pour former le placode de la lentille. Simultanément, les vésicules optiques s’invaginent provoquant une indentation sur le placode de la lentille appelée fosse de la lentille (Fig., 2a).
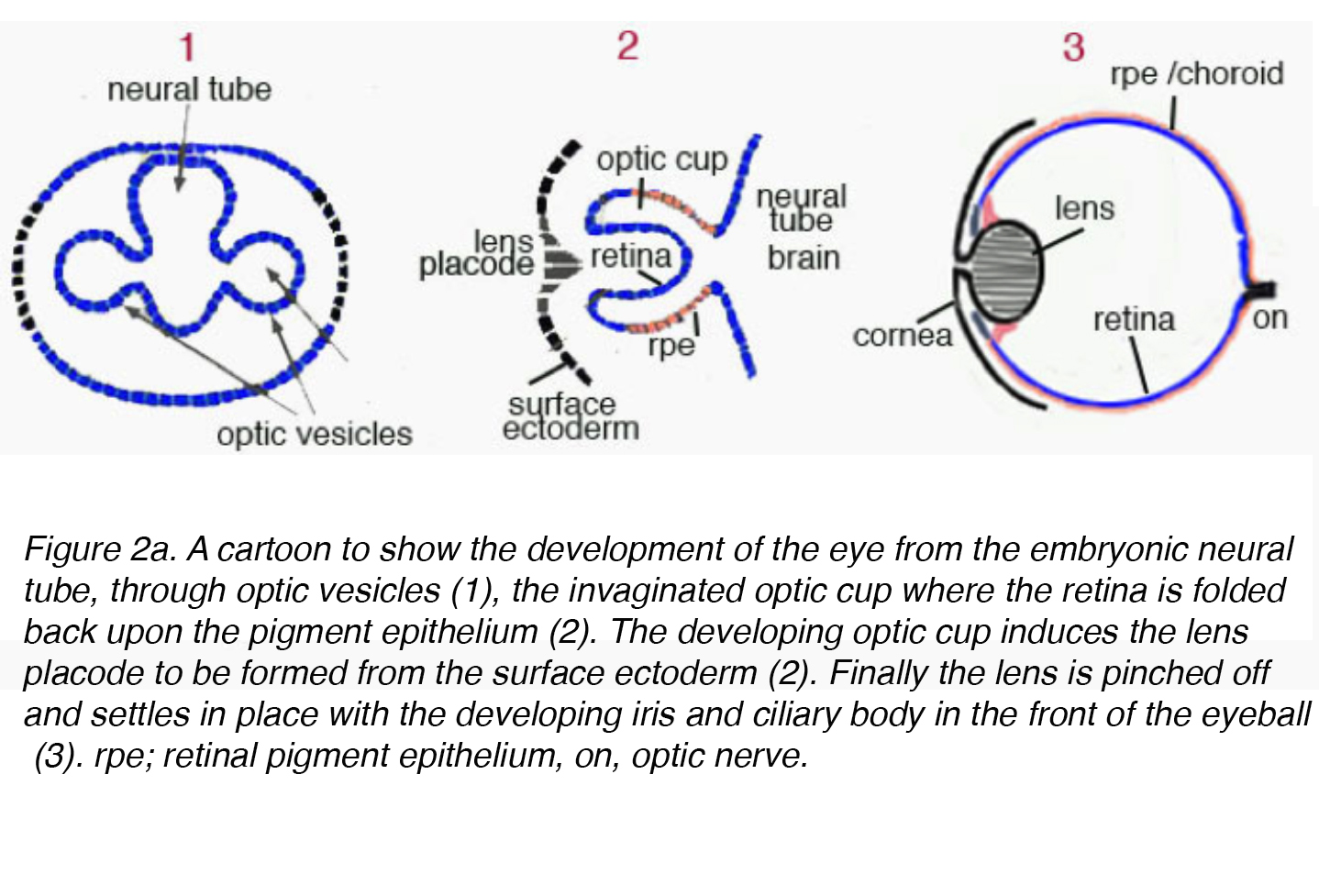
Figure 2a. dessin animé pour montrer le développement de l’œil à partir du tube neural embryonnaire, à travers les vésicules optiques (1), la coupe Optique invaginée où la rétine est repliée sur l’épithélium pigmentaire (2). La coupelle optique en développement induit la formation du placode de la lentille à partir de l’ectoderme de surface (2). Enfin, la lentille est pincée et se dépose en place avec l’iris en développement et le corps ciliaire à l’avant du globe oculaire (3). EPR; épithélium pigmentaire rétinien, on, nerf optique.,
à ce stade, la vésicule cristalline est constituée d’une seule couche de cellules enveloppées dans une membrane basale externe. Cette membrane basale finira par former la capsule de la lentille. Alors qu’elles sont enfermées dans la membrane basale, les cellules du pôle postérieur de la vésicule de la lentille s’étendent vers l’avant pour former les fibres primaires de la lentille (Fig. 2a)
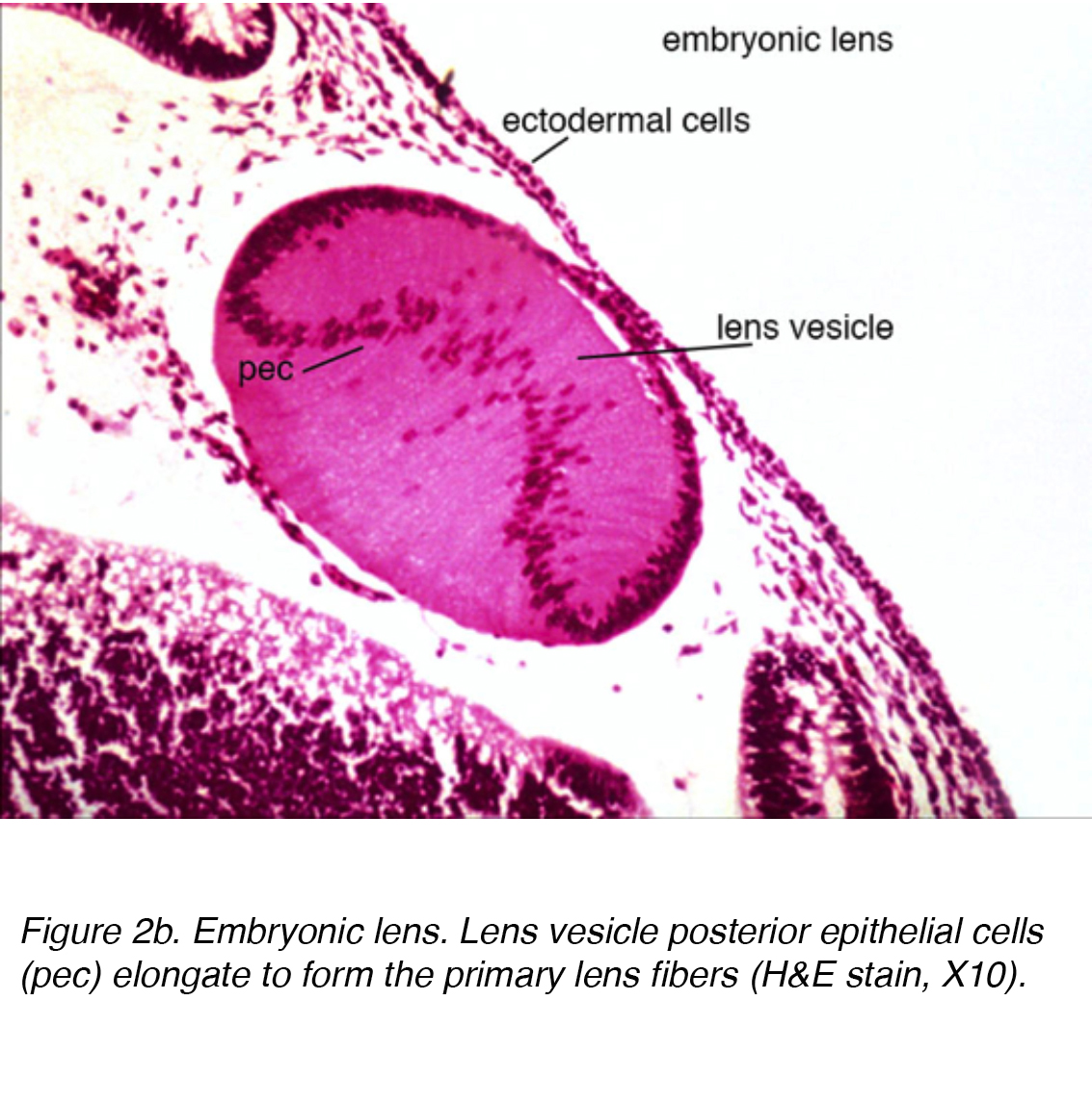 Figure 2b. lentille embryonnaire. Les cellules épithéliales postérieures de la vésicule cristalline (CEP) s’allongent pour former les fibres primaires de la lentille (h&e stain, X10).,
Figure 2b. lentille embryonnaire. Les cellules épithéliales postérieures de la vésicule cristalline (CEP) s’allongent pour former les fibres primaires de la lentille (h&e stain, X10).,
Les cellules antérieures deviennent les cellules épithéliales de la lentille, tandis que les fibres primaires de la lentille forment collectivement le noyau embryonnaire. Par la suite, les fibres secondaires de la lentille commencent à s’allonger à partir des cellules épithéliales de la lentille pour former le noyau fœtal pendant la période de gestation et continuent de croître en plusieurs couches. À mesure que les fibres de lentilles secondaires s’allongent à partir de l’Équateur, elles forment des sutures en forme de Y en se rencontrant antérieurement et postérieurement pendant la croissance fœtale. Les fibres de lentilles secondaires finissent par se développer pour former le noyau adulte avec de nouvelles couches de fibres de lentilles formant le cortex lenticulaire., Au cours du développement lenticulaire, l’artère hyaloïde fournit des facteurs de nutrition et de croissance à travers les lentilles tunica vasculosa, une structure vasculaire qui enveloppe le noyau de la lentille. Cependant, cette structure subit une involution avant la naissance pour ressembler à la lentille avasculaire observée chez l’adulte. Une bonne compréhension de l’embryologie et du développement du cristallin permettra de mieux comprendre la pathologie associée à la formation de la cataracte.,
histologie de la lentille
La Figure 3 montre une section colorée de la lentille humaine adulte avec la partie antérieure de la lentille dans la section supérieure et la partie postérieure dans la section inférieure.
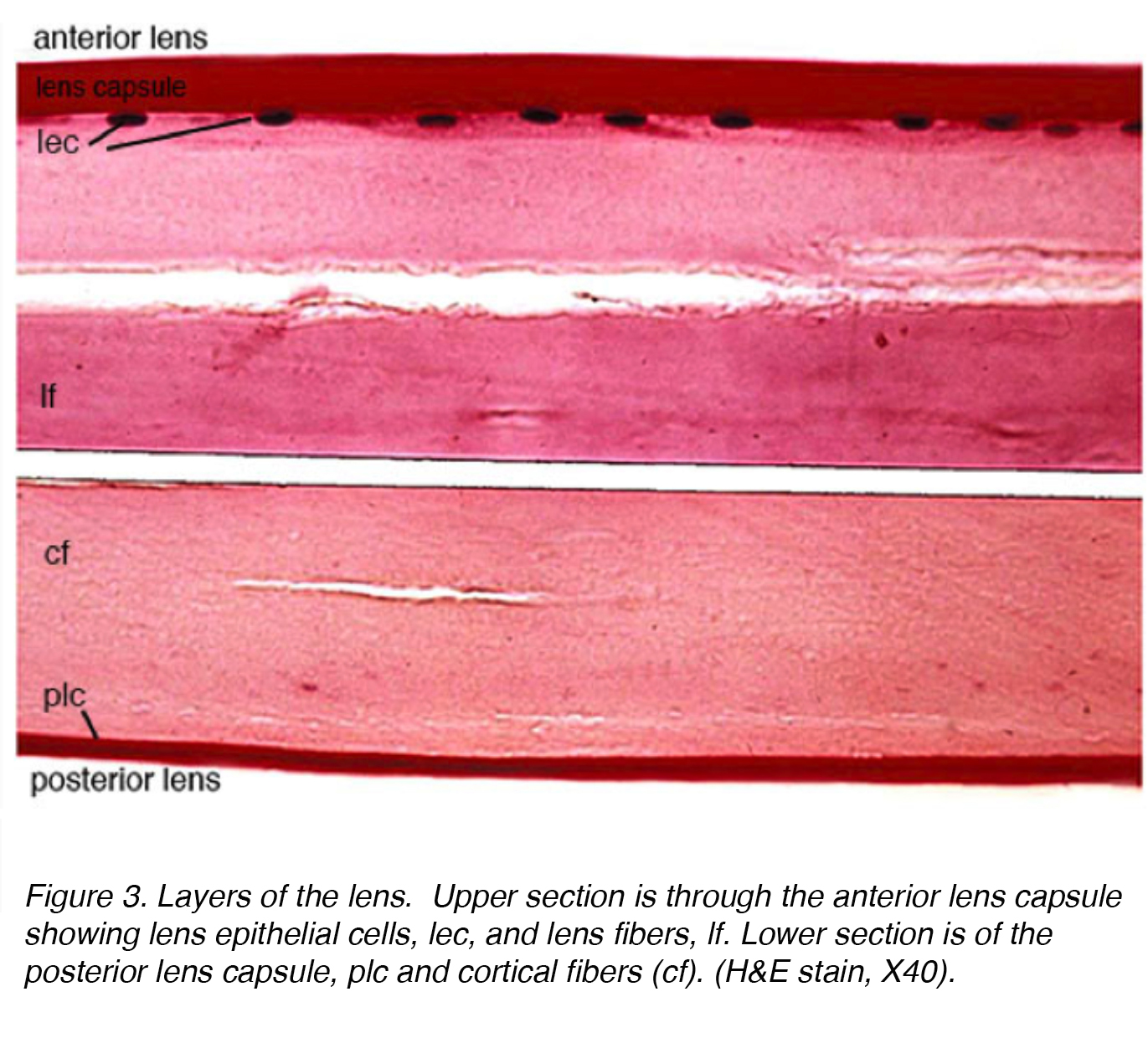
la Figure 3. Les couches de la lentille. La section supérieure est à travers la capsule du cristallin antérieur montrant les cellules épithéliales du cristallin, lec, et les fibres du cristallin, lf. La section inférieure est de la capsule du cristallin postérieur, plc et fibres corticales (cf). (H&e tache, X40).
le cristallin est composé de 4 structures: capsule, épithélium, cortex et noyau (Fig. 3)., La capsule est la membrane basale avec le collagène de type VI élaboré par la couche d’épithélium, et colore positivement avec la tache périodique de shiff acide (pas). Il est optiquement clair et acellulaire. La lentille est maintenue en place par des fibres zonulaires, autrement connues sous le nom de zonules de Zinn (Fig. 4). Ces fibres élastiques proviennent de la couche épithéliale non pigmentée du corps ciliaire et s’articulent avec la couche externe de la capsule, la couche lamellaire capsulaire., Il y a une réduction de la tension zonulaire avec la contraction du muscle ciliaire conduisant à une forme plus sphérique permettant de se concentrer sur des objets plus proximaux. Ce processus est appelé l’hébergement.
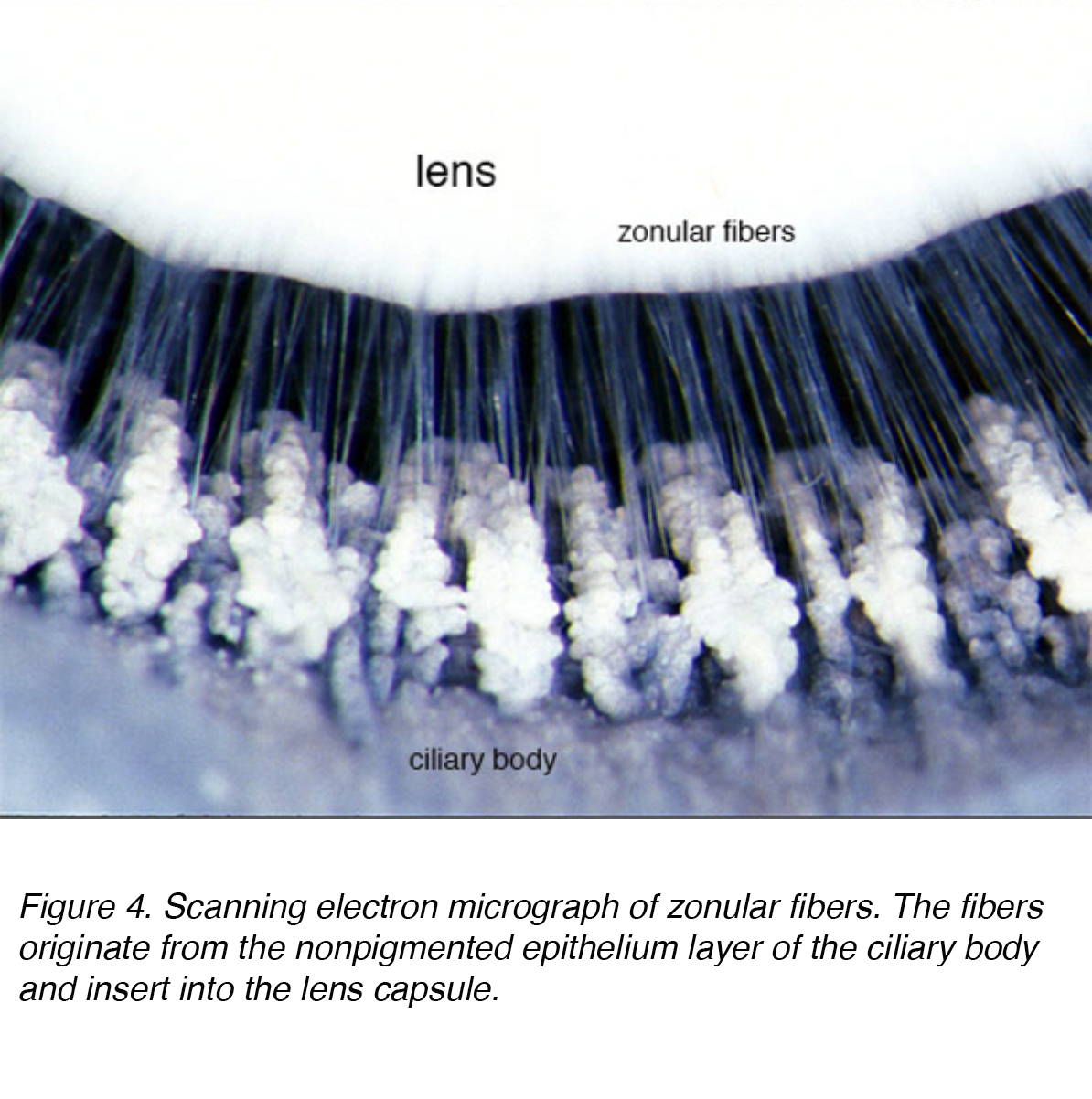
la Figure 4. Micrographie électronique à balayage des fibres zonulaires. Les fibres proviennent de la couche épithéliale non pigmentée du corps ciliaire et s’insèrent dans la capsule du cristallin.
l’épithélium du cristallin a des cellules mitotiquement actives qui subissent une différenciation supplémentaire via un processus d’élongation, une augmentation de la protéine intracellulaire et une perte d’organites., Ces cellules sont disposées en une seule couche à travers l’aspect postérieur de la capsule antérieure. La région équatoriale de l’Arc de la lentille est l’endroit où les cellules épithéliales de la lentille s’allongent pour former des cellules de fibres de lentille (Fig.5). La différenciation terminale de l’épithélium conduit finalement aux couches de fibres du cortex et du noyau, les fibres plus anciennes étant situées plus centralement.
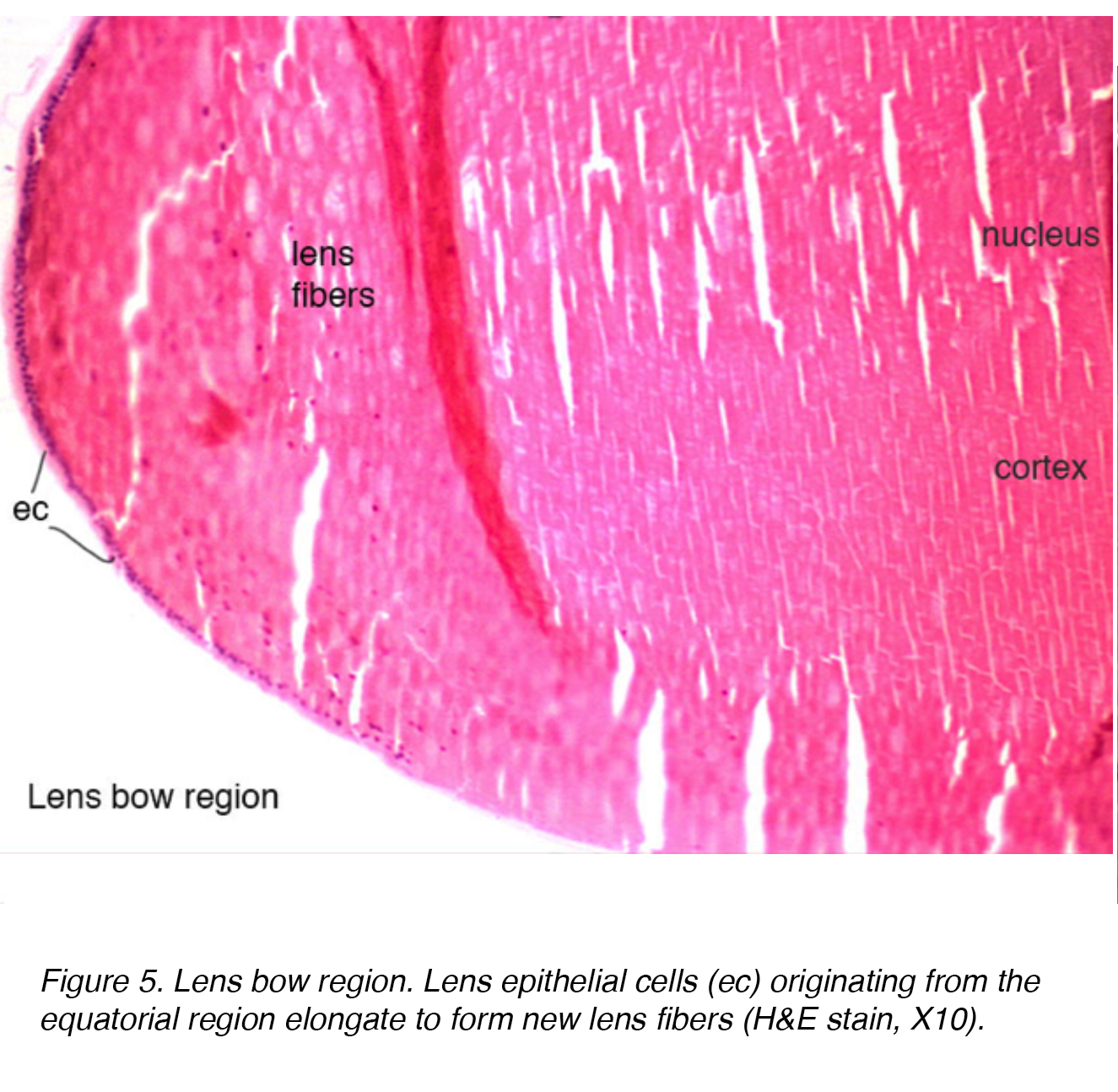
la Figure 5. Région d’Arc de lentille. Les cellules épithéliales du cristallin (ec) provenant de la région équatoriale s’allongent pour former de nouvelles fibres du cristallin (h&tache E, X10).,
bien que le noyau soit plus dense, histologiquement, il n’y a pas de distinction entre le cortex et le noyau (Fig. 5). La seule différence appréciable est l’âge, avec des couches plus anciennes situées plus au centre. Fait intéressant, à mesure que les couches du cortex et du noyau se développent, la force dioptrique globale de la lentille augmente en raison de l’augmentation du diamètre et de la courbure de la lentille. L’absence d’organites dans le noyau et le cortex sert à fournir un milieu optiquement clair pour la transmission de la lumière. La lentille adulte est presque trois fois la masse de sa version néonatale correspondante, 90 mg à 250 mg.,
chez l’ADULTE, la lentille manque de vascularisation ou d’innervation, de sorte que les exigences métaboliques de la lentille sont satisfaites par un flux constant d’humeur aqueuse qui sert de conduit à la fois pour l’élimination des déchets et l’apport de nutriments.
formation de la cataracte et TYPES de cataractes
1) cataractes congénitales
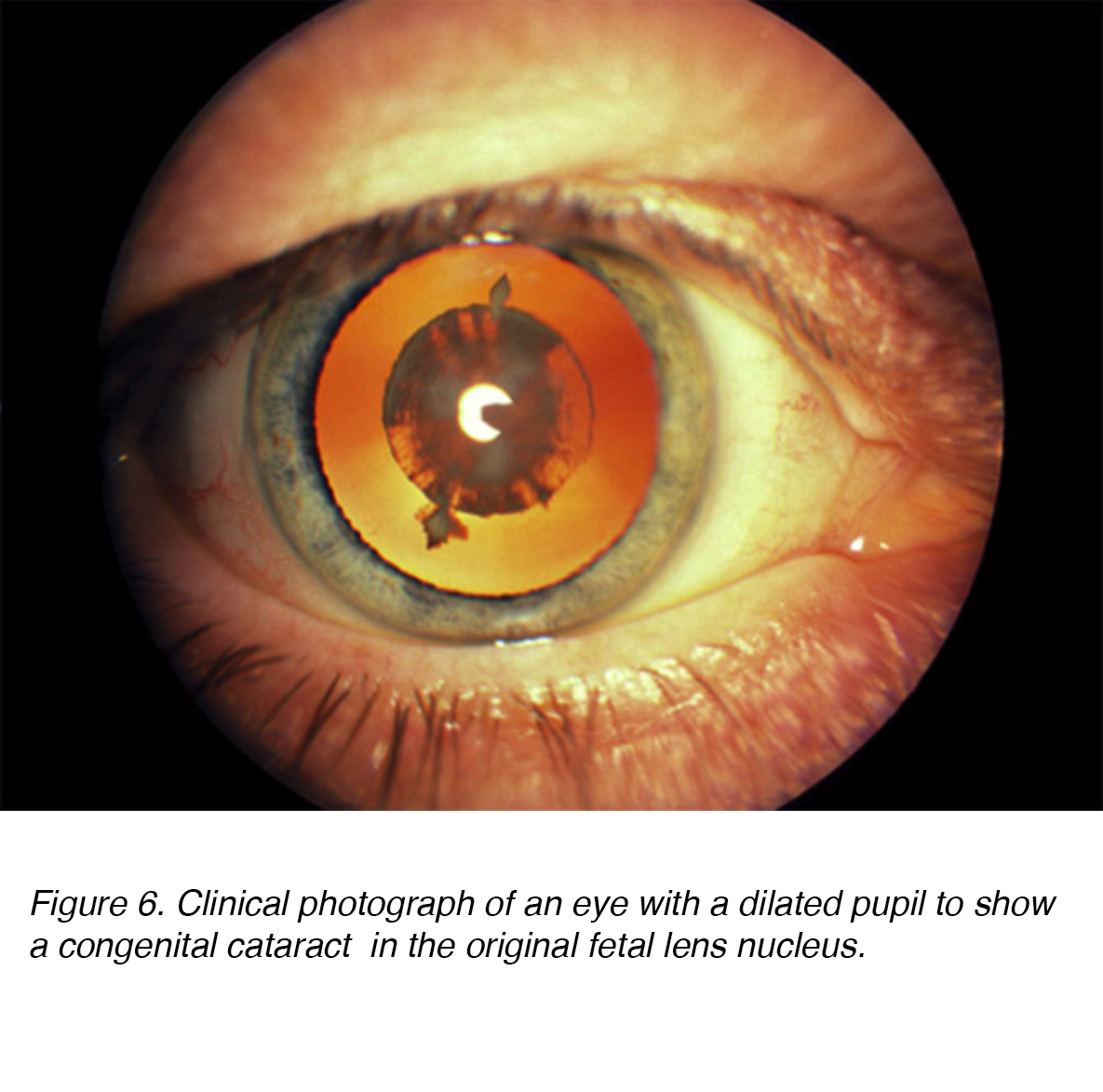
Figure 6. Photographie clinique d’un œil avec une pupille dilatée pour montrer une cataracte congénitale dans le noyau du cristallin fœtal d’origine.,
les cataractes congénitales sont des opacités lenticulaires qui provoquent une diffusion importante de la lumière à la naissance ou qui sont observées peu de temps après (Fig. 6). On estime que 200 000 enfants dans le monde sont aveugles à la suite de cataractes congénitales, avec une incidence de 40 000 dans les pays en développement. En ce qui concerne la latéralité, la prévalence semble être la même pour unilatérale vs bilatérale. L’intervention chirurgicale pour la cataracte unilatérale et bilatérale est primordiale pour prévenir la privation à long terme l’amblyopie ou la perte visuelle., L’amblyopie est définie comme un dysfonctionnement du traitement visuel, caractérisé par une mauvaise acuité visuelle dans un ou les deux yeux et une perception anormale de la profondeur binoculaire. Bien que les deux soient essentiels à détecter, la gravité à long terme de la privation visuelle bilatérale semble être inférieure à sa contrepartie unilatérale. .
Les principaux types morphologiques de cataractes congénitales sont classés comme zonulaires, polaires, totales et membraneuses. Les cataractes zonulaires congénitales sont décrites comme une opacité localisée dans une région lenticulaire spécifique., Un sous-type distinct peut se produire en fonction du moment de la blessure ou de l’erreur de développement. Si l’insulte survient au cours des 2 premiers mois de gestation, une cataracte nucléaire embryonnaire peut survenir. Une blessure survenant au troisième mois de gestation peut former une cataracte nucléaire fœtale, caractérisée par des opacités situées entre les sutures y antérieures et postérieures, et est connue sous le nom de cataracte suturale. Une étiologie tératologique peut expliquer l’arborisation d’une opacité suturale., Les cataractes polaires sont des opacités distinctes trouvées dans le cortex sous-capsulaire dans les régions polaires, avec des sous-types antérieurs et postérieurs. Un point de Mittendorf se produit lorsque le vaisseau hyaloïde ne parvient pas à développer. Il se caractérise par une petite tache blanche dense sur la surface postérieure de la capsule du cristallin. L’étiologie des cataractes pendant la petite enfance est large, y compris l’infection intra-utérine, les troubles métaboliques induits par la drogue, les traumatismes, les maladies oculaires, le syndrome héréditaire et idiopathique.,
2) cataractes nucléaires
Une cause fréquente de déficience visuelle chez les personnes âgées est la cataracte liée à l’âge, qui est sous-classée en tant que type nucléaire, cortical ou sous-capsulaire. L’incidence Cumulative de la corticale nucléaire, corticale et postérieure est de 29,7%, 22,9% et 8,4% respectivement. La cataracte nucléaire est le problème le plus courant lié à l’âge (Fig. 7 et 8).
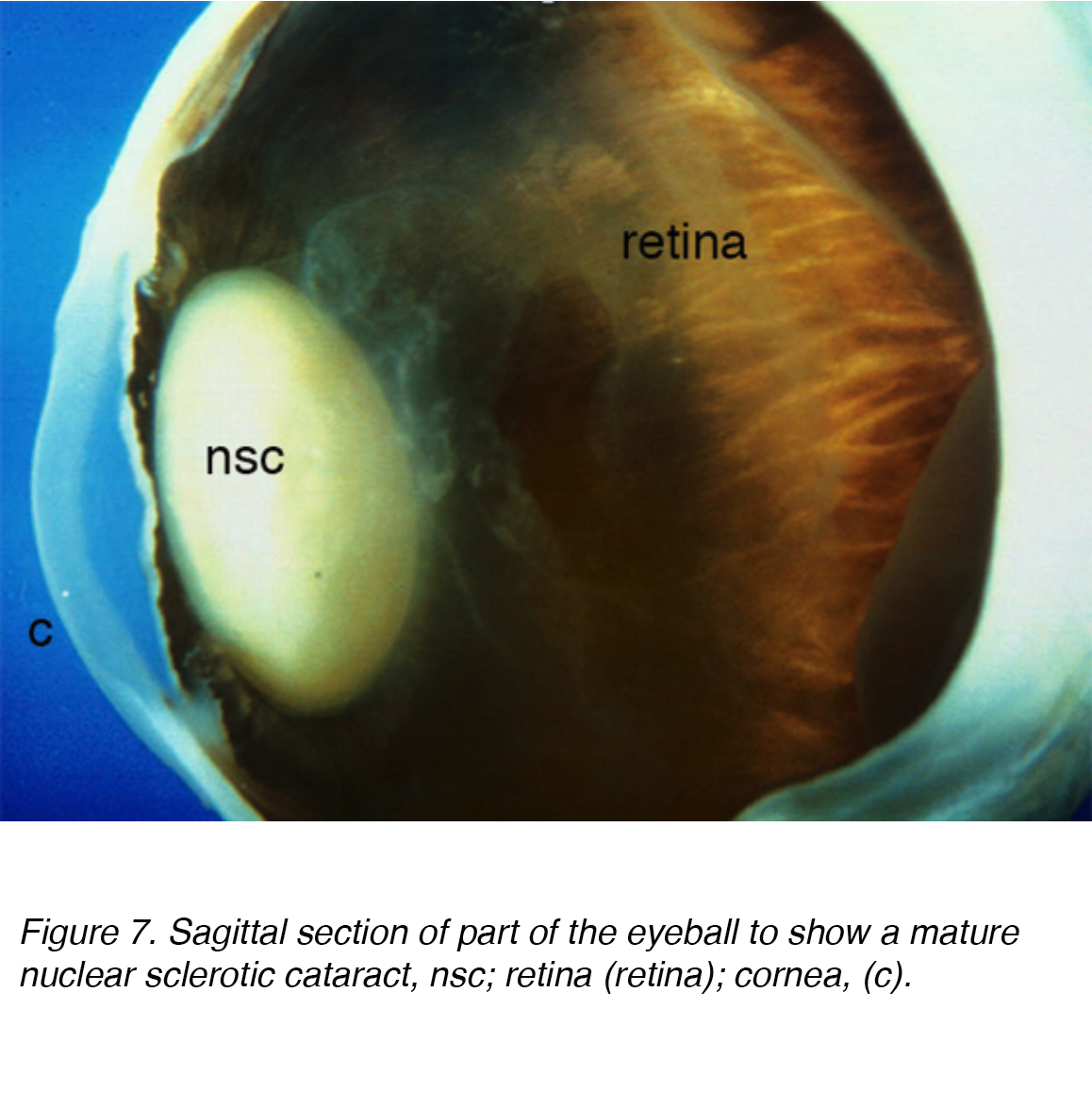
la Figure 7. Section sagittale d’une partie du globe oculaire pour montrer une cataracte sclérotique nucléaire mature, nsc; rétine (rétine); cornée, (c).
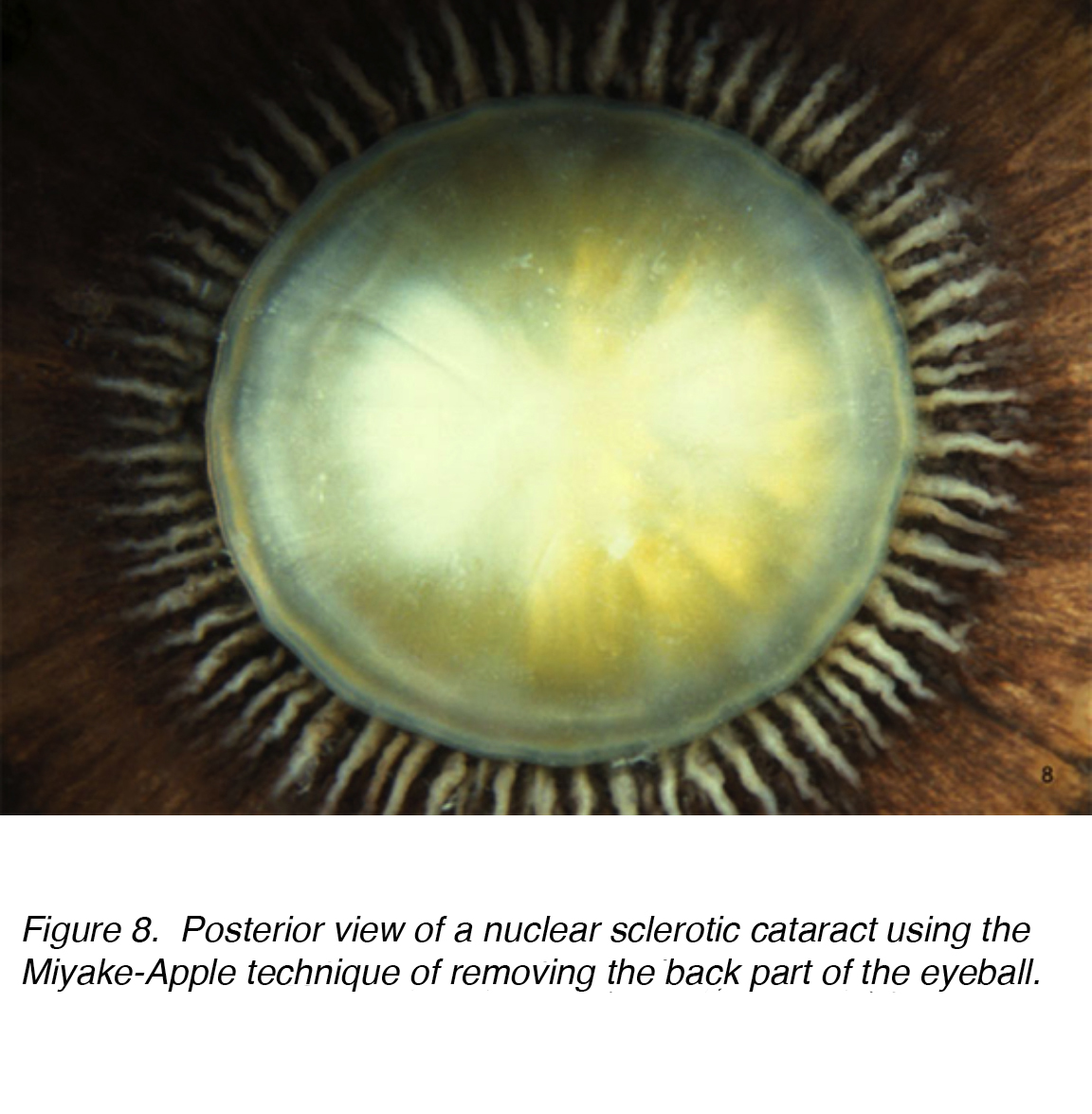
la Figure 8., Vue postérieure d’une cataracte sclérotique nucléaire utilisant la technique Miyake-Apple consistant à retirer la partie arrière du globe oculaire.
avec l’Âge, Les fibres nucléaires deviennent plus compactées et provoquent une diffusion accrue de la lumière. En conséquence, les noyaux de lentilles sclérotiques diminuent en transparence et entraînent des aberrations visuelles et des reflets gênants la nuit. Cliniquement, la lentille nucléaire sclérosée change de couleur, d’un matériau transparent clair au jaune ou à l’orange, éventuellement même au brun (brunescent) si on la laisse mûrir (Fig. 9)., Histologiquement, les lentilles sclérotiques nucléaires sont caractérisées par un matériau homogène dense.

la Figure 9. Cataracte brunescente isolée. La cataracte sclérotique nucléaire a une couleur brun foncé avec l’âge.
le vieillissement fait augmenter la taille globale du matériau lenticulaire et le rend plus amorphe. À mesure que les fibres de la lentille continuent de vieillir, le noyau devient plus compact et moins souple, ce qui diminue la capacité de la lentille à s’adapter efficacement., L’augmentation de la coloration est due à l’agrégation protéique dans la lentille nucléaire, diminuant sa transparence et entraînant divers symptômes, notamment une déficience visuelle, une diminution de la sensibilité au contraste, une perception des couleurs terne et un décalage myope
à mesure que la cataracte continue de mûrir, le matériau cortical commence à se liquéfier et le noyau augmente Une cataracte hyper-mature est la dernière étape du processus de vieillissement. Le cortex liquéfié est résorbé et le noyau dense s’enfonce dans le sac capsulaire., Si elle n’est pas traitée, la matière protéique peut fuir à travers la muqueuse capsulaire et provoquer une obstruction du maillage trabéculaire (MC), ce qui entraîne une réaction phacolytique glaucomateuse. Cette réaction inflammatoire est médiée par les macrophages qui réagissent à la fuite de protéine lenticulaire et contribuent à L’obtruction TM. Les changements dans le noyau de la lentille ne se produisent pas indépendamment de l’autre structure lenticulaire, au lieu de cela, les cataractes sous-capsulaires corticales peuvent et se produisent généralement simultanément. Cependant, la cataracte sclérotique nucléaire est de loin l’opacité lenticulaire la plus courante liée à l’âge.,
la Figure 10 montre une photographie de l’œil d’un patient avec une cataracte mature dense qui a à la fois des composants nucléaires et corticaux (voir ci-dessous). De toute évidence, le patient était « aveugle” dans cet œil, et cette cataracte devait être enlevée pour rétablir la vue à l’œil.
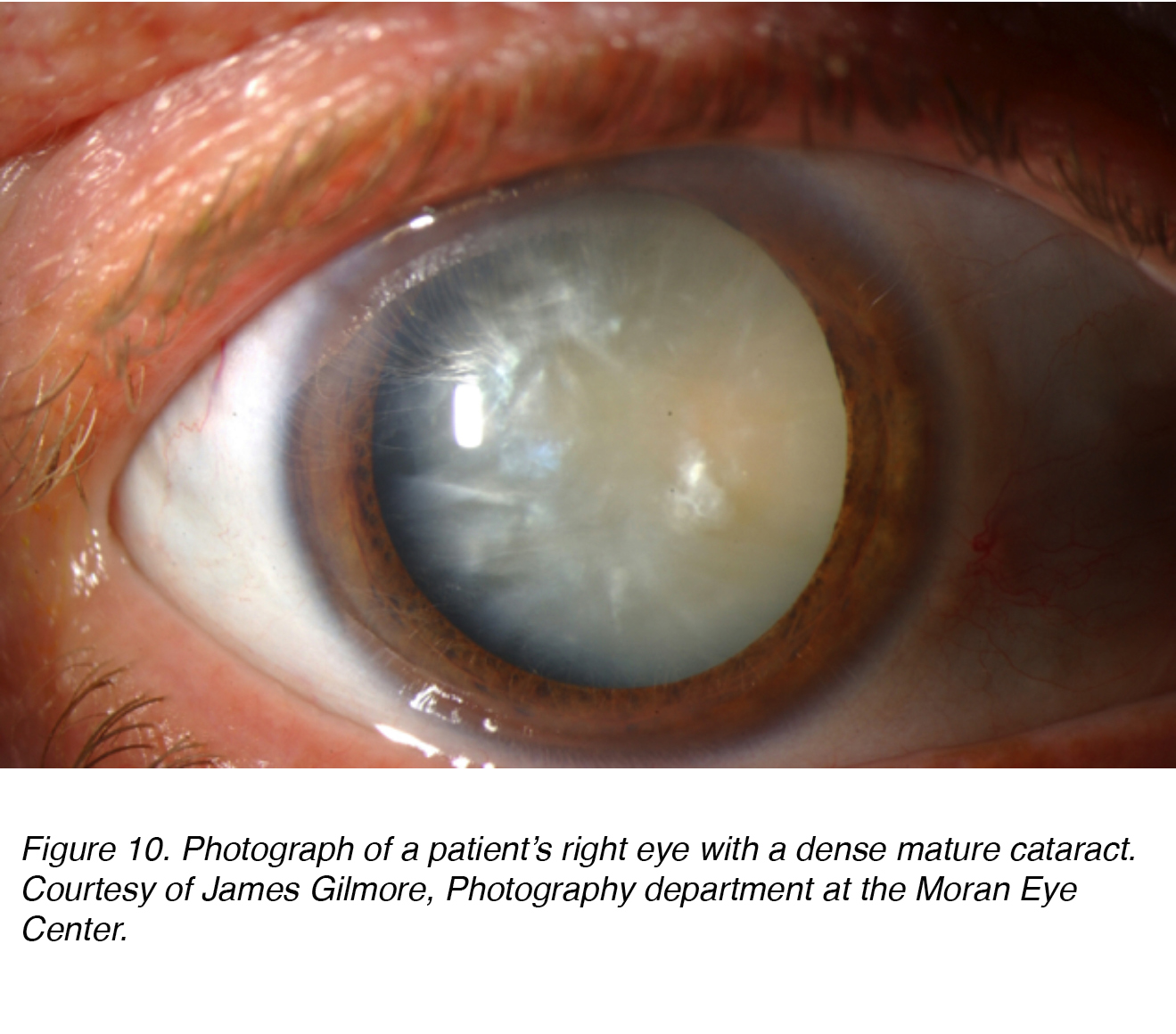
la Figure 10. Photographie de l’œil droit d’un patient avec une cataracte mature dense. Avec L’aimable autorisation de James Gilmore, Département de photographie au Moran Eye Center.
3) cataractes corticales
comme dans les changements de lentilles sclérotiques nucléaires, le vieillissement peut provoquer des changements dégénératifs similaires dans le cortex de la lentille., Les opacités formées dans le cortex cristallin sont tout à fait uniques. Des fentes fluides claires et nettes ressemblent à des rayons opaques dans le cortex de la lentille (Fig. 11,12).
Les Figures 11 et 12 montrent l’aspect typique du catéract cortical représenté de face (fig. 11) et le dos (fig. 12).
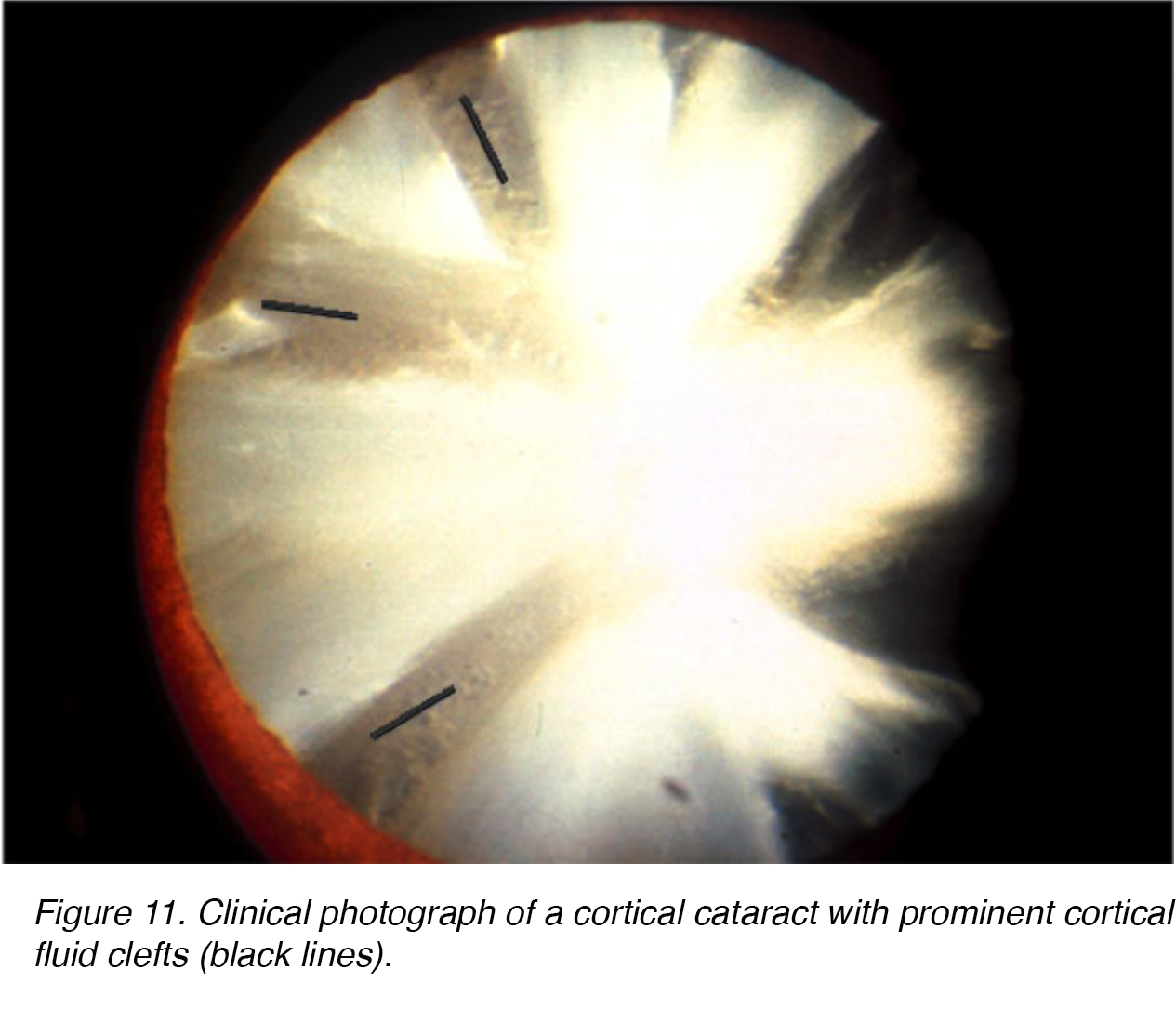
la Figure 11. Photographie clinique d’une cataracte corticale avec des fentes de liquide cortical proéminentes (lignes noires).

la Figure 12. Vue postérieure d’une cataracte corticale utilisant la technique Miyake-Apple pour afficher le cristallin., Les fentes fluides sont évidentes (lignes noires).
histologiquement, les cataractes corticales sont caractérisées par une accumulation de liquide éosinophile à coloration rose entre les fibres corticales (Fig. 13).
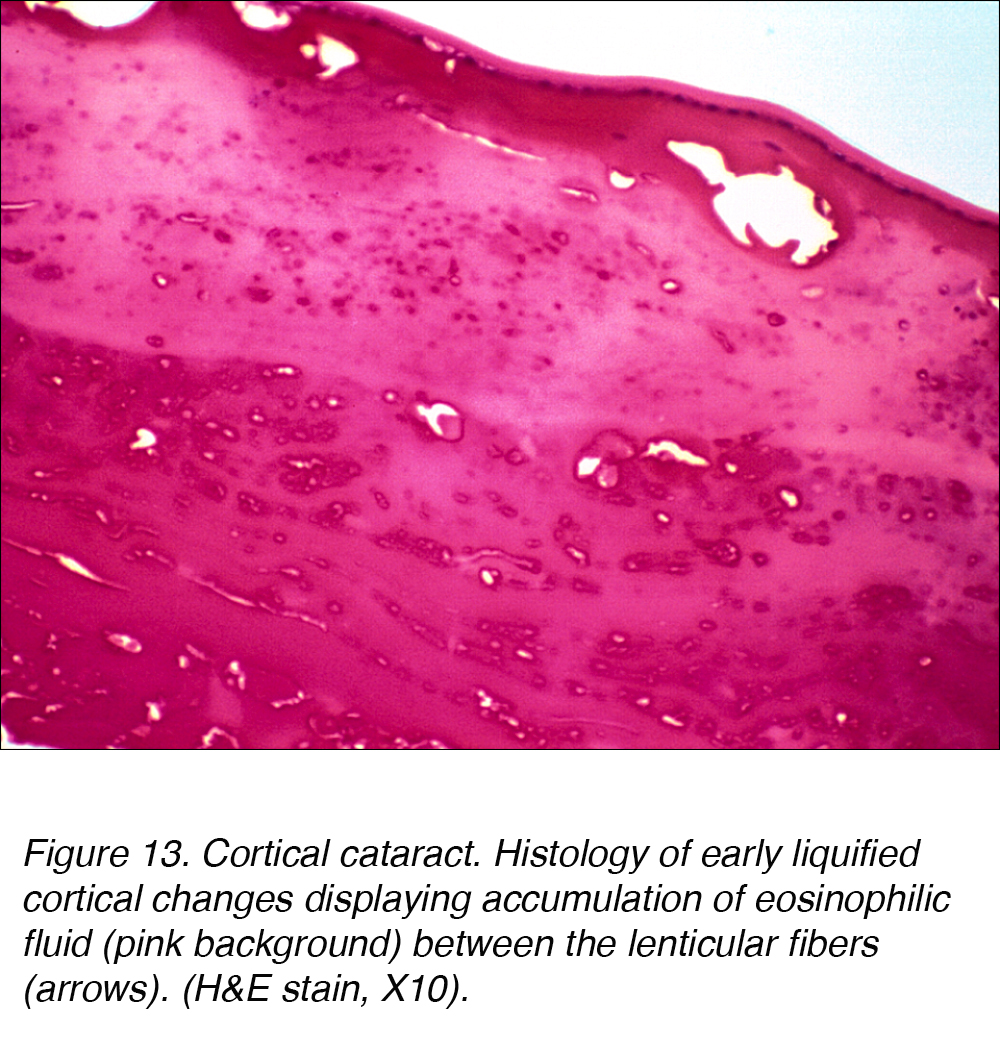
la Figure 13. La cataracte corticale. Histologie des changements corticaux précoces liquifiés montrant une accumulation de liquide éosinophile (fond rose) entre les fibres lenticulaires (flèches). (H&e tache, X10).
cette accumulation de liquide provoque des déplacements entre les cellules lenticulaires conduisant au déplacement et à la dégénérescence des cellules limitrophes., Le décalage tient compte des rayons observés cliniquement (fig. 11 et 12). Des Globules de matière protéique, appelés globules Morgagniens, peuvent être libérés par la dégénérescence des cellules de la lentille corticale (Fig. 14). À mesure que la cataracte corticale continue de mûrir, toute la région corticale peut être remplacée par ces globules et devient ainsi une cataracte Morgagnienne mature (Fig. 15).
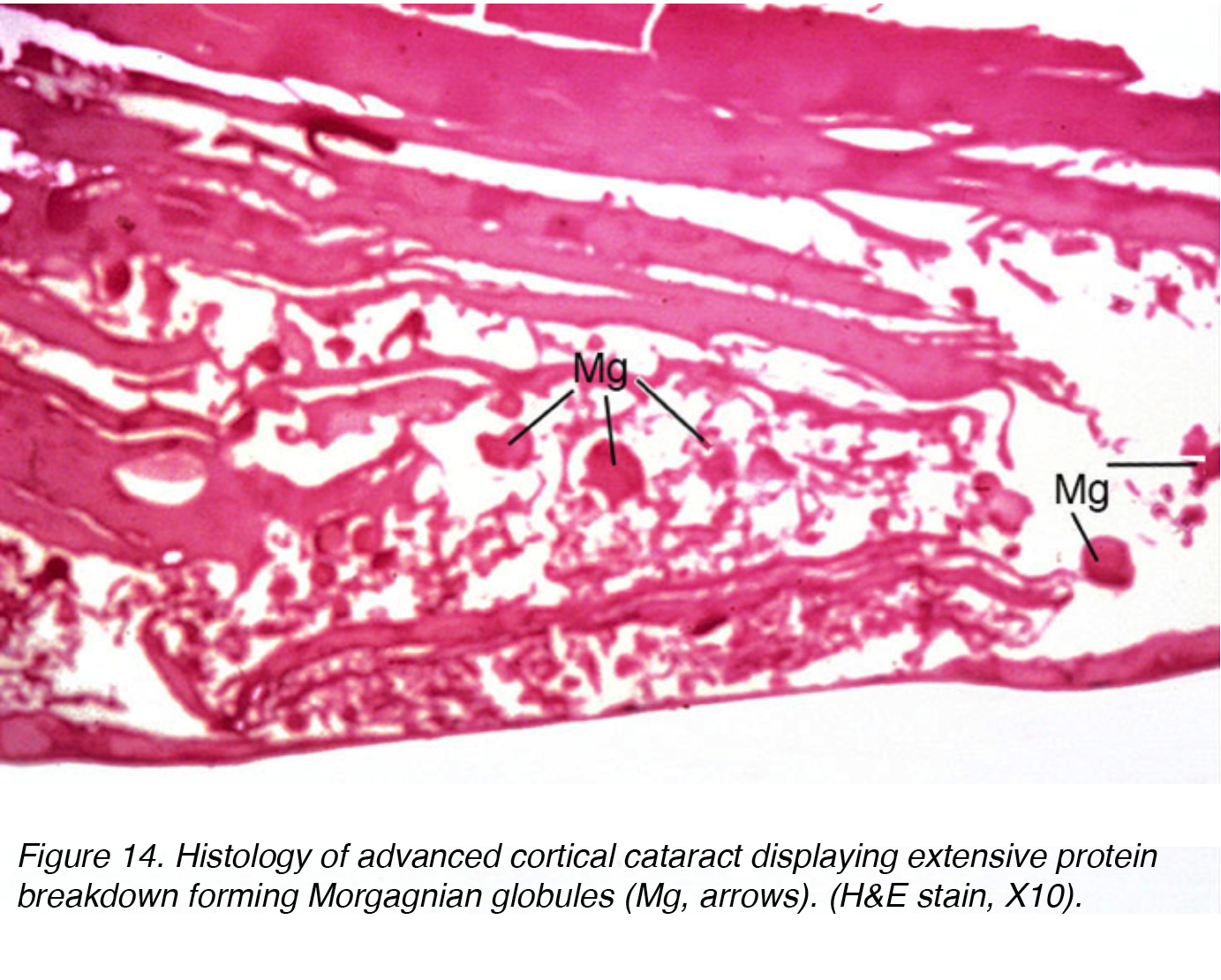
la Figure 14. Histologie de la cataracte corticale avancée présentant une dégradation importante des protéines formant des globules de Morgagnian (Mg, flèches). (H&e tache, X10).,
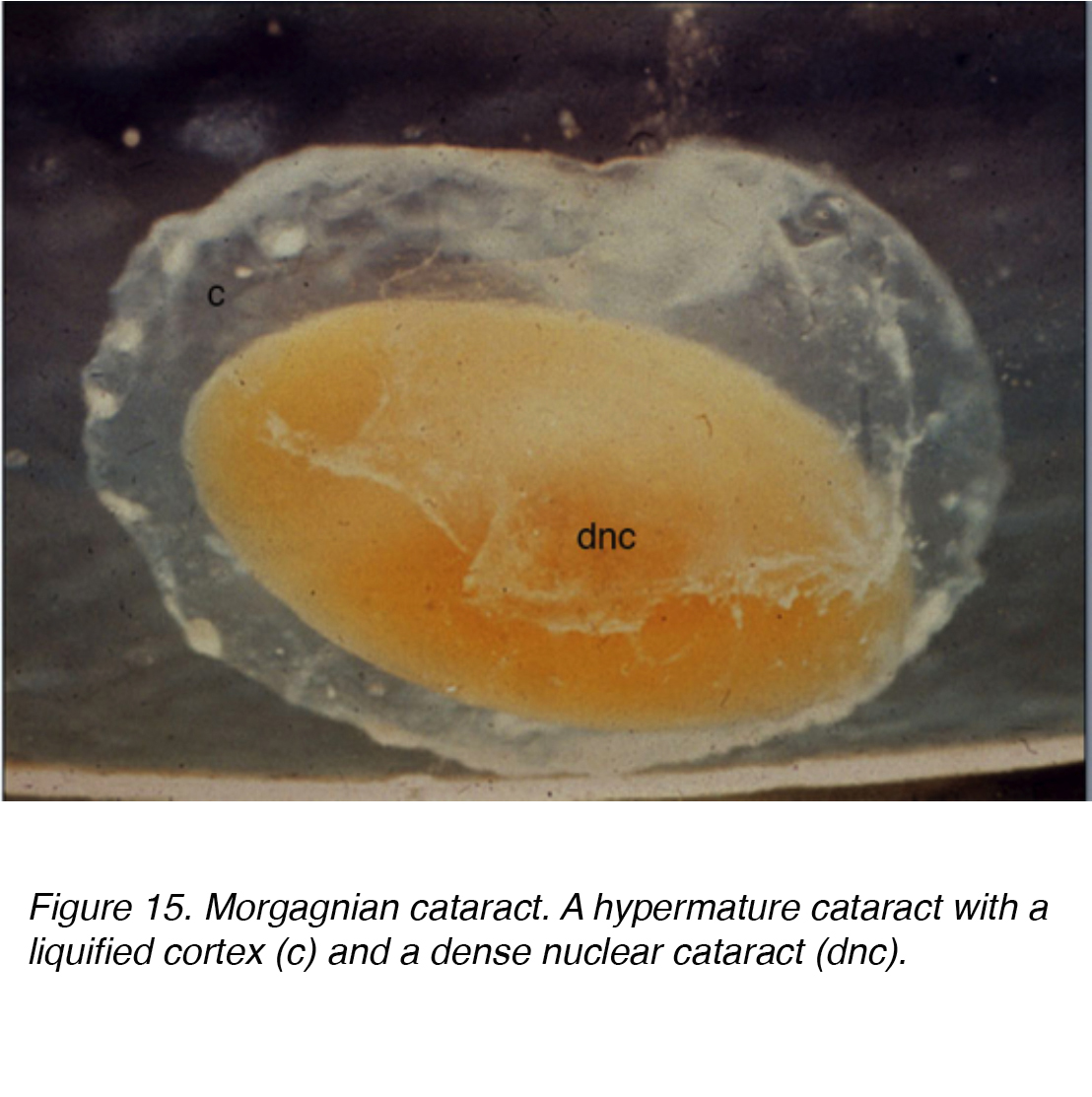
la Figure 15. Cataracte morgagnienne. Une cataracte hypermature avec un cortex liquéfié (c) et une cataracte nucléaire dense (dnc).
Une autre apparence caractéristique de la cataracte corticale est une cataracte d’arbre de Noël. Cela se produit lorsque des cristaux se forment dans le cortex profond. Ces cristaux sont généralement composés de cholestérol, lipides, calcium ou d’autres composés. Fait intéressant, les cataractes des arbres de Noël ne causent généralement pas de déficience visuelle importante.,
alors qu’une cataracte corticale peut se produire indépendamment d’une cataracte sclérotique nucléaire, des changements biomécaniques dans le noyau de la lentille peuvent en fait induire des changements cataracteux dans le cortex de la lentille. La capacité de s’adapter efficacement diminue avec l’âge, en général. La biomécanique altérée entre le noyau sclérotique et le cortex crée une contrainte pure résiduelle et entraîne des micro-crêtes parallèles au niveau de la zone de séparation lamellaire. Ce processus aide à expliquer les schémas histologiques observés dans les cataractes corticales.,
4) cataracte sous-capsulaire postérieure
les cataractes sous-capsulaires postérieures (PSC) se développent en raison de la migration postérieure des cellules épithéliales du cristallin en réponse à un stimulus externe. Bien que la plupart des cas soient spontanés, la PSC peut également se développer secondairement à des causes métaboliques, telles que le diabète, l’inflammation, l’uvéite, ou à partir de l’utilisation topique ou systémique à long terme de corticostéroïdes. La CSP a tendance à se produire chez les patients plus jeunes et progresse plus rapidement que les autres sous-types de cataracte. L’opacité est située au pôle postérieur de la lentille sur la face antérieure de la capsule postérieure (Figures 16 et 17).,
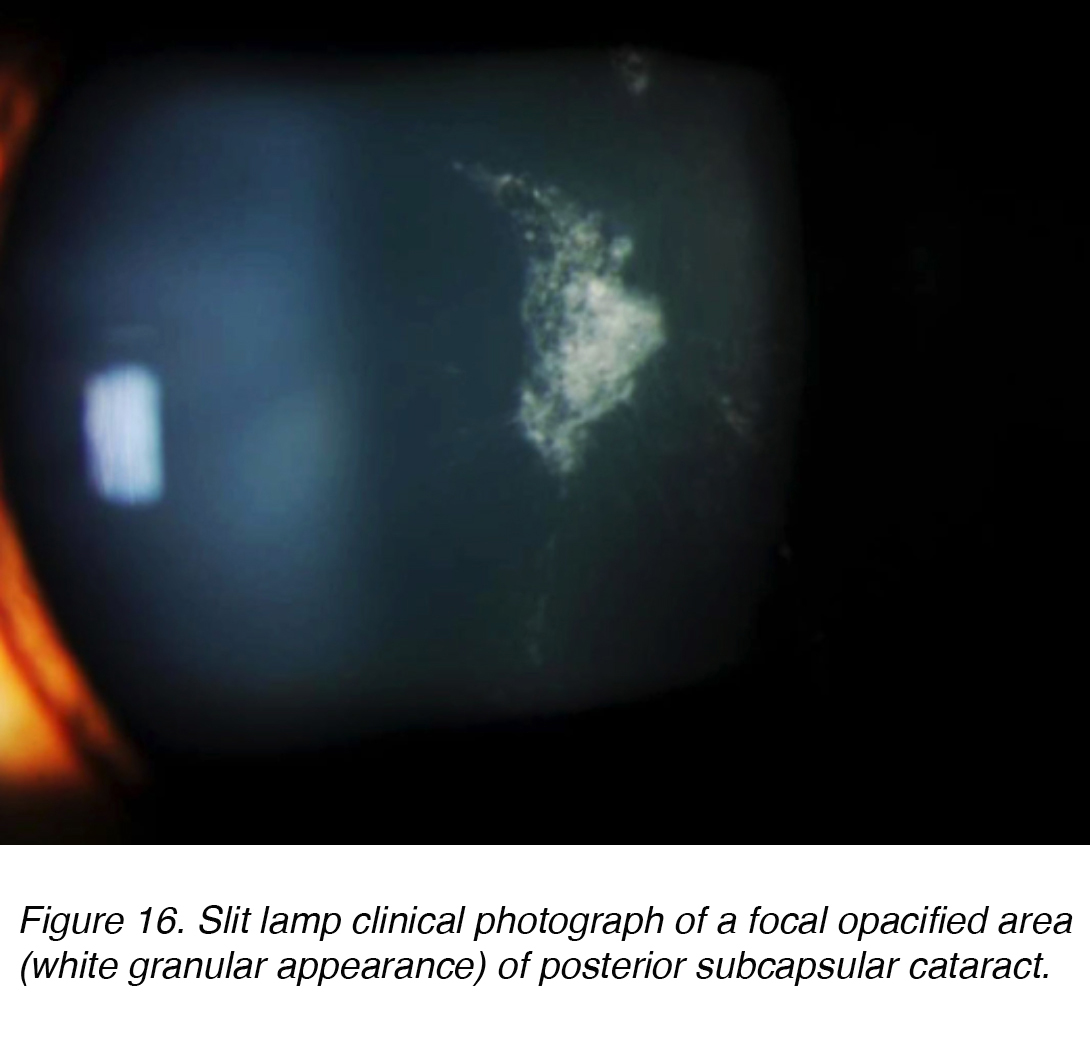
la Figure 16. Lampe à fente photographie clinique d’une zone opacifiée focale (aspect granulaire blanc) de la cataracte sous-capsulaire postérieure.
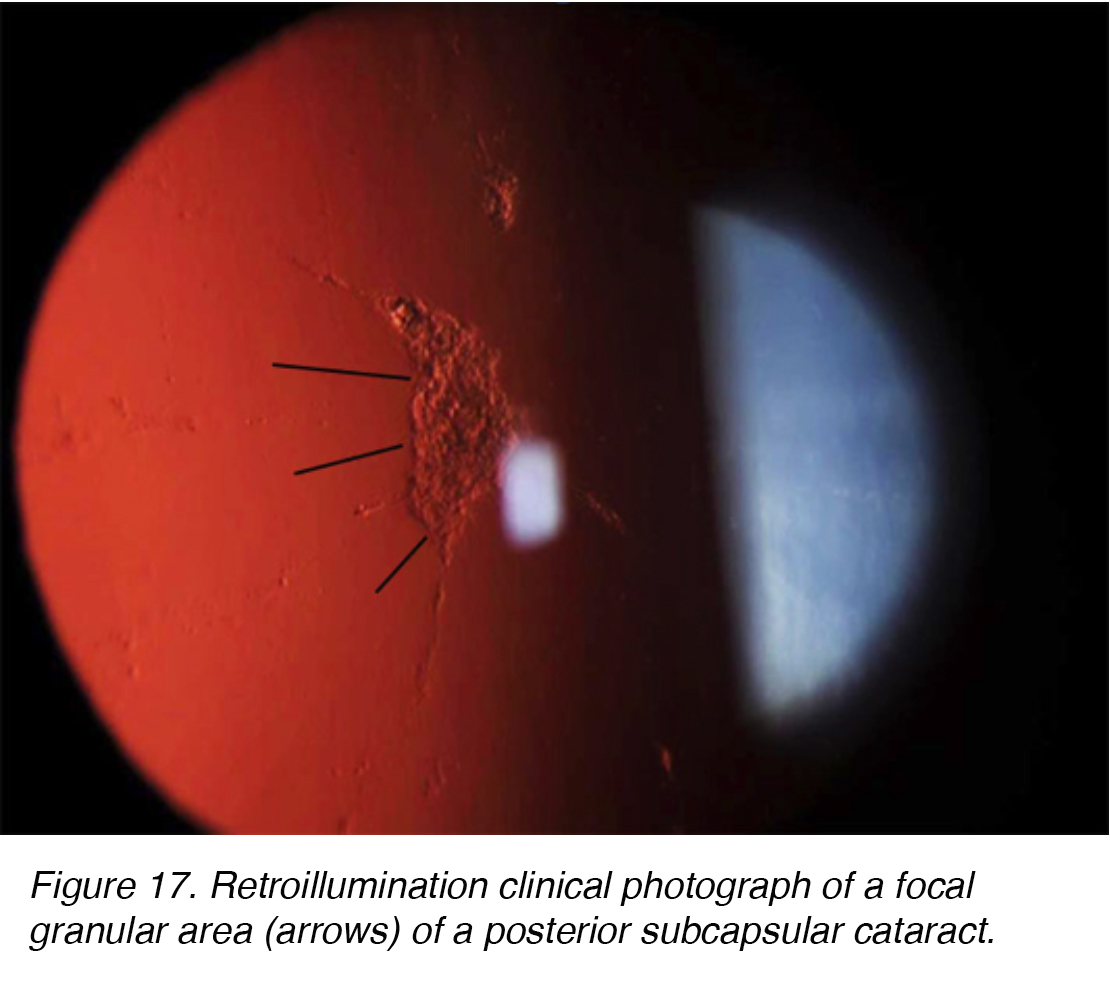
la Figure 17. Rétroillumination photographie clinique d’une zone granulaire focale (flèches) d’une cataracte sous-capsulaire postérieure.
Une étude ultrastructurale impliquant 13 yeux avec PSC a montré les changements qui ont eu lieu lorsque les cellules épithéliales du cristallin migrent de l’Équateur du cristallin vers la région PSC., L’étude a conclu qu’il y avait un changement mitotique lorsque les cellules migraient vers le pôle postérieur. Les cellules de la région équatoriale ressemblaient à des cellules épithéliales normales du cristallin, mais les cellules proches du PSC présentaient une activité mitotique accrue. Les auteurs ont suggéré que les cellules répondaient à un certain type de stimuli nocifs au pôle postérieur. L’activité résultante a amené les cellules à mûrir en fibres de lentilles ou à grossir en cellules ressemblant à la vessie appelées cellules Wedl et à la formation de PSC (Fig. 18)., Les cellules migratrices contribuent probablement à la formation de cataractes en sécrétant des matériaux extracellulaires, la cytolyse, la dissolution cellulaire et éventuellement la libération d’enzymes lysosomales.
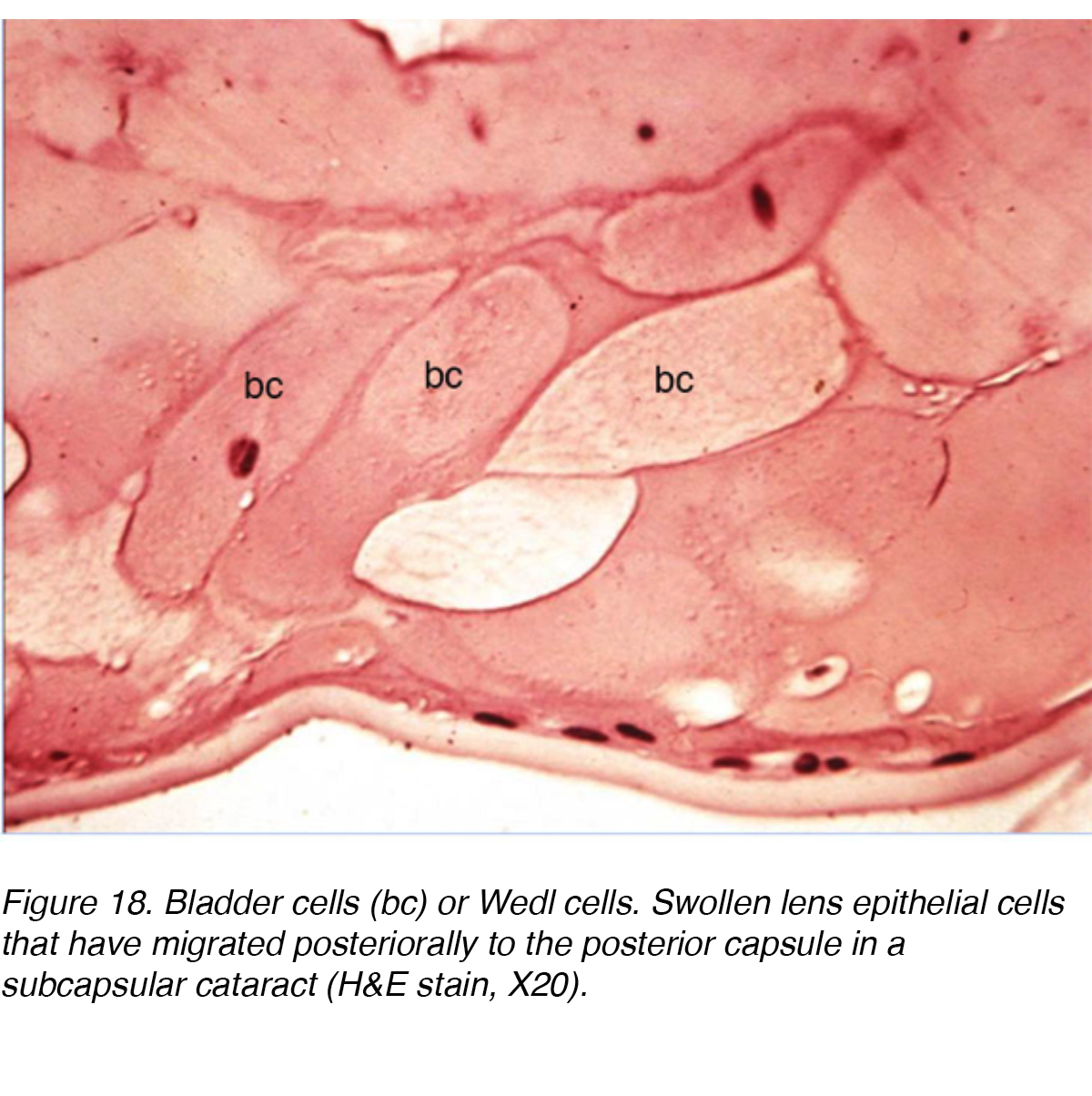
la Figure 18. Cellules de la vessie (bc) ou cellules Wedl. Cellules épithéliales du cristallin gonflées qui ont migré vers la capsule postérieure dans une cataracte sous-capsulaire (h&tache E, X20).
5) cataracte sous-capsulaire antérieure
les cataractes sous-capsulaires antérieures (ASC) se développent en raison de la dégénérescence des cellules épithéliales du cristallin antérieur., Ils peuvent développer des causes secondaires à un traumatisme, à un traitement médical iatrogène ou spontanément. La zone endommagée provoque une migration des cellules épithéliales du cristallin dans la zone et une transformation ultérieure des cellules en myofibroblastes dans un processus connu sous le nom de métaplasie fibreuse. Il en résulte une opacité sur la face antérieure de la lentille sous la capsule antérieure.
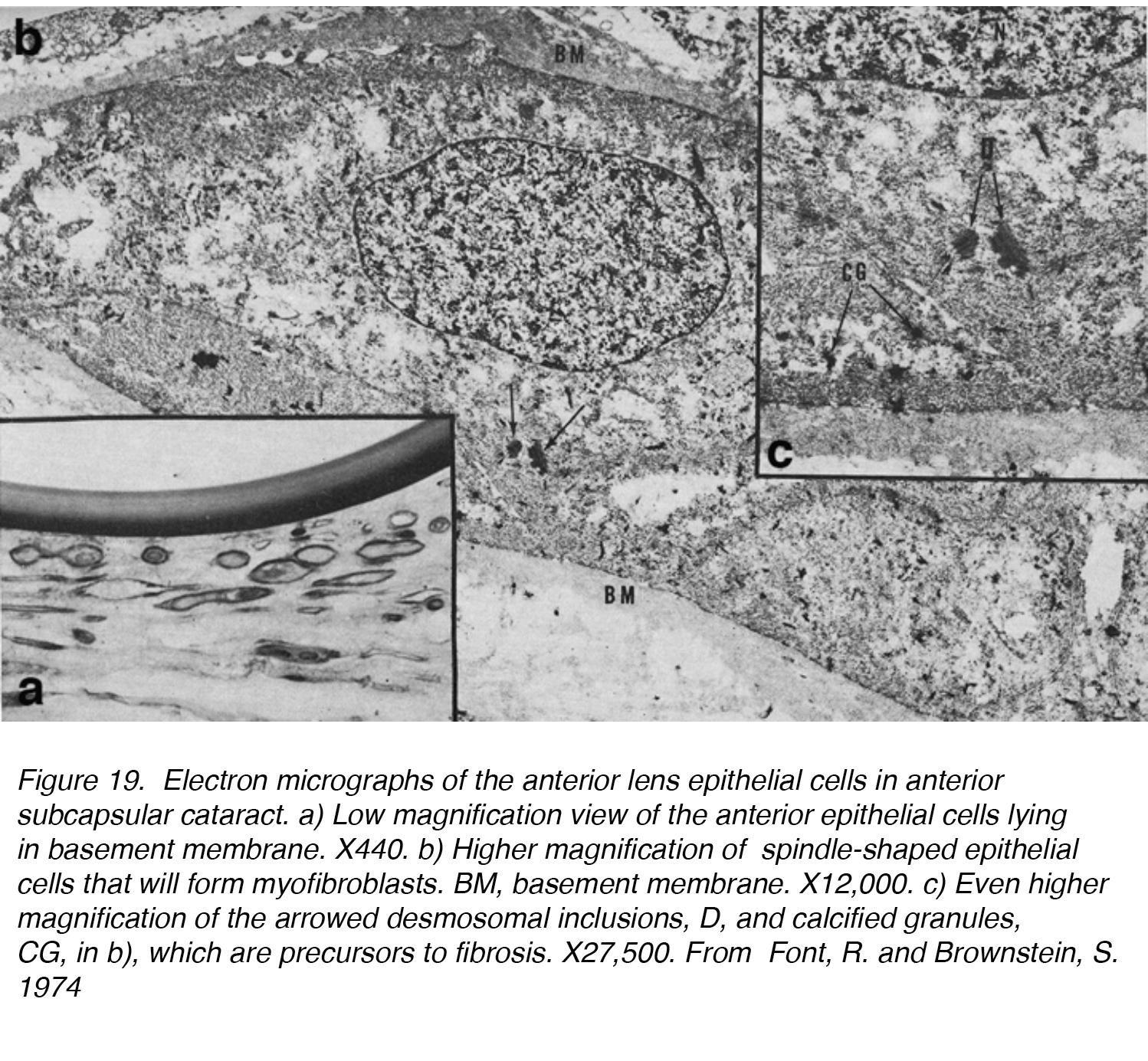
la Figure 19. Micrographies électroniques des cellules épithéliales de la lentille antérieure dans la cataracte sous-capsulaire antérieure. a) vue à faible grossissement des cellules épithéliales antérieures situées dans la membrane basale., X440. b) grossissement plus élevé des cellules épithéliales en forme de fuseau qui formeront des myofibroblastes. BM, membrane basale. X 12 000. c) grossissement encore plus élevé des inclusions desmosomales fléchies, D, et des granules calcifiés, CG, en b), qui sont des précurseurs de la fibrose. X27 500. De Font, R. et Brownstein, S. 1974.
dans l’une des premières études sur L’ASC, 5 lentilles avec ASC ont été examinées par microscopie optique et électronique et ont confirmé la capacité de l’épithélium de la lentille à subir une transformation en plaque fibreuse., Les cellules épithéliales du cristallin ont perdu leur forme cuboïdale normale et se sont allongées en une cellule plus fuselée (Fig. 19a, b, c). Ces cellules se sont fréquemment trouvées en contact les unes avec les autres, ce qui a donné naissance à la plaque fibreuse appelée ASC. Ce processus peut être décomposé en deux phases: une phase proliférative et une phase dégénérative. La phase proliférative était la plus évidente près de la périphérie de la plaque, montrant de nombreuses cellules en forme de fuseau et des cellules mitotiquement actives. Il est suivi d’une phase dégénérative, qui se traduit par une masse hyaline presque sans structure avec moins de cellules en forme de fuseau.,
bien que la cause de L’ASC soit variée, on a émis l’hypothèse d’une association entre L’ASC et la formation de synéchies après un traumatisme ou une inflammation. Les synéchies se formeraient entre l’iris postérieur et la capsule du cristallin antérieur, entraînant une stagnation de l’humeur aqueuse et une accumulation de métabolites toxiques qui pourraient produire un effet toxique sur l’épithélium du cristallin antérieur.
6) cataracte traumatique
une blessure directe à la tête ou aux yeux peut causer une perturbation mécanique importante et entraîner la formation de cataractes., Un anneau Vossius peut se produire si l’insulte a provoqué l’empreinte de l’épithélium pigmentaire de l’iris postérieur sur la capsule du cristallin. Le dépôt de pigment peut diminuer et se résoudre complètement avec le temps. Une blessure contondante grave peut provoquer des opacités lenticulaires stellaires dans le cortex et la capsule. Une telle insulte peut conduire à un dysfonctionnement de l’épithélium de la lentille, entraînant une réponse œdémateuse significative à la lentille corticale superficielle. Les poches de Vacuole peuvent alors être piégées de manière permanente dans la zone lamellaire, s’intégrant dans les fibres lenticulaires tandis que de nouvelles couches sont élaborées sur la lésion., Alternativement, un traumatisme contondant peut également provoquer la formation de cataractes dans toutes les couches lenticulaires, conduisant à une métaplasie fibreuse diffuse (Fig. 20). D’autres formes de traumatismes pouvant entraîner la formation de cataractes comprennent l’exposition aux rayonnements, aux infrarouges, à la chaleur extrême et aux blessures électriques.
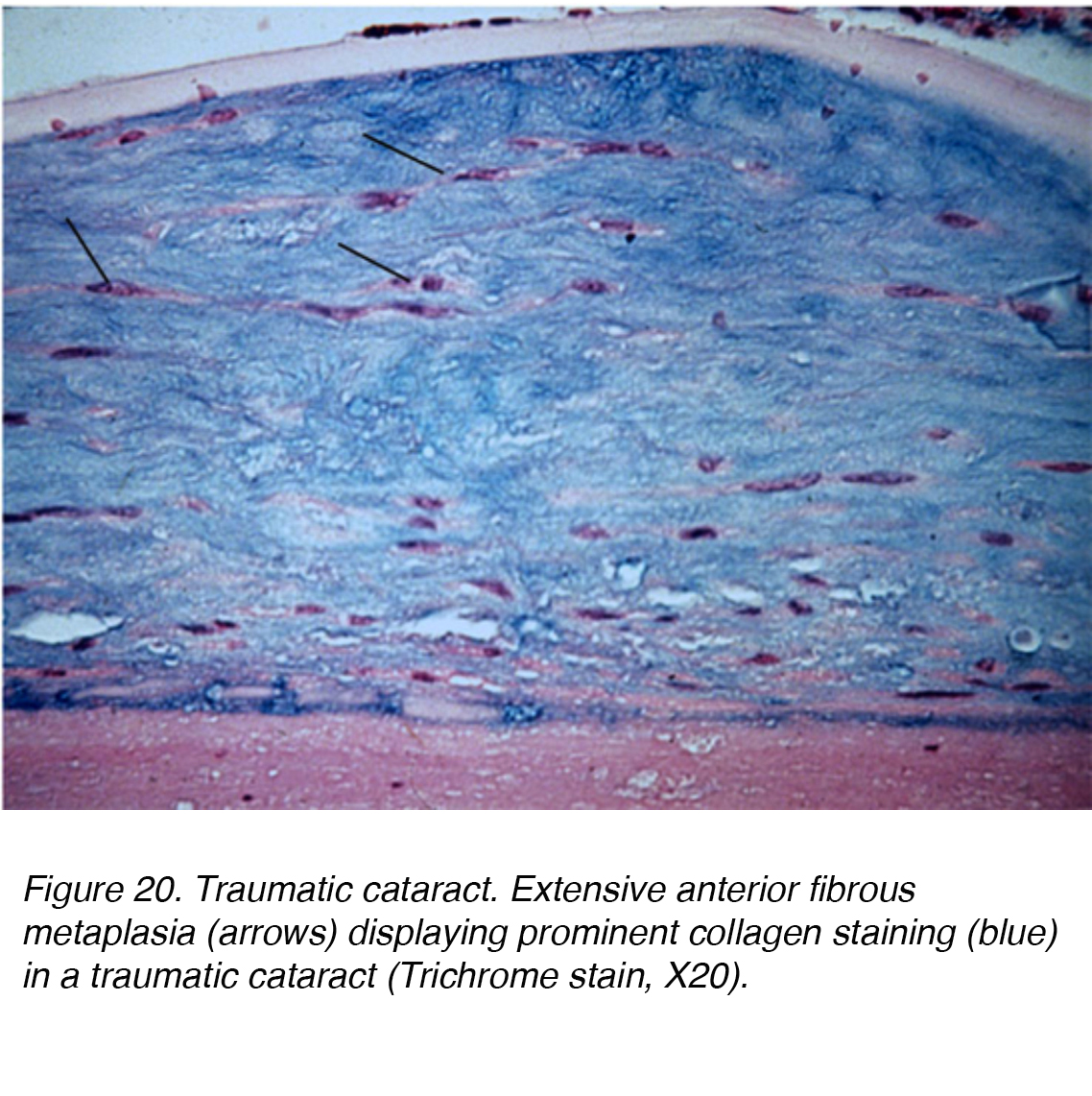
la Figure 20. Traumatique de la cataracte. Métaplasie fibreuse antérieure étendue (flèches) montrant une coloration importante du collagène (bleu) dans une cataracte traumatique (tache Trichrome, X20).,
7) cataracte induite par un médicament
Il a été démontré que plusieurs agents pharmacologiques provoquent la formation de cataractes. La corticothérapie à Long terme et l’utilisation de stéroïdes anabolisants sont parmi les agents les plus courants associés à la formation de la cataracte, en particulier la cataracte sous-capsulaire postérieure. L’incidence et la gravité de la CFP sont directement liées à la dose et à la durée d’utilisation. Fait intéressant, la thérapie stéroïdienne est devenue une option de traitement fréquente dans la gestion des pathologies rétiniennes et augmente à son tour les taux de formation de la cataracte., Il ne semble pas y avoir de distinction entre la CFP induite par l’utilisation de stéroïdes ou une CFP pure liée à l’âge. La phénothiazine est un autre agent thérapeutique qui peut provoquer des opacités lenticulaires. Les agents psychotropes, en particulier la phénothiazine, induisent le dépôt de matière pigmentée dans l’épithélium du cristallin antérieur dans une configuration axiale très distincte . D’autres agents pharmaceutiques connus pour causer des cataractes lenticulaires comprennent les miotiques et l’amiodarone .,
8) autres CAUSES de la cataracte
bien que les changements liés à l’âge restent le principal facteur de formation de la cataracte, en particulier la cataracte sénile, d’autres facteurs contributifs incluent le tabagisme, la maladie systémique, l’exposition excessive au soleil et les agents pharmacologiques susmentionnés . De nombreuses maladies systémiques peuvent causer des cataractes, telles que le diabète sucré, l’hypocalcémie, la dystrophie myotonique et la maladie de Wilson . Chez les patients diabétiques, la corticale et les CSP semblent apparaître plus tôt, en particulier chez les patients présentant un mauvais contrôle glycémique., Les cataractes induites par l’hypocalcémie commencent généralement sous forme de petites opacités de points blancs qui peuvent fusionner en flocons plus gros.
Le tabagisme, l’exposition au soleil et la gestion systémique des maladies sont des facteurs de risque modifiables, donc prendre des mesures pour modifier ces facteurs peut retarder l’apparition et la progression de la formation de la cataracte. Les phytonutriments, tels que les caroténoïdes de xanthophylle, la lutéine et la zéaxanthine peuvent jouer un rôle potentiel dans la limitation ou la neutralisation des changements oxydatifs induits par la lumière dans le cristallin . Actuellement, il existe plusieurs études en cours évaluant d’autres agents protecteurs possibles., Bien qu’il n’y ait pas de mesure définitive pour prévenir la formation de la cataracte, la chirurgie de la cataracte reste une intervention extrêmement sûre et très réussie.
chirurgie de la cataracte
deux vidéos montrant des interventions chirurgicales de la cataracte à partir des vues antérieure et postérieure du segment antérieur de l’œil humain.
Depuis la vue antérieure (fichier mp4).
Depuis la vue postérieure (fichier mp4).
la chirurgie de la cataracte a subi une évolution importante. Les connaissances anciennes considéraient l’œil catarateux comme un déséquilibre des humeurs qui nécessitait un déplacement pour récupérer la vision., À l’aide d’une aiguille, le chirurgien procéderait à déplacer l’Humeur anormale jusqu’à ce que le cristallin se disloque. La chirurgie moderne de la cataracte a subi des changements importants et se caractérise maintenant par plusieurs étapes: incision cornéenne, capsulorrhexie curviligne continue (CCC), hydrodissection, phacoémulsification, aspiration corticale et implantation de lentilles intraoculaires (IOL).
Une intervention chirurgicale antérieure pour enlever toute la lentille cataracte nécessitait une incision de 12 mm avec fermeture de suture ultérieure. Cependant, un petit 2.4 à 2.,Une incision cornéenne claire de 8 mm de large est suffisante pour faciliter l’entrée de la pièce à main phaco tout en restant sans suture pour la fermeture. La technique CCC a été développée par Gimbel et Neuhann dans les années 1980 et a véritablement révolutionné la technique de phacoémulsification . Le CCC consiste à créer une déchirure dans la capsule antérieure puis à poursuivre la déchirure de manière circulaire et continue tout en minimisant les forces de cisaillement exercées sur les fibres zonulaires. Après la création du CCC, la phacoémulsification est utilisée pour fragmenter et émulsionner à la fois la matière corticale et nucléaire., Initialement lancée par Kelman en 1967, la phacoémulsification reste un élément essentiel de la chirurgie de la cataracte . L’ouverture CCC est suffisamment grande pour permettre l’implantation de la totalité de l’optique et de l’haptique d’une lentille intraoculaire (IOL) dans le sac capsulaire de la lentille restante. L’utilisation préalable de lentilles de polyméthacrylate de méthyle non pliables nécessitait une incision cornéenne claire relativement grande pour l’implantation. Cependant, le développement des Liols pliables en silicone et en acrylique a permis l’insertion par une petite incision la plupart du temps inférieure à 4,0 mm de longueur., L’Innovation améliore constamment ces étapes de la chirurgie de la cataracte, des nouvelles IOLs avec un design unique pour minimiser l’incision cornéenne, à l’utilisation du laser femtoseconde pour créer une incision cornéenne automatisée, CCC et pour fragmenter le noyau avant l’aspiration.
les types de lentilles intraoculaires, qui sont actuellement utilisés dans la chirurgie de la cataracte, sont présentés dans le chapitre suivant dans webvision par Jason Nguyen, et Liliana Werner.
Sheeladevi et coll. 2016. Prévalence mondiale de la cataracte infantile: une revue systématique. Oeil. 30, 9 (2016), 1160–1169.
le Bouleau, l’E., et coll. 2009. La période critique pour le traitement chirurgical des cataractes bilatérales congénitales denses. Journal de l’Association Américaine pour l’Ophtalmologie Pédiatrique et Strabisme. 13, 1 (2009), 67–71.
Holmes, J. M. et Clarke, M. P. 2006. Amblyopie. Lancet (Londres, Angleterre). 367, 9519 (avr. 2006), 1343–1351.
Streeten, B. W. 1978. Cataracte Sous-Capsulaire Postérieure Humaine. Archives de L’Ophtalmologie. 96, 9 (janv. 1978), 1653.
Urban, R. C. et Cotlier, E. 1986. Cataractes induites par les corticostéroïdes. Enquête D’Ophtalmologie. 31, 2 (1986), 102–110.
Kelman, C. D. 1979., Phacoémulsification dans la chambre antérieure. Ophtalmologie. 86, 11 (1979), 1980–1982.
À propos des auteurs

Joah F. Aliancy, MD, originaire d’Haïti, a reçu son diplôme de premier cycle de L’Université de Floride du Sud en chimie avec mention et son diplôme de médecine de L’Université D’État de Floride. Actuellement, il est chercheur en pathologie oculaire au John A. Moran Eye Center. Dans un an, le Dr Aliancy assistera au Harkness Eye Institute de L’Université Columbia pour sa résidence en ophtalmologie., Ses intérêts de recherche comprennent la nouvelle technologie de la lentille intraoculaire, les mécanismes pour diminuer l’opacification de la lentille capsulaire, le syndrome du segment antérieur toxique et l’oxyde nitrique comme modalité de traitement de la maladie glaucomateuse. Il a été intronisé dans les sociétés D’honneur Alpha Omega Alpha et Gold Humanism et a reçu le prix Rabb-Venable de la National Medical Association. Dr. Aliancy peut être contacté à [email protected]

Nick Mamalis est professeur D’ophtalmologie au John A., Moran Eye Center de L’Université de L’Utah à Salt Lake City, Utah. Il a obtenu son baccalauréat en biochimie de L’Université Harvard et son doctorat en médecine de la Faculté de Médecine de l’Université de L’Utah. Après une bourse en pathologie ophtalmique à l’Université de L’Utah, il a complété sa résidence en ophtalmologie au Loyola University Medical Center. Il est actuellement directeur de la pathologie ophtalmique ainsi que co-directeur du Centre de recherche oculaire Intermountain à l’Université de L’Utah., Il est L’Éditeur du Journal of Cataract and Refractive Surgery ainsi que membre du Comité clinique de la cataracte et du Comité Exécutif de L’American Society of Cataract and Refractive Surgery (ASCRS). Le Dr Mamalis est un ancien président de la société D’Ophtalmologie de L’Utah. Il a reçu L’American Academy of Ophthalmology Honor Award en 1994, le Senior Achievement Award en 2005 et un Life Achievement Honor en 2015. Il a reçu la médaille D’honneur Brinkhorst en 2013 par L’ASCRS., Il est connu à l’échelle nationale et internationale et a publié plus de 200 articles de revues d’évaluation par les pairs et a écrit plusieurs manuels et chapitres de manuels. Dr. Mamalis peut être contacté à [email protected]