Luokka: Kemia
Julkaistu: 9. joulukuuta 2013
Kyllä, vesi voi jäädä nestettä alle nolla astetta. On muutamia tapoja, joilla tämä voi tapahtua.
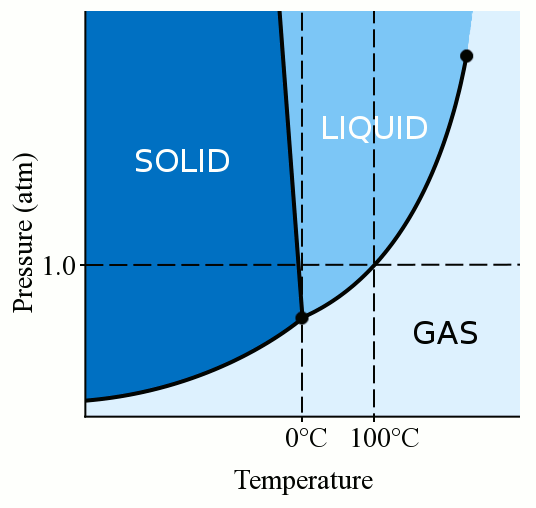
ensinnäkin materiaalin faasi (olipa se kaasu, neste tai kiinteä) riippuu voimakkaasti sekä sen lämpötilasta että paineesta., Useimmille nesteille paineen soveltaminen nostaa lämpötilaa, jossa neste jäätyy kiinteäksi. Vankka muodostuu, kun löysä, polveileva molekyylien nesteen saada tarpeeksi hitaasti ja tarpeeksi lähellä lomake vakaa bonds, että pin ne paikoilleen. Kun kohdistamme painetta nesteeseen, pakotamme molekyylit lähentymään toisiaan. Ne voivat siis muodostaa vakaita sidoksia ja tulla kiinteiksi, vaikka niiden lämpötila olisi korkeampi kuin jäätymispiste standardipaineessa. Vesi on kuitenkin jokseenkin ainutlaatuista. Vesimolekyylit leviävät sitoutuessaan kiinteään kiderakenteeseen., Tämä levittäytyminen johtaa siihen, että jää on vähemmän tiheää kuin nestemäinen vesi, jolloin jää kelluu. Tämä vesimolekyylien levittäytyminen jäätymisen aikana tarkoittaa myös sitä, että paineen kohdistaminen veteen alentaa jäätymispistettä. Jos käytät tarpeeksi painetta (jolloin vesimolekyylien on vaikea levitä kiinteään rakenteeseen), sinulla voi olla nestemäistä vettä useita asteita alle nollan asteen.
Vaikka et painostaa, voit silti olla nestemäistä vettä pakkasella käyttämällä lisäaineita., Lisäaineet, kuten suola, voivat haitata kiinteän aineen muodostamiseen tarvittavaa kemiallista sidosta ja siten laskea veden jäätymispistettä. Suola koostuu vahvoista natrium-ja kloori-ioneista. Veteen liuetessaan vesimolekyylit tuppaavat tarttumaan suola-ioneihin toistensa sijaan, eivätkä ne siksi jäädy yhtä helposti. Kun veteen lisää suolaa, sen jäätymispiste jatkaa laskuaan, kunnes vesi ehtii kyllästyä eikä siihen mahdu enää suolaa. Jos suolaa lisää riittävästi, veden jäätymispisteen voi pudottaa jopa -21 asteeseen., Tämä tarkoittaa sitä, että -21-asteinen vesi voi edelleen säilyä nestemäisenä, jos siihen lisätään riittävästi suolaa. Nestemäisen veden jäätymisen estämisen sijaan tätä voimakasta suolan ominaisuutta voidaan käyttää myös jään kääntämiseen takaisin vedeksi. Jäisillä jalkakäytävillä olevan suolan ripottelu alentaa jään jäätymispistettä ympäristön lämpötilan alapuolelle ja jää sulaa. Suolan ripottelu jäisillä kävelysilloilla ei kuitenkaan auta, jos ympäristön lämpötila on alle -21 astetta. Suolan vaikutus veden jäätymispisteeseen vaikuttaa syvästi myös maan valtameriin.,
vaikka ei painaisi eikä veteen lisäisi mitään, nestevettä voi silti olla alle nollan asteen lämpötiloissa. Jotta vesi jähmettyisi jäihin, se tarvitsee jotain jäätymistä päälle prosessin käynnistämiseksi. Kutsumme näitä lähtökohtia ”nukleaatiokeskuksiksi”. Useimmissa tilanteissa pieni pöly, epäpuhtaus tai jopa vähäinen värähtely vedessä antavat nukleaatiokeskuksia veden jäätymiselle päälle. Mutta jos vesi on hyvin puhdasta ja hyvin liikkumatonta, vesimolekyylit eivät kiteydy mihinkään., Tämän seurauksena hyvin puhdasta vettä voi viilentää reilusti alle nollan asteen ilman jäätymistä. Tässä tilassa olevaa vettä kutsutaan ”supercoolediksi”. Normaalipaineessa puhdasta vettä voidaan superkalauttaa jopa noin -40 asteeseen. Superkoolattua vettä estää jäätymästä vain nukleaatiokeskusten puute. Siksi, kun nukleaatiokeskukset ovat olemassa (joka voi olla yhtä yksinkertainen kuin värähtely), superkoolattu vesi jäätyy nopeasti. Jäätävä sade on luonnollinen esimerkki superkoolatusta nestemäisestä vedestä., Kerran jäätävää sadetta osuu objektin maan pinnalla, että kohde tarjoaa nukleaatio keskuksia, ja sade jäätyy.
aiheet: jäätyminen, jäätymispiste, jäätyminen sade, jää, vaihekaavio, paine, supercooled, lämpötila, vesi