tutkimuksen kinetiikan avulla tutkijat voivat määrittää suhdetta olosuhteiden muutokset ja nopeus tietyn kemiallisen reaktion. Yksi tärkeimmistä tekijöistä, jotka vaikuttavat nopeus reaktio on reaktiivisuus kemikaalien mukana, että erityisiä reaktio; Lisäksi, on olemassa useita muuttujia, jotka voivat vaikuttaa myös reaktionopeutta (pitoisuus, lämpötila, katalyytti, jne.).
yhtä näistä muuttujista pidetään törmäyksenä.,
Jokainen kemiallinen reaktio vaatii reaktanttihiukkasten (atomien ja / tai molekyylien) yhteentörmäyksiä. Toisaalta kaikki törmäykset eivät edistä tapahtuvaa reaktiota. Sen sijaan, jos törmäävät hiukkaset eivät ole riittävästi liike-energiaa tai oikea suunta avaruudessa, reaktio ei tapahdu.
mutta mitä tarkoitetaan ”riittävällä energialla”tai” oikealla orientaatiolla”? Saada parempi käsitys käsitteet aiemmin mainittiin, artikkeli antaa joitakin yleisiä määritelmiä vastaavalla esimerkkejä ja näyte ongelmia.,
päätavoitteemme on määritellä aktivaatioenergian käsite ja selittää, miksi osa törmäyksistä ei johda reaktioon.
näin ollen tässä artikkelissa keskitytään ensisijaisesti reaktiivisen törmäyksen käsitteeseen. Tämän lisäksi tarkastelemme lyhyesti joitakin skenaarioita, joissa on kyse ei-aktiivisista törmäyksistä. Koska törmäykset ovat liittyy kaksi suurta ominaisuudet, energia -, ja kohdealueeseen, keskustelemme nämä ehdot samoin.,
Törmäysteoria
kuten edellä on jo mainittu, kahden tai useamman molekyylin yhteentörmäyksiä on tapahduttava, jotta kemiallinen reaktio tapahtuu. Törmäys ei kuitenkaan riitä siihen, että reaktantit muunnetaan tuotteiksi. Molekyyleillä on oltava tarpeeksi energiaa, ja niiden on törmättävä oikeaan avaruussuuntaukseen.
kuten ehkä jo tiedät, reaktioita on erilaisia, kuten synteesi, hajoaminen, uppouma ja palaminen., Ottaen huomioon, että törmäys teoria keskittyy reaktioita, joissa törmäysten välillä kaksi lajia, sinun ei tarvitse huolehtia paljon noin hajoaminen reaktioita, koska, näissä tapauksissa, yksittäinen yhdiste on hajonnut, ja ei ole tarvetta harkita törmäysten tai suunta hiukkasia avaruudessa.
Jos reaktiossa on mukana kaksi lajia, molekyylien väliset törmäykset ovat ratkaisevia reaktion etenemisen kannalta, mutta vain sellaisten molekyylien törmäykset, joilla on riittävä liike-energia ja asiaankuuluva spatiaalinen suunta, voivat aiheuttaa reaktion., Näin ollen, energiaa tarvitaan murtaa joukkovelkakirjojen sisällä reagoivat molekyylit, kun taas suunta molekyylejä avaruudessa on tärkeä rooli riviin oikea atomien kanssa yksi toinen uudistus rikki joukkovelkakirjojen asianmukaisella tavalla.
kun molemmat kriteerit täyttyvät, törmäystä pidetään onnistuneena, tehokkaana tai reaktiivisena törmäyksenä.
kun otetaan Huomioon kaksi tärkeää tekijää edellä on mainittu (energia ja suunta), meidän pitäisi jatkaa lisäselvityksiä termejä ja käsitteitä, jotta voidaan paremmin ymmärtää periaatteet törmäys teoria.,
Aktivointi Energiaa
Kuten jo aiemmin mainittiin, hiukkasia, on törmäävät tarpeeksi energiaa, jotta reaktio tapahtuu. Tämä reaktion etenemiseen tarvittava vähimmäisenergia määritellään aktivaatioenergiaksi.,
kuten ehkä tiedätte, energian vapautumiseen tai imeytymiseen liittyviä reaktioita on kahdenlaisia:
- endoterminen reaktio – energia imeytyy reaktiossa (yleensä lämmön muodossa)
- eksoterminen reaktio – energia vapautuu reaktiossa (yleensä lämmön muodossa)
ensi silmäyksellä, saattaa näyttää siltä, että koska energiaa vapautuu eksotermisessä reaktiossa, ei pitäisi olla tarvetta syöttää jonkin verran energiaa reaktiota varten.. Sen sijaan sekä endotermiset että eksotermiset kemialliset reaktiot vaativat energiaa päästäkseen alkuun.,
se tuntuu vähän oudolta, eikö? Miksi reaktio tarvitsee energiapanoksen, jos energia näin ollen vapautuu?
tarkastellaan seuraavia esimerkkejä eksotermisistä reaktioista, joita esiintyy jokapäiväisessä elämässämme.

Esimerkki #1 – Polttaminen Kynttilän
palavan kynttilän vapauttaa energiaa lämmön muodossa; näin ollen, reaktion aikana esiintyvä prosessi on eksoterminen. On selvää, että kynttilä on sytytettävä tulitikulla tai sytkärillä., Tämä tarkoittaa sitä, että sinun täytyy syöttää energiaa kynttilän syttyä. Sen jälkeen reaktiossa on riittävästi energiaa edetä seuraaviin vaiheisiin, ja kynttilä jatkaa energian polttamista.
kynttilä ei kuitenkaan koskaan roihahda itsestään liekkeihin, vai mitä?
Esimerkki #2 – Lighting a Match

tyypillinen ottelupää koostuu rikkistä, joka on sekoitettu eri hapettavien aineiden kanssa. Tulitikun sytyttämiseksi kannattaa hieroa ottelupää tulitikkuaskin erikoispuolta vasten., Tämän prosessin aikana reaktio tapahtuu ja vapauttaa energiaa valon ja lämmön muodossa. Näin reaktiota pidetään eksotermisenä. Vaikka, sinun täytyy silti syöttää energiaa matchstick alkaa polttaa. Tämä energia määritellään termillä ” aktivointienergia.”Kuten edellisessä esimerkissä, niin kauan kuin annat riittävästi energiaa tulitikun syttymiseen, se jatkaa polttamista ja lämmön vapauttamista itsestään.
Aktivaatioenergiakäyrä kuvaa kemiallisen reaktion aikana tapahtuvia energiamuutoksia.,
tontti aktivointi energia-kuvaaja, on tärkeää ottaa huomioon kaksi muuttujaa:
- Määrä yhteentörmäyksiä eri molekyylejä,
- Liike-energia törmäyksen molekyylejä,
ensimmäinen muuttuja on melko helppo ymmärtää, koska se on suora merkitys – se määrittelee useita törmäyksiä hiukkasten välillä kaksi lajia per sekunti.
toinen muuttuja on törmäävien molekyylien liike-energia, joka voidaan määritellä molekyylien liikkeen energiaksi.
- endoterminen Reaktioenergia imeytyy., Reaktanttien energia on pienempi kuin tuotteiden energia.
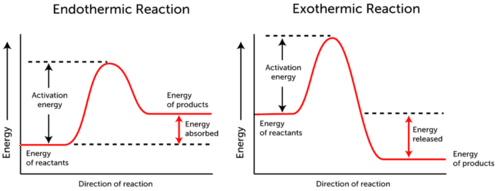
- eksoterminen Reaktioenergia julkaistaan. Reaktanttien energia on enemmän kuin tuotteiden energia.
kuten yllä olevista kahdesta kuvaajasta näkyy, aktivaatioenergia sekä endotermisille että eksotermisille reaktioille on sama.,
Koska endoterminen reaktio voi tuottaa yhtä paljon energiaa kuin se tarvitsee kuluttaa reaktio tapahtuu, energia imeytyy; näin ollen, energiaa, tuotteita on korkeampi kuin energian reactants.
päinvastoin eksotermiset reaktiot tuottavat enemmän energiaa kuin ne käyttävät aktivaatioenergiana. Tämän seurauksena energiaa vapautuu, ja tuotteissa on vähemmän energiaa kuin reaktoreissa.,
johtopäätöksenä voidaan todeta, että vaikka reagoivien aineiden molekyylit nopeasti törmäävät toisiinsa, on välttämätöntä, että molekyylejä on riittävästi energiaa, jotta reaktio tapahtuu.
Paikkasuuntaus
törmäysteorian mukaan kaikki törmäykset eivät onnistu, vaikka reaktanttimolekyyleillä olisi riittävä aktivaatioenergia. Molekyylien on myös törmättävä oikeaan suuntaan.
niin, toinen reaktiivisiin törmäyksiin vaikuttava aspekti katsotaan avaruussuuntautuneeksi (molekyylien orientaatio avaruudessa).,
mitä tarkoitetaan molekyylien ”oikealla” suuntautumisella reaktiossa?
kun kaksi molekyyliä törmää toisiinsa, molempien molekyylien on sijaittava siten, että niiden on helppo reagoida. Käsitteen ymmärtämiseksi on tärkeää korostaa reaktion mekanismia.
katsotaan esimerkiksi propeenin (tai propeenin) ja vetybromidin välinen reaktio:

kuten yllä näkyy, reaktio etenee 2 askelta.,
Vaihe 1: kaksoissidos rikkoutuu
Vaihe 2: bromi kiinnittyy
tässä reaktiossa HBR: n ja C3H6: n molekyylisuunnat ovat tärkeässä roolissa, koska yksi niistä sijaitsi toisella tavalla, H-atomin ei olisi ollut mahdollista lähestyä propyleenimolekyyliä.
Tämä pätee jokaiseen reaktioon. Jokaisella molekyylillä on oltava oikea suunta avaruudessa, jotta reaktio tapahtuu. Oikea suunta varmistaa, että molekyylit sijaitsevat siten, että niiden on suhteellisen helppo törmätä ja reagoida.,
voimme päätellä, että reaktanttimolekyylien suotuisa suuntautuminen on yhtä tärkeää kuin riittävä aktivaatioenergia.
Yhteenveto
koko artikkelissa määritellyt termit ja käsitteet on koottu alla olevaan taulukkoon:
| miten hiukkaset selittyvät on oltava vuorovaikutuksessa tai keskenään aiheuttaa reaktion., Törmäysteorian mukaan kemiallisen reaktion aikaansaamiseksi on täytettävä kaksi kriteeriä: molekyylien on törmättävä riittävään aktivaatioenergiaan katkaistakseen ja muodostaakseen uudelleen olemassa olevat sidokset; molekyylien on törmättävä suotuisaan avaruussuuntautumiseen. | |||
| Onnistunut Törmäys (kutsutaan myös tehokas, tai reaktiivinen törmäys) | törmäys molekyylejä, joilla on riittävä aktivointi energia-ja oikea suunta avaruudessa, joka aiheuttaa kemiallisen reaktion., | ||
| Aktivointienergia | minimienergia, joka tarvitaan reaktion tapahtumiseen. Energiaa tarvitaan endotermisten ja eksotermisten reaktioiden varalta. | ||
| Endoterminen Reaktio | Energiaa (lämpöä) imeytyy; energia reagenssit on PIENEMPI kuin energia-tuotteita; ei Voi tuottaa yhtä paljon energiaa kuin se kuluttaa reaktion aikana., | ||
| eksoterminen reaktio | Energia (lämpö) vapautuu; reaktanttien energia on suurempi kuin tuotteiden energia; voi tuottaa enemmän energiaa kuin se kuluttaa reaktion aikana. | ||
| Molekyylisuuntaus | molekyylien Avaruussuuntaus., |
Three different scenarios are represented in the picture attached below:
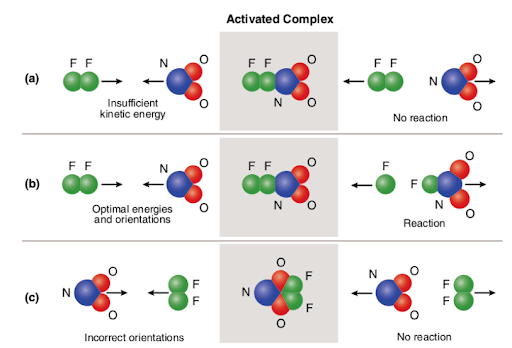
The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride.,
tapauksessa (a) reagoivien aineiden molekyylit ovat oikea kohdealueeseen, mutta ei ole riittävä aktivointi energiaa; Siksi, reaktio ei tapahdu johtuen siitä, että siellä ei ole tarpeeksi voimaa murtaa joukkovelkakirjoja. Näiden kahden molekyylin törmäystä pidetään siis epäaktiivisena.
B: n tapauksessa reaktanttimolekyyleillä on sekä riittävä aktivaatioenergia että oikea orientaatio avaruudessa. Molekyylien optimaalisten ominaisuuksien vuoksi reaktio etenee ja muodostuu typen oksifluoridia., Näiden kahden molekyylin yhteentörmäystä pidetään siis reaktiivisena.
tapauksessa (c) reagoivien aineiden molekyylit ovat riittävän aktivointi energiaa, mutta eivät ole oikein sijaitsee avaruudessa, ja Siksi reaktio ei tapahdu, koska se ei ole mahdollista, että molekyylit tavoittaa toisiaan tavalla, joka rikkoo sidoksia. Samoin kuin ensimmäisessä tapauksessa, näiden kahden molekyylin törmäystä pidetään ei-aktiivisena.