Richard Baxter ja Jim Britton
Miten teräs syövyttää veteen?
katodisuojan ymmärtämiseksi on ensin ymmärrettävä, miten korroosio syntyy. Korroosiota varten on oltava kolme asiaa:
1. Kaksi erilaista metallia
2. Elektrolyytti (vesi, jossa on mitä tahansa suolaa tai siihen liuenneita suoloja)
3., Metalli (johtava) polku välillä erilaisia metalleja,
kaksi erilaista metallia voi olla täysin eri seokset – kuten teräs-ja alumiini – mutta ovat todennäköisemmin mikroskooppinen tai makroskooppinen metallurgisen eroja pinnalla yhdestä pala terästä. Tällöin harkitsemme vapaasti syövyttävää terästä, joka ei ole yhtenäinen.
Jos edellä mainitut olosuhteet ovat olemassa, tapahtuu aktiivisemmilla paikoilla seuraava reaktio: (kaksi rauta-Ionia ja neljä vapaata elektronia).,
2Fe => 2Fe++ + 4e-
vapaat elektronit kulkevat metalli-polku vähemmän aktiivisia sivustoja, jossa seuraava reaktio tapahtuu: (happea kaasu muunnetaan happi-ion – yhdistämällä neljä vapaita elektroneja – joka yhdistää veden kanssa muodostaen hydroksyyli-ioneja).
O2 + 4e- + 2H20 => 4 OH-
näiden ionien rekombinaatiot aktiivisella pinnalla tuottavat seuraavan reaktion, joka tuottaa rautakorroosiotuotetta rautahydroksidia: (rauta yhdistyy hapen ja veden kanssa muodostaen rautahydroksidia).,
2FE + O2 + 2H2O => 2FE (OH)2
tätä reaktiota kuvataan yleisemmin ’virtauksena veden läpi anodista (aktiivisempi kohta) katodiin (vähemmän aktiivinen kohta).”
miten katodisuojaus pysäyttää korroosion?
Katodinen suojaus estää korroosiota muuntamalla kaikki anodinen (aktiivinen) sivustoja metalli pinta katodinen (passiivinen) sivustoja toimittamalla sähkö-nykyinen (tai vapaita elektroneja) alkaen vaihtoehtoinen lähde.
yleensä tämä muodostuu galvaanisista anodeista, jotka ovat terästä aktiivisempia., Tämä käytäntö on myös nimitystä uhrijärjestelmän, koska galvaaninen anodit uhrata itse suojella rakenteellisten teräs-tai putkiston korroosiota.
jos alumiini anodit, reaktio alumiini pinta on: (neljä alumiini-ioneja plus kaksitoista vapaita elektroneja)
4Al => 4AL+++ + 12 e-
ja teräksen pinnalle: (happea kaasu muunnetaan hapen ioneja, joka yhdistää veden kanssa muodostaen hydroksyyli-ioneja).,
3O2 + 12e- + 6H20 => 12oh-
kunhan virta (vapaat elektronit) saapuu katodille (teräkselle) happea nopeammin, korroosiota ei tapahdu.,
perusnäkökohdat uhrianodijärjestelmiä suunniteltaessa
sähkövirran anodipurkauksia ohjataan Ohmin lailla, joka on:
I=E/R
i= virran virtaus vahvistimissa
e= anodin ja katodin potentiaalierotus volteissa
R= kokonaispiirin resistanssi ohmeissa
aluksi virta on suuri, koska anodin ja katodin välinen potentiaaliero on suuri.katodi on suuri, mutta koska potentiaaliero pienenee katodiin virtaavan virran vaikutuksesta, virta pienenee vähitellen katodin polarisoitumisen vuoksi., Piirin resistanssiin kuuluu sekä vesireitti että metallireitti, joka sisältää minkä tahansa piirin kaapelin. Vallitseva arvo tässä on anodin vastus merivedelle.
useimmissa sovelluksissa metallinkestävyys on niin pieni verrattuna vedenkestävyyteen, että se voidaan jättää huomiotta (vaikka tämä ei koske kelkkoja tai pitkiä putkistoja, jotka on suojattu molemmista päistä). Yleensä pitkien, ohuiden anodien vastustuskyky on pienempi kuin lyhyiden, rasvaisten anodien. Ne purkavat nykyistä enemmän, mutta eivät kestä yhtä kauan.,
näin Ollen, katodinen-suoja suunnittelija on koko anodien niin, että ne ovat oikean muotoinen ja pinta-ala vastuuvapauden tarpeeksi virtaa suojella rakenne ja tarpeeksi painoa viime haluttu käyttöikä, kun jätevedet tämä nykyinen.
nyrkkisääntönä:
anodin pituus määrittää, kuinka paljon anodilla saadaan aikaan virtaa ja näin ollen kuinka monta neliöjalkaa terästä voidaan suojata. Poikkileikkaus (paino) määrittää, kuinka kauan anodi voi ylläpitää tätä suojaustasoa.,
vaikuttunut-nykyiset katodisuojajärjestelmät (ICCP-anodijärjestelmät)
monissa merivesijärjestelmissä mukana olevien suurten virtausten vuoksi ei ole harvinaista käyttää vaikuttuneita virtajärjestelmiä, joissa käytetään sellaisia anodeja (ICCP-anodeja), jotka eivät liukene helposti metalli-ioneiksi. Tämä aiheuttaa vaihtoehtoisen reaktion: liuenneiden kloridi-ionien hapettumisen.
2cl- => Cl2 + 2E-
teho toimitetaan ulkoisella TASAVIRTAYKSIKÖLLÄ.,

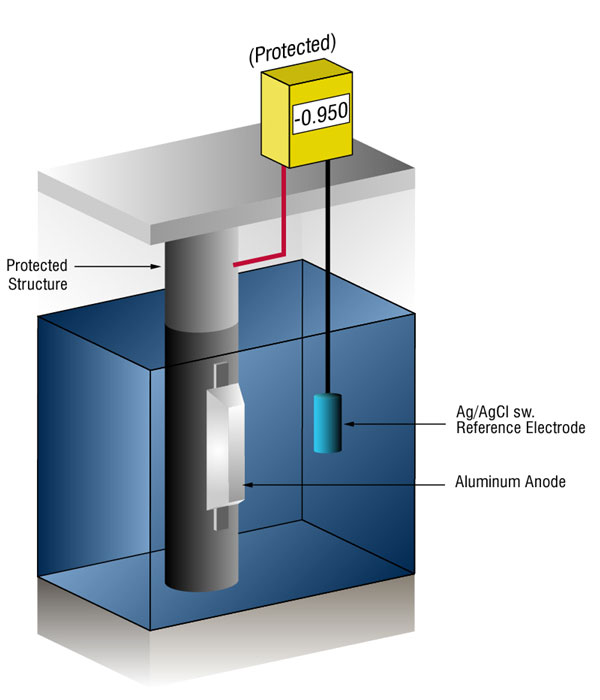
Kuinka me tiedämme, milloin olemme tarpeeksi katodinen suojaus?
voimme varmistaa, että virtaa on riittävästi mittaamalla teräksen potentiaali standardia vertailuelektrodia, yleensä hopeaa/kloridia (Ag/AgCl sw.), mutta joskus sinkki (sw.).
virtausvirta mille tahansa metallille siirtää normaalin potentiaalinsa negatiiviseen suuntaan. Historia on osoittanut, että jos teräs saa tarpeeksi virtaa siirtää potentiaalia ( – ) 0,800 vs., silver / silver chloride (Ag / AgCl), the corrosion is essentially stopped.
 |
 |