Learning Objectives
- saadakseen käsityksen törmäysteoriasta.
- saadakseen käsityksen neljästä pääasiallisesta tekijästä, jotka vaikuttavat reaktionopeuteen.
Reaktiokinetiikka on kemiallisten reaktioiden nopeustutkimus, ja reaktionopeudet voivat vaihdella suuresti useilla eri aikavaaoilla. Jotkin reaktiot voivat edetä räjähdysmäisesti nopeasti, kuten ilotulitteiden räjähtäminen (Kuva 17.,1 ”ilotulitus yöllä joen yllä”), kun taas toiset voivat esiintyä hitaalla nopeudella useiden vuosien ajan, kuten alkuaineille altistuneen piikkilangan ruostuminen (Kuva 17.2 ”ruostunut piikkilanka”).
kuva 17. 1. Ilotulitus Yöllä Yli Joen

kemiallinen reaktio ilotulitus tapahtuu räjähtävä tahtiin.
kuva 17. 2. Ruostunut piikkilanka

piikkilangan ruostuminen tapahtuu monen vuoden aikana.,
Törmäys Teoria,
ymmärtää, kinetiikka kemiallisia reaktioita, ja tekijät, jotka vaikuttavat kinetiikka, meidän pitäisi ensin tutkia, mitä tapahtuu aikana reaktio molekyylitasolla. Reaktiivisuuden törmäysteorian mukaan reaktiot syntyvät, kun reaktanttimolekyylit ”törmäävät tehokkaasti toisiinsa.”Sillä ”tehokas törmäys” esiintyy reagoivien aineiden molekyylit on suuntautunut avaruudessa oikein helpottaa rikkomatta ja muodostaa joukkovelkakirjojen ja uudelleenjärjestely atomit, jotka johtavat muodostumista tuotteen molekyylit (Kuva 17.3 ”Törmäys Visualisointeja”).
kuva 17.3., Törmäys Visualisointeja,
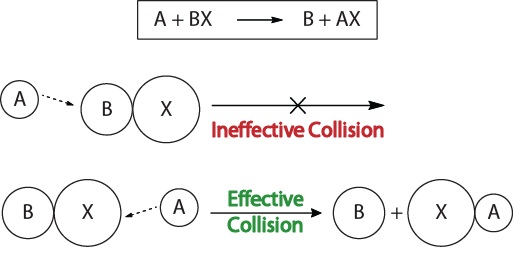
Tämä visualisointi osoittaa, tehoton ja tehokas törmäys, joka perustuu molekyylien suuntautumisen.
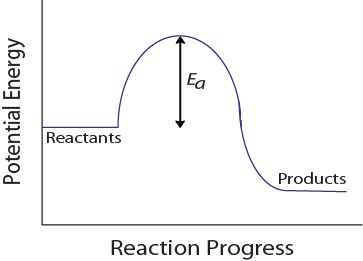
molekyylitörmäyksessä molekyyleillä on oltava myös minimimäärä liike-energiaa tehokkaan törmäyksen aikaansaamiseksi. Tämä energia vaihtelee kunkin reaktion osalta, ja sitä kutsutaan aktivaatioenergiaksi (EA) (Kuva 17.4 ”potentiaalienergia ja Aktivaatioenergia”)., Reaktionopeus riippuu siis siitä, aktivointi energia; suurempi aktivointi energia tarkoittaa, että vähemmän molekyylejä on riittävästi energiaa suorittaa tehokas törmäys.
kuva 17. 4. Potentiaalienergia ja Aktivaatioenergia
nopeuteen
vaikuttavia tekijöitä on neljä päätekijää, jotka voivat vaikuttaa kemiallisen reaktion reaktionopeuteen:
1. Reaktantin pitoisuus., Yhden tai useamman reaktantin pitoisuuden lisääminen lisää usein reaktionopeutta. Tämä tapahtuu, koska korkeampi pitoisuus lähtöaineen johtaa enemmän törmäyksiä, että lähtöaineen tietyn ajan kuluessa.
2. Reaktanttien fyysinen tila ja pinta-ala. Jos reaktanttimolekyylejä on eri faaseissa, kuten heterogeenisessä seoksessa, reaktionopeutta rajoittaa kosketuksessa olevien faasien pinta-ala., Jos esimerkiksi kiinteä metallireaktantti ja kaasun reaktantti sekoitetaan keskenään, vain metallin pinnalla olevat molekyylit pystyvät törmäämään kaasumolekyyleihin. Siksi kasvava pinta-ala metalli hakkaa se taulu tai leikkaamalla sen moneen osaan kasvattaa reaktionopeutta.
3. Lämpötila. Lämpötilan nousu nostaa tyypillisesti reaktionopeutta. Lämpötilan nousu nostaa reaktanttimolekyylien keskimääräistä liike-energiaa., Siksi suuremmalla osalla molekyyleistä on tehokkaan törmäyksen edellyttämä pienin energia (Kuva. 17,5 ”lämpötila ja reaktionopeus”).
kuva. 17.5 Lämpötila ja reaktionopeutta
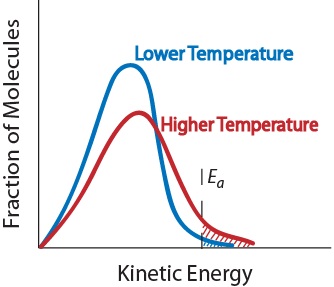
4. Katalyytin läsnäolo. Katalyytti on aine, joka kiihdyttää reaktiota osallistumalla siihen kuluttamatta. Katalyytit muodostavat vaihtoehtoisen reaktioreitin tuotteiden saamiseksi., Ne ovat kriittisiä monille biokemiallisille reaktioille. Niitä tarkastellaan tarkemmin jaksossa ” katalyysi.”
Key Takeaways
- – reaktiot tapahtuvat, kun kaksi reaktanttimolekyyliä törmäävät tehokkaasti toisiinsa, joilla kullakin on minimienergia ja oikea suunta.
- Lähtöaineen pitoisuus, olomuoto reagenssit, ja pinta-ala, lämpötila, ja katalyytin läsnä ollessa ovat neljä tärkeimmät tekijät, jotka vaikuttavat reaktionopeutta.