10.2 Brønsted-Lowryn Määritelmä Hapot ja Emäkset
Oppimisen Tavoitteet
- Tunnistaa yhdiste Brønsted-Lowry happo tai Brønsted-Lowry pohja.
- kuvaa protonin siirtoprosessia, joka määrittelee Brønsted-Lowryn happo-emäsreaktion.
Ammoniakki (NH3) lisää hydroksidi-ioni konsentraatio vesiliuoksessa reagoimalla veden sijaan vapautuu hydroksidi-ioneja suoraan., Arrheniuksen määritelmät haposta ja emäksestä keskittyvätkin vetyioneihin ja hydroksidi-ioneihin. Onko hapoille ja emäksille olemassa perusteellisempia määritelmiä?
vuonna 1923 Tanskalainen tiedemies Johannes Brønsted ja englantilainen tiedemies Thomas Lowry ehdottivat itsenäisesti uusia määritelmiä hapoille ja emäksille. Sen sijaan, että ne ottaisivat huomioon sekä vety-että hydroksidi-ionit, ne keskittyivät vain vetyioniin. Brønsted-Lowry acidA-yhdiste, joka toimittaa reaktiossa vetyionia (H+); protonin luovuttaja. on yhdiste, joka toimittaa vety-ionin reaktiossa., Brønsted-Lowry baseA-yhdiste, joka hyväksyy vety-ionin (H+) reaktiossa; protonin hyväksyjä. vastaavasti on yhdiste, joka hyväksyy reaktiossa vety-ionin. Näin ollen Brønsted-Lowry määritelmät hapon ja emäksen keskittyä liikkeen vety ionien reaktiota, eikä tuotanto vety-ioneja ja hydroksidi-ioneja vesiliuoksessa.
käyttäkäämme ammoniakin reaktiota vedessä osoittaaksemme hapon ja emäksen Brønsted-Lowry-määritelmät., Ammoniakki ja vesimolekyylit ovat reaktantteja, kun taas ammoniumioni ja hydroksidi−ioni ovat tuotteita:
NH3(aq) + H2O(ℓ) → NH4+(aq) + OH – (aq)
mitä tässä reaktiossa on tapahtunut on se, että alkuperäinen vesimolekyyli on lahjoittanut vetyionin alkuperäiseen ammoniakkimolekyyliin, joka puolestaan on hyväksynyt vetyionin. Voimme havainnollistaa tätä seuraavasti:
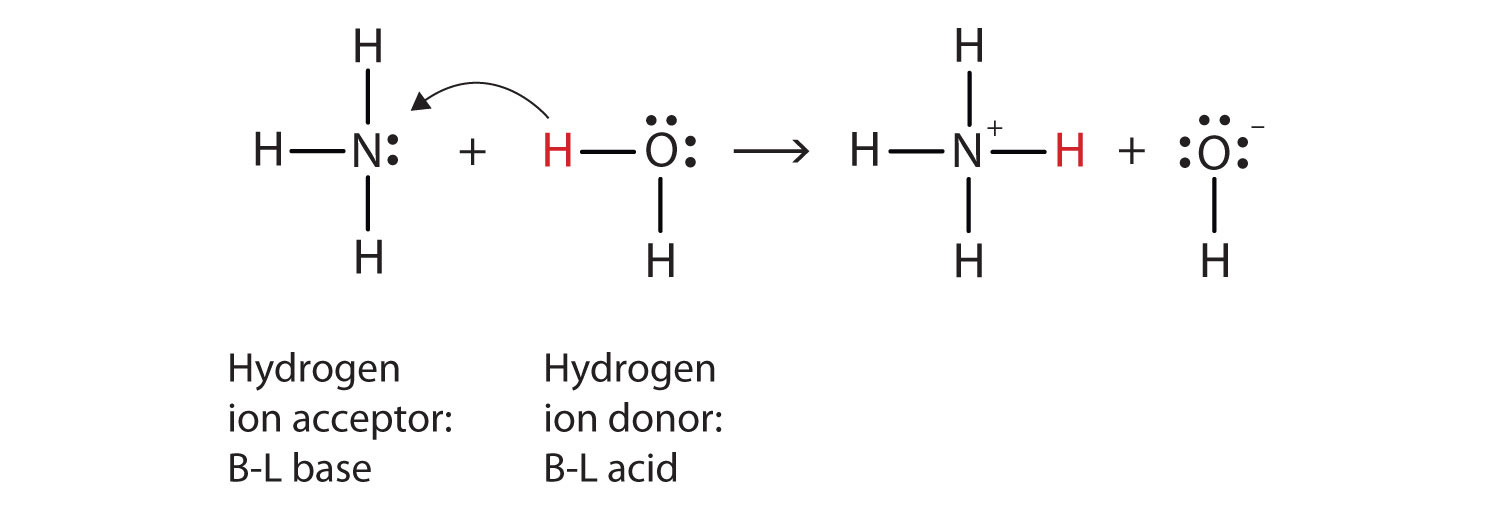
koska vesimolekyyli luovuttaa vetyionin ammoniakille, se on Brønsted-Lowry happo, kun taas ammoniakkimolekyyli—joka hyväksyy vetyionin—on Brønsted-Lowry-emäs., Näin ammoniakki toimii pohjana sekä Arrheniuksen että Brønsted-Lowryn merkityksessä.
Onko suolahapon kaltainen Arrheniushappo vielä Brønsted-Lowry-merkityksessä happo? Kyllä, mutta se vaatii meitä ymmärtämään, mitä todella tapahtuu, kun HCl liuotetaan veteen. Muista, että vetyatomi on yksi protoni, jota ympäröi yksi elektroni. Vetyioniksi poistamme elektronin, jolloin jäljelle jää paljas protoni. Onko meillä todella paljaita protoneja kellumassa vesiliuoksessa? Ei ole., Todellisuudessa H+ – ioni kiinnittyy H2O: hon tehdäkseen H3O+: n, jota kutsutaan hydroniumioniksi. Useimmissa tarkoituksissa H+ ja H3O+ edustavat samaa lajia, mutta H3O+: n kirjoittaminen H+: n sijaan osoittaa, että ymmärrämme, ettei liuoksessa kellu paljaita protoneja. Sen sijaan nämä protonit ovat itse asiassa kiinnittyneet liuotinmolekyyleihin.
Huom!
protonin vesiliuoksessa voi olla ympäröi useampi kuin yksi vesimolekyyli, joka johtaa kaavoja, kuten H5O2+ tai H9O4+ sijaan H3O+. On kuitenkin yksinkertaisempaa käyttää H3O+: ta.,
tätä ajatellen, miten määrittelemme HCl: n hapoksi Brønsted-Lowry-merkityksessä? Mieti, mitä tapahtuu, kun HCl liuotetaan H2O: ssa:
HCl + H2O(ℓ) → H3O+(aq) + Cl−(aq)
voimme kuvata tätä prosessia Lewis electron dot-diagrammeilla:
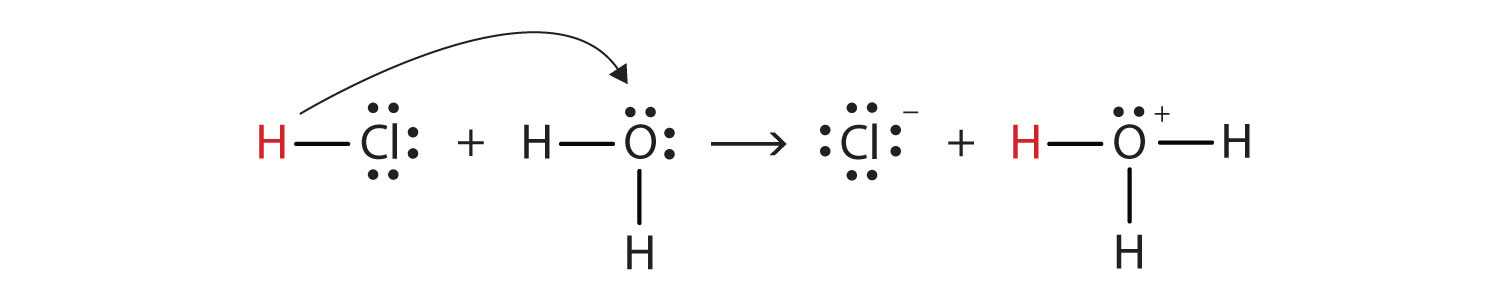
nyt näemme, että vetyioni siirtyy HCl-molekyylistä H2o-molekyyliin kloridi-ja hydroniumionien valmistamiseksi. Vetyionien luovuttajana HCl toimii Brønsted-Lowryhappona; vetyionien vastaanottajana H2O on Brønsted-Lowry-emäs., HCl on siis happo Arrheniuksen lisäksi myös Brønsted-Lowry-merkityksessä. Lisäksi Brønsted-Lowry-määritelmillä H2O on emäs vesipitoisen HCl: n muodostumisessa. Niinpä hapon ja emäksen Brønsted-Lowry-määritelmät luokittelevat HCl: n liuottamisen veteen hapon ja emäksen väliseksi reaktioksi—vaikka Arrheniuksen määritelmä ei olisi tässä tilanteessa leimannut H2O: ta emäkseksi.
Huom!
Kaikki Arrhenius hapot ja emäkset ovat Brønsted-Lowry hapot ja emäkset sekä. Kaikki Brønsted-Lowry-hapot ja emäkset eivät kuitenkaan ole Arrhenius-happoja ja emäksiä.,
esimerkki 3
aniliini (C6H5NH2) liukenee hieman veteen. Siinä on typpiatomi,joka voi hyväksyä vetyionin vesimolekyylistä aivan kuten ammoniakin typpiatomi. Kirjoita reaktion kemiallinen yhtälö ja tunnista Brønsted-Lowry happo ja emäs.
liuos
C6H5NH2 ja H2O ovat reaktantteja. Kun C6H5NH2 hyväksyy protonin H2O: sta, se saa ylimääräisen H: n ja positiivisen varauksen ja jättää OH− ionin taakseen., Reaktio on seuraava:
C6H5NH2(aq) + H2O(ℓ) → C6H5NH3+(aq) + OH−(aq)
Koska C6H5NH2 hyväksyy protoni, se on Brønsted-Lowry pohja. Koska H2o-molekyyli luovuttaa protonin, se on Brønsted-Lowry-happo.
Taito-Rakennus Liikunta
-
Kofeiini (C8H10N4O2) on nautintoaine löytyy kahvia ja teetä. Veteen liuetessaan se voi hyväksyä vesimolekyylistä protonin. Kirjoita tämän prosessin kemiallinen yhtälö ja tunnista Brønsted-Lowry happo ja emäs.,
hapon ja emäksen Brønsted-Lowry-määritelmiä voidaan soveltaa kemiallisiin reaktioihin, joita esiintyy muissa liuottimissa kuin vedessä. Seuraava esimerkki valaisee asiaa.
esimerkki 4
Natriumamidi (NaNH2) liukenee metanoliin (CH3OH) ja hajoaa natriumioneiksi ja amidi−ioneiksi (NH2 -). Amidi-ionit reagoivat metanolin kanssa muodostaen ammoniakkia ja metoksidi−Ionia (CH3O -). Kirjoita tälle prosessille tasapainoinen kemiallinen yhtälö ja tunnista Brønsted-Lowry happo ja emäs.,
liuos
reaktion yhtälö on NH2− ja CH3OH: n välillä, jotta NH3 ja CH3O− on seuraava:
NH2−(solv) + CH3OH(ℓ) → NH3(solv) + CH3O−(solv)
etiketti (solv) osoittaa, että laji liukenee johonkin liuottimeen toisin kuin (aq), joka määrittää vesipitoisen (H2O) liuoksen. Tässä reaktiossa näemme, että NH2− ioni hyväksyy protonin CH3OH-molekyylistä tehdäkseen NH3-molekyylin. Protonin hyväksyjänä NH2 – on siis Brønsted-Lowry-tukikohta. Protonin luovuttajana CH3OH on Brønsted-Lowry-happo.,
Taito-Rakennus Liikunta
-
Pyridinium kloridi (C5H5NHCl) liukenee etanoliin (C2H5OH) ja erottaa osaksi pyridinium ioneja (C5H5NH+) ja kloridi-ioneja. Pyridiniumioni voi siirtää vetyionin liuotinmolekyyliin. Kirjoita tälle prosessille tasapainoinen kemiallinen yhtälö ja tunnista Brønsted-Lowry happo ja emäs.
terveydellesi: Brønsted-Lowry Acid-Base Reactions in Pharmaceuticals
Brønsted-Lowry acid-base reactions in pharmaceutical industry
on monia mielenkiintoisia sovelluksia Brønsted-Lowry acid-base reactions., Esimerkiksi lääkkeiden on usein oltava vesiliukoisia maksimaalisen tehokkuuden varmistamiseksi. Monet kompleksiset orgaaniset yhdisteet eivät kuitenkaan ole liukoisia tai ne liukenevat veteen vain vähän. Onneksi niihin lääkkeisiin, jotka sisältävät protonia hyväksyviä typpiatomeja (ja niitä on paljon), voidaan reagoida laimealla suolahapolla . Typpiatomit-jotka toimivat Brønsted-Lowry-emäksinä-hyväksyvät haposta vetyionit ioniksi, joka yleensä liukenee paljon paremmin veteen., Muutettu huumeiden molekyylejä voi sitten olla eristetty kloridisuolat:
RN(sl aq) + H+(aq) → RNH+(aq) →Cl−(aq) RNHCl(s)
jos RN edustaa joitakin orgaanisia yhdisteitä, jotka sisältävät typpeä. Etiketti (sl aq) tarkoittaa ”hieman vesiliuosta,” mikä osoittaa, että yhdiste RN on vain hieman liukenee. Näin muokattuja lääkkeitä kutsutaan hydrokloridisuoloiksi. Esimerkkeinä voidaan mainita voimakas kipulääke kodeiini, jota käytetään yleisesti kodeiinihydrokloridina. Myös muita happoja kuin suolahappoa käytetään. Esimerkiksi hydrobromihaposta saadaan hydrobromidisuoloja., Dekstrometorfaania, joka on monien yskänlääkkeiden ainesosa, annostellaan dekstrometorfaanihydrobromidina. Oheisessa kuvassa näkyy toinen lääkitys hydrokloridisuolana.
tämän lääkkeen nimi tekee selväksi, että sitä on hydrokloridisuolana.
© Thinkstock
Concept Review Exercise
-
antavat Brønsted-Lowry-hapon ja Brønsted-Lowry-emäksen määritelmät.,
Vastaus
-
Brønsted-Lowry happo on protonin luovuttaja, kun Brønsted-Lowry pohja on protonin tunnustaja.
Key Takeaways
- a Brønsted-Lowry happo on protonin luovuttaja, ja Brønsted-Lowry pohja on protonin tunnustaja.
- Brønsted-Lowryn happo-emäsreaktiot ovat olennaisesti protoninsiirtoreaktioita.
harjoitukset
-
leimaavat kukin reaktiivisen Brønsted-Lowryhapoksi tai Brønsted-Lowry-emäkseksi.,
HCl (aq) + NH3(AQ) → NH4 + (AQ) + Cl−(AQ)
-
Label kunkin reaktiivinen kuin Brønsted-Lowry happo tai Brønsted-Lowry pohja.
H2o(ℓ)+n2h4(AQ) → N2H5 + (aq) + OH−(AQ)
-
selitä, miksi Brønsted-Lowryn emästä voidaan kutsua protonihyvittäjäksi.
-
Kirjoita ammoniakin reaktion kemiallinen yhtälö veteen ja merkitse Brønsted-Lowry happo ja emäs.,
-
Kirjoita veteen metyyliamiinin (CH3NH2) reaktion kemiallinen yhtälö ja merkitse Brønsted-Lowry happo ja emäs.
-
osoittavat, että HNO3: n liukeneminen veteen on itse asiassa Brønsted-Lowry-happo-emäsreaktio kuvaamalla sitä kemiallisella yhtälöllä ja merkitsemällä Brønsted-Lowry-happo ja emäs.,
-
Jos kodeiinihydrobromidin formula_18h22brno3, mikä on kantayhdisteen kodeiinin kaava?,
selitä, miksi Brønsted-Lowryhappoa voidaan kutsua protoninluovuttajaksi.
tunnista Brønsted-Lowryhappo ja emäs seuraavassa kemiallisessa yhtälössä:
c3h7nh2(aq) + H3O+(aq) → C3H7NH3+(aq) + H2O(ℓ)
Kirjoita kemiallinen yhtälö reaktiolle, joka tapahtuu kokaiinihydrokloridin (C17H22ClNO4) liukenee veteen ja luovuttaa protonin vesimolekyylille. (Kun osittain halogenidit liukenevat veteen, ne erkanevat kloridi-ioneiksi ja sopiviksi kationeiksi.)