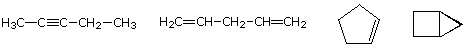Johdanto
Alkeenit ja alkynes ovat hiilivetyjä, jotka vastaavasti ovat hiili-hiili-kaksoissidos ja hiili-hiili-triple bond toiminnallisia ryhmiä. Näiden tyydyttymättömien hiilivetyjen molekyylikaavat heijastavat funktionaalisten ryhmien moninkertaista sidosta:
Alkeenit nimetään ikään kuin ne olisivat alkaaneja, mutta ”-ane”- suffiksi muutetaan ”- eeni”., Jos alkeenissa on vain yksi kaksoissidos ja että kaksoissidos on terminaalinen (kaksoissidos on molekyylin toisessa päässä tai toisessa), ei ole tarpeen sijoittaa mitään numeroa nimen eteen.,
butaani: C4H10 (CH3CH2CH2CH3)
buteeni: C4H8 (CH2=CHCH2CH3)
Jos kaksoissidos ei ole terminaalinen (jos se on hiilellä jossain ketjun keskellä) niin hiilet on numeroitava tällaisiin hiiliin tapa antaa ensimmäinen kahdesta kaksoissidotusta hiilestä pienin mahdollinen määrä, ja tämän luvun pitäisi edeltää ”ene”-päätettä viivalla, kuten alla on esitetty.,
oikein: pent-2-eeni (CH3CH=CHCH2CH3)
virheellinen: pent-3-eeni (CH3CH2CH=CHCH3)
toinen on virheellinen, koska kaavan kääntäminen vaakasuoraan johtaa alkeenille pienempään numeroon.
Jos alkeenissa on useampi kuin yksi kaksoissidos, kaikki sidokset on numeroitava molekyylin – jopa terminaalisen kaksoissidoksen nimissä. Numeroiden pitäisi mennä pienimmästä korkeimpaan, ja ne pitäisi erottaa toisistaan pilkulla. IUPAC: n numeerisia etuliitteitä käytetään ilmaisemaan kaksoissidosten lukumäärä.,
octa-2,4-dieeni: CH3CH=CHCH=CHCH2CH2CH3
deca-1,5-dieeni: CH2=CHCH2CH2CH=CHCH2CH2CH2CH3
Huomaa, että numerointi ”2-4” edellä tuotot molekyyli, jossa on kaksi kaksoissidosta, joita erottaa vain yksi sidos. Tällaisessa tilassa olevia kaksoissidoksia kutsutaan ”konjugoituneiksi”, ja ne edustavat konformaation vahvistunutta vakautta, joten niitä suositaan energeettisesti reaktantteina monissa tilanteissa ja yhdistelmissä.,
| Alkaani | CnH2n+2 | Tämä on maksimi H/C-suhde tietyn määrä hiiliatomeja. |
|---|---|---|
| Alkeeni | CnH2n | Jokainen kaksoissidos vähentää vety-atomit 2. |
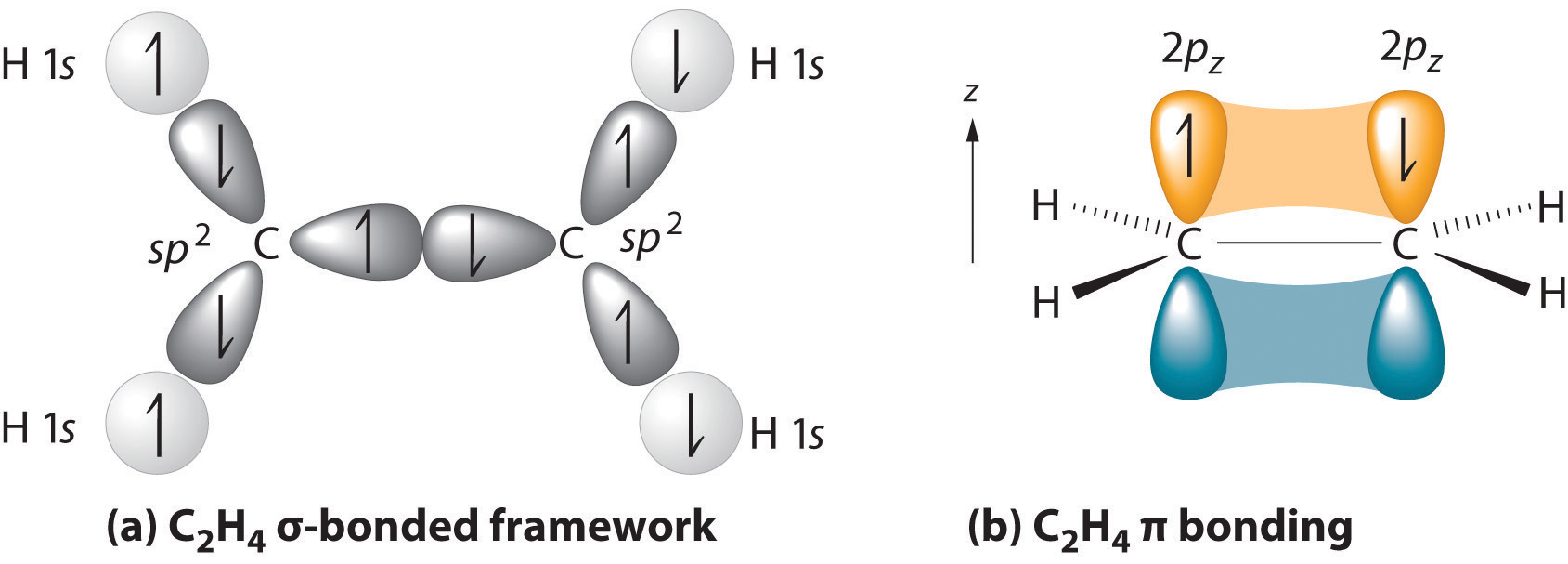
kantarakenne on pisin ketju, joka sisältää kaksoissidoksen molemmat hiiliatomit., Kaksoissidoksen kaksi hiiliatomia ja niihin kiinnittyneet neljä atomia sijaitsevat tasossa, jonka sidoskulmat ovat noin 120° A kaksoissidos koostuu yhdestä sigma-sidoksesta, joka muodostuu sp2 hybridiorbitaalien päällekkäisyyksistä ja yhdestä pii-sidoksesta, joka muodostuu yhdensuuntaisten 2 p orbitaalien
molekyyli-kaava hiilivety tarjoaa tietoa mahdollisista rakenteellisista tyypit se voi edustaa. Ajatellaan esimerkiksi yhdisteitä, joilla on formula_5h8., Viisihiilisen alkaanipentaanin kaava on C5H12, joten ero vetypitoisuudessa on 4. Tämä ero viittaa siihen, että tällaisilla yhdisteillä voi olla kolmoisliitos, kaksi kaksoissidosta, rengas ja kaksoissidos tai kaksi rengasta. Tässä on joitakin esimerkkejä, ja niitä on ainakin neljätoista!